Альвеско — инструкция по применению
Синонимы, аналоги
Статьи
В настоящее время препарат не числится в Государственном реестре лекарственных средств или указанный регистрационный номер исключен из реестра.
Регистрационный номер
ЛП-000823
Торговое наименование:
Альвеско®
Международное непатентованное название (МНН):
циклесонид
Лекарственная форма:
аэрозоль для ингаляций дозированный
Состав
Одно распыление содержит:
Активное вещество:
Дозировка 40 мкг: циклесонид 0,04 мг;
Дозировка 80 мкг: циклесонид 0,08 мг;
Дозировка 160 мкг: циклесонид 0,16 мг;
Вспомогательные вещества:
Дозировка 40 мкг: норфлуран (HFА-134а) 54,51 мг, этанол 4,74 мг;
Дозировка 80 мкг: норфлуран (HFА-134а) 54,46 мг, этанол 4,74 мг;
Дозировка 160 мкг: норфлуран (HFА-134а) 54,37 мг, этанол 4,73 мг.
Описание:
бесцветный прозрачный раствор в алюминиевом баллончике.
Фармакотерапевтическая группа:
глюкокортикостероид для местного применения.
Код АТХ
R03BA08
Фармакологическое действие
Фармакодинамика
Циклесонид проявляет низкое сродство к глюкокортикостероидным рецепторам. После ингаляции он с помощью ферментов превращается в легких в основной метаболит (дезциклесонид,
С21-дезметилпропионилциклесонид), который обладает выраженной противовоспалительной активностью и поэтому считается активным метаболитом.
Циклесонид подавляет воспалительные реакции в дыхательных путях и, таким образом, ослабляет симптомы бронхиальной астмы, улучшает функцию легких.
Фармакокинетика
Всасывание
Пероральное или внутривенное введение меченного радиоактивным изотопом циклесонида показало, что степень абсорбции составляет 24,5 %. При приеме препарата внутрь биодоступность как циклесонида, так и активного метаболита незначительна (< 0,5 % для циклесонида, и < 1 % для метаболита) в связи со значительным влиянием пресистемного метаболизма. Накопление циклесонида у здоровых пациентов в легких -свыше 50 %. В соответствии с этой цифрой системная биодоступность для активного метаболита после ингаляционной дозы -свыше 50 %. Так как биодоступность активного метаболита при приеме циклесонида внутрь менее 1 %, принятая доля ингаляционного средства не оказывает системного воздействия.
Распределение
После внутривенного введения здоровым пациентам циклесонид быстро распределяется вследствие его высокой липофильности. Объем распределения составляет в среднем 2,9 л/кг для циклесонида и 12,1 л/кг для дезциклесонида. Процент циклесонида, связанного с белками плазмы — около 99 %, и процент активного метаболита — 98 — 99 % показывают почти полное связывание циркулирующего циклесонида/активного метаболита с белками плазмы.
Метаболизм
Циклесонид гидролизуется до биологически активного метаболита посредством фермента эстеразы в легких. Активный метаболит циклесонида, главным образом, метаболизируется до гидроксилированных неактивных метаболитов посредством катализа с участием изофермента CYP3A4. Клиренс циклесонида составляет около 152 л/час и дезциклесонида — около 228 л/час, что свидетельствует о высокой степени экстракции вещества печенью.
Выведение
Циклесонид выводится, главным образом, с калом, как после перорального, так и после внутривенного введения, что говорит о преимущественном выделении его с желчью.
Фармакокинетика у отдельных групп пациентов
Пациенты с почечной или печеночной недостаточностью, пожилые пациенты
Корректировка дозы у данной группы пациентов не требуется.
Так как активный метаболит не выводится через почки, исследования у пациентов с ослабленной почечной функцией не проводились.
У пациентов с печеночной недостаточностью были отмечены удлиненный период полувыведения и небольшое увеличение времени удержания дезциклесонида (активного метаболита) в крови. Вследствие чего не исключается накопление этого вещества при приеме препарата в высоких дозах.
Дети
Фармакокинетические параметры дезциклесонида идентичны для детей и взрослых.
Показания к применению
Бронхиальная астма.
Противопоказания
Повышенная чувствительность к препарату, возраст до 6 лет.
С осторожностью:
— у пациентов с легочным туберкулезом в активной или хронической форме;
— у пациентов с бактериальными, вирусными или грибковыми инфекциями дыхательных путей.
Применение во время беременности и в период лактации
Контролируемые исследования у беременных женщин не проводились. Тем не менее, после ингаляционного приема препарата концентрация циклесонида в сыворотке крови очень низкая, следовательно, воздействие на эмбрион и потенциальная токсичность, влияющая на репродуктивную функцию незначительны. Выделение циклесонида или его метаболитов через грудное молоко не исследовалось.
Как и другие ингаляционные глюкокортикостероиды, циклесонид может применяться во время беременности и лактации по назначению врача, если ожидаемый лечебный эффект превышает риск развития возможных побочных эффектов. Новорожденные от матерей, леченных глюкокортикостероидами, должны находиться под наблюдением врача для исключения гипофункции надпочечников.
Способ применения и дозы
Альвеско® применяют только для пероральной ингаляции.
Альвеско® должен приниматься в течение длительного периода времени ежедневно.
Альвеско® дозируют индивидуально. Начальная доза должна быть подобрана в зависимости от тяжести состояния. При достижении желаемого клинического эффекта, дозу следует снизить до минимальной, необходимой для контролирования проявлений заболевания.
Взрослые, пожилые пациенты и подростки старше 12 лет
Астма от легкой до средней степени тяжести: Рекомендованная ежедневная доза составляет от 160 мкг до 640 мкг; дозу 640 мкг следует делить на два приема в день.
Тяжелая степень астмы: Доза может быть увеличена максимально до 2 x 640 мкг ежедневно.
Улучшение проявлений заболевания наступает в течение 24 часов после приема Альвеско®. Предполагается, что максимальный эффект от лечения — как и с другими ингаляционными глюкокортикостероидами — достигается после 2-3 месячного применения препарата.
Пациенты не должны прекращать лечение, даже при отсутствии симптомов астмы.
Дети старше 6 лет
Рекомендованная ежедневная доза 80 — 160 мкг однократно или 80 мкг дважды в день.
Альвеско® может использоваться со спейсером или без него. Если использование спейсера необходимо, рекомендуется применять спейсер AeroChamberPlus.
Указания по отдельным случаям
Нет необходимости корректировать дозу для пожилых пациентов или пациентов с печеночной или почечной недостаточностью.
Взрослые и подростки, постоянно принимающие пероральные глюкокортикостероиды
У пациентов с тяжелым течением бронхиальной астмы, которые зависят от пероральной терапии глюкокортикостероидами (например, преднизолоном), доза Альвеско® составляет 640 мкг дважды в день.
Для перевода пациентов с перорального глюкокортикостероида на Альвеско®, пациенты должны находиться в стадии ремиссии. Доза Альвеско® (640 мкг дважды в день) должна применяться в течение 10 дней в комбинации с пероральным глюкокортикостероидом. Доза перорального глюкокортикостероида должна затем постепенно снижаться каждую неделю до как можно более низкого уровня, с уменьшением ежедневной дозы не более, чем на 2,5 мг каждый раз.
Инструкция по использованию ингалятора
Пациенты должны быть проинструктированы о правильном обращении с ингалятором.
Если ингалятор новый или не использовался более одной недели, то первые три нажатия клапана должны быть выполнены в воздух. Нет никакой необходимости встряхивания баллона, так как это растворенный аэрозоль.
Тщательно следуйте этим инструкциям и используйте картинки в качестве руководства.
1. Снимите защитный колпачок с пульверизатора и проверьте мундштук внутри и снаружи. Убедитесь, что он чистый и сухой.
2. Переверните ингалятор дном вверх (дном баллона вверх), расположите свой указательный палец на дне баллона, а большой палец — под мундштуком.
3. Сделайте максимальный выдох настолько, насколько это возможно. Не выдыхайте в ингалятор.
4. Поместите мундштук в рот и сомкните губы вокруг него.
5. Только после того, как Вы начали вдыхать, нажмите указательным пальцем на верхушку ингалятора для высвобождения лекарства во время Вашего медленного и глубокого вдоха. Позаботьтесь о том, чтобы лекарство не могло пройти через пространство между губами и мундштуком.
6. Задержите дыхание, удалите мундштук изо рта и снимите палец с верхушки ингалятора. Продолжайте задерживать дыхание в течение приблизительно 10 секунд или насколько сможете дольше. Медленно выдохните через рот. Избегайте выдыхать через мундштук.
Важно не торопиться во время проведения шагов 3 — 6.
7. Если Вам необходимо сделать дополнительный вдох, подождите полминуты и повторите шаги 3 — 6.
8. После использования всегда надевайте защитный колпачок для предохранения от пыли. Плотно закройте и зафиксируйте на месте.
9. В целях гигиены:
— пожалуйста, очищайте регулярно мундштук снаружи и внутри сухой салфеткой;
— используя сухую сложенную салфетку, протрите поверхность с маленьким отверстием, откуда выходит лекарство;
— не используйте воду или какую-либо другую жидкость.
Побочное действие
* идентичный или более низкий процент по сравнению с плацебо
** Сердцебиения наблюдались во время клинических исследований в случаях одновременного применения с препаратами, которые могут оказывать побочное действие на сердечный ритм (например, теофиллин или сальбутамол).
Парадоксальный бронхоспазм может встречаться непосредственно после ингаляции и являться неспецифической острой реакцией на любые ингаляционные медицинские препараты, которая может быть связана с активным веществом, вспомогательными веществами или охлаждением вследствие испарения пропеллента в случае применения дозируемых ингаляторов. В большинстве случаев, это — умеренно неблагоприятная реакция, которая не требует прекращения лечения Альвеско®, и которая может пройти сама.
Ингаляционные глюкокортикостероиды могут давать системные эффекты, особенно при высоких дозах, прописанных на длительный период. Возможные системные эффекты включают синдром Кушинга и кушингоподобные симптомы, такие как угнетение функции надпочечников (подавление надпочечников), замедление роста у детей и подростков, уменьшение плотности кости, катаракту и глаукому. Именно поэтому важно, чтобы доза ингаляционного глюкокортикостероида снижалась до наименьшей, при которой ведется удовлетворительный контроль за проявлениями заболевания.
Передозировка
Острая
Ингаляционное применение однократной дозы 2880 мкг циклесонида у здоровых добровольцев переносилось хорошо. Возможность острых токсических эффектов вслед за передозировкой ингаляционного циклесонида низка.
Возможно усиление сухости слизистой оболочки полости рта и глотки, ощущения раздражения или першения в горле, дисфонии.
Лечение: После острой передозировки необходимость специфического лечения отсутствует.
Хроническая
После продолжительного введения 1280 мкг циклесонида не наблюдалось клинических признаков подавления надпочечников. Однако, если превышение рекомендованной дозы продолжается в течение сверхдлительного периода времени, некоторая степень подавления надпочечников не может быть исключена.
Лечение: Рекомендуется контролировать функцию надпочечников. В случаях передозировки Альвеско® терапия может быть продолжена дозой, достаточной для поддержания терапевтического эффекта.
Взаимодействие с другими лекарственными средствами
Данные in vitro показывают, что изофермент CYP3A4 является основным ферментом, вовлеченным в метаболизм активного метаболита циклесонида — M1 (дезциклесонида) у человека.
В исследованиях лекарственных взаимодействий между циклесонидом и кетоконазолом, в качестве мощного ингибитора изофермента CYP3A4, влияние на активный метаболит дезциклесонид увеличивалось примерно в 3,5 раза, тогда как влияния на циклесонид отмечено не было.
Исходя из этого, следует избегать одновременного применения потенциальных ингибиторов изофермента CYP3A4 и циклесонида.
Исследование взаимодействия циклесонида и субстрата эритромицина изофермента CYP3A4 не показало никаких взаимодействий между двумя веществами.
Особые указания
Альвеско® не показан для лечения астматического статуса или других острых эпизодов астмы, требующих интенсивных терапевтических мер.
Действие ингаляционных глюкокортикостероидов при длительном применении у детей до конца не выяснено.
Врач должен постоянно наблюдать за развитием роста детей, принимающих глюкокортикостероиды в течение длительного периода. Если рост замедляется, терапия должна быть пересмотрена с целью уменьшения дозы ингаляционного глюкокортикостероида. Если возможно, то до наименьшей дозы, с помощью которой поддерживается постоянный контроль за проявлениями астмы.
Доза Альвеско® может быть уменьшена у пациентов, нуждающихся в пероральных глюкокортикостероидах.
Для пациентов, переведенных с пероральной глюкокортикоидной терапии на ингаляционное лечение Альвеско®, может сохраняться снижение функции коры надпочечников в течение значительного периода времени после перевода. Возможность развития нежелательных эффектов от применения пероральных глюкокортикостероидов может сохраняться в течение некоторого времени после их отмены. В подобных случаях рекомендуется проводить контроль резервной функции коры надпочечников. Всегда должна приниматься во внимание возможность остаточного ухудшения адренокортикального отклика в критической ситуации (терапевтической или хирургической) и в других индивидуальных случаях, которые могут быть вызваны стрессовой реакцией, вследствие чего следует начинать соответствующее глюкокортикостероидное лечение.
В случае недостаточности адренокортикального отклика или серьезных обострений дозу Альвеско® следует увеличить; если необходимо, следует применять пероральные глюкокортикостероиды. В случае инфекции должны использоваться антибиотики. Парадоксальный бронхоспазм с усилением хрипов и другие симптомы сужения бронхов, появившиеся непосредственно после ингаляции, должны лечиться с помощью быстродействующего бронхорасширяющего средства, что обычно приводит к быстрому облегчению. Пациент должен быть осмотрен, и терапия с Альвеско® должна продолжаться только в том случае, если, после взвешенного рассмотрения, ожидаемый эффект выше, чем возможный риск. Должна быть принята во внимание взаимосвязь между степенью тяжести астмы и общей предрасположенностью к острым бронхиальным реакциям.
Перевод пациентов, принимавших пероральные глюкокортикостероиды, на Альвеско®
Перевод пациентов, получавших лечение пероральными глюкокортикостероидами, на Альвеско® и их последующее ведение нуждается во внимании, так как восстановление сниженной функции надпочечников, вызванной продолжительной систематической глюкокортикостероидной терапией, может занять некоторое время.
У пациентов, принимавших системные глюкокортикостероиды в течение длительного периода времени, или в высокой дозе, может наблюдаться подавление функции надпочечников. Функция надпочечников этих пациентов должна отслеживаться регулярно, и доза системных глюкокортикостероидов должна уменьшаться постепенно.
После приблизительно одной недели может быть начато постепенное исключение системных глюкокортикостероидов с уменьшением их ежедневной дозы на 1 мг преднизолона, или его эквивалент. Для поддерживающей дозы преднизолона свыше 10 мг ежедневно, могут оказаться целесообразными осторожно предпринятые большие снижения дозы на протяжении недельных интервалов.
Некоторые пациенты могут плохо себя чувствовать во время отмены препарата, несмотря на сохранение или даже улучшение дыхательной функции. Их необходимо обследовать на адренокортикальную недостаточность.
При переводе пациентов с приема системных глюкокортикостероидов на ингаляционную терапию могут проявляться аллергические реакции (например, аллергический ринит, экзема), которые раньше подавлялись системными препаратами. Эти аллергии должны быть пролечены симптоматически антигистаминными средствами и/или средствами местного применения, включающими глюкокортикостероиды местного применения.
Влияние на способность управлять автотранспортными средствами и механизмами
Нет данных о влиянии препарата на способность управлять транспортными средствами и механизмами.
Форма выпуска
Аэрозоль для ингаляций дозированный 40 мкг/распыление, 80 мкг/распыление, 160 мкг/распыление. По 5 мл (60 распылений) или 8 мл (120 распылений) в алюминиевый баллончик с дозирующим клапаном и мундштуком с защитной крышкой. Баллончик вместе с инструкцией по применению помещают в картонную пачку.
Срок годности
3 года.
Не использовать после истечения срока годности, указанного на упаковке.
Условия хранения
Хранить при температуре не выше 25 °С.
Содержимое баллона находится под давлением.
Баллон нельзя вскрывать и подвергать нагреванию выше 50 °С.
Хранить в недоступном для детей месте.
Условия отпуска из аптек
По рецепту.
Наименование и юридический адрес держателя (владельца) регистрационного удостоверения
АстраЗенека АБ, SE-151 85 Содерталье, Швеция
AstraZeneca AB, SE-151 85 Sodertalje, Sweden
Производитель, фасовщик (первичная упаковка), упаковщик (вторичная (потребительская) упаковка)
3М Хелс Кеа Лимитед, Дерби Роад, Лафборо,
LE11 5SF Лестершир, Великобритания
3M Health Care Limited, Derby Road, Loughborough,
LE11 5SF Leicestershire, United Kingdom
Выпускающий контроль качества
Такеда ГмбХ, Роберт-Бош-Штрассе 8, 78224 Зинген, Германия
Takeda GmbH, Robert-Bosch-Strasse 8, 78224 Singen, Germany
Наименование, адрес организации, уполномоченной держателем или владельцем регистрационного удостоверения лекарственного препарата для медицинского применения на принятие претензий от потребителя:
Представительство компании АстраЗенека ЮК Лимитед, Великобритания, в г. Москве
и ООО АстраЗенека Фармасьютикалз 125284 Москва, ул. Беговая д.3, стр. 1
*Цены в Москве. Точная цена в Вашем городе будет указана на сайте аптеки.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Альвеско: инструкция по применению
Форма выпуска: Аэрозоль
Цены в аптеках: Минск
Уточняйте
Содержание
- Состав
- Описание
- Фармакологическое действие
- Фармакокинетика
- Показания к применению
- Противопоказания
- Беременность и период лактации
- Способ применения и дозы
- Побочное действие
- Передозировка
- Взаимодействие с другими лекарственными средствами
- Форма выпуска
- Условия хранения
- Срок годности
- Условия отпуска из аптек
Состав
Одна ингаляционная доза содержит
активное вещество- циклезонид 0,04 мг, 0,08 мг или 0,16 мг,
вспомогательные вещества:норфлуран (HFA–134а), этанол.
Описание
Бесцветный раствор
Фармакологическое действие
Альвеско имеет низкое сродство к рецепторам глюкокортикоидов (примерно в 8 раз ниже, чем у дексаметазона). После пероральной ингаляции циклезонид ферментативно преобразовывается в легких в активный метаболит, дез-циклезонид. Дез-циклезонид обладает выраженным противовоспалительным эффектом благодаря высокому сродству к рецепторам глюкокортикоидов(приблизительно в 12 раз выше, чем у дексаметазона).
Применение Альвеско® в рекомендованных дозах показывает удовлетворительное соотношение между местным противовоспалительным эффектом и системным эффектом кортикостероидов, что объясняетсяследующими фармакокинетическими и фармакодинамическими свойствами действующего вещества: высокий клиренс, незначительное содержание в тканях по сравнению с легкими, относительно короткий период полувыведения, низкая оральная биодоступность, высокий уровень связывания с протеином, низкое сродство метаболитов, кроме дез-циклезонида, и низкое взаимодействие с другими лекарственными средствами.
Длительное удержание дез-циклезонида в легких (до 24 часов) позволяет поддерживать потенциал однократного приема Альвеско®. Лечение ингаляционным циклезонидом также замедляет рост воспалительных клеток (общие эозинофилы) и воспалительных медиаторов в слюне.
Фармакокинетика
Пероральное или внутривенное введение меченного радиоактивным изотопом циклезонида показало, что при пероральном приеме степень абсорбции составляет 24.5%. При приеме препарата внутрь биодоступность как циклезонида, так и активного метаболита незначительна (<0.5% для циклезонида, и <1% для метаболита) в связи со значительным влиянием пресистемногометаболизма. Накопление циклезонида у здоровых пациентов в легких — свыше 50%. В соответствии с этой цифрой системная биодоступность для активного метаболита после ингаляционной дозы – свыше 50%. Так как биодоступность активного метаболита при приеме циклезонида внутрь менее 1%, принятая доля ингаляционного средства не оказывает системного воздействия.
После внутривенного введения здоровым пациентам циклезонид быстрораспределяется вследствие его высокой липофильности. Объем распределения составляет в среднем 2.9 л/кг дляциклезонида и 12.1 л/кг для дез-циклезонида. Процент циклезонида, связанного с белками плазмы крови, около 99%, и процент активного метаболита — 98-99%, показывают почти полное связывание циркулирующего циклезонида/активного метаболита с белками плазмы крови.
Циклезонид гидролизуется до биологически активного метаболита посредством фермента эстеразы в легких. Активный метаболит циклезонида, главным образом, метаболизируется догидроксилированных неактивных метаболитов посредством CYP3A4 катализа. Клиренс циклезонида составляет около 152 л/час и дез-циклезонида — около 228 л/час, чтосвидетельствует о высокой степени экстракции вещества печенью.
Циклезонид выводится, главным образом, с калом, как после перорального, так и после внутривенного введения, что говорит о преимущественном выделении его с желчью.
Фармакокинетика у отдельных групп пациентов
Пациенты с астмой
Фармакокинетика циклезонида у пациентов с легкой степенью астмы по сравнению со здоровыми пациентами не меняется.
Пациенты с почечной или печеночной недостаточностью, пожилые пациенты
Корректировка дозы у данной группы пациентов не требуется.
Так как активный метаболит не выводится через почки,исследования у пациентов с ослабленной почечной функцией не проводились.
У пациентов с печеночной недостаточностью были отмечены удлиненный период полувыведения и небольшое увеличение времени удержания дез-циклезонида (активного метаболита) в крови. Вследствие чего не исключается накопление этого вещества при приеме препарата в высоких дозах.
Показания к применению
бронхиальная астма
Цены в аптеках Минск
Альвеско, аэрозоль, 160 мкг / 1 доза 60 доз ×1
для ингаляций дозированный, Такеда, Япония • По рецепту
Нет в продаже
Альвеско, аэрозоль, 80 мкг / 1 доза 60 доз ×1
для ингаляций дозированный, Такеда, Япония • По рецепту
Нет в продаже
Описание препарата Альвеско® (аэрозоль для ингаляций дозированный, 160 мкг/доза) основано на официальной инструкции, утверждено компанией-производителем в 2015 году
Дата согласования: 29.09.2015
Особые отметки:
Содержание
- Фотографии упаковок
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Состав
- Описание лекарственной формы
- Фармакологическое действие
- Фармакодинамика
- Фармакокинетика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Производитель
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Аналоги (синонимы) препарата Альвеско®
Фотографии упаковок

29.09.2015

29.09.2015
Действующее вещество
ATX
Фармакологическая группа
Состав
| Аэрозоль для ингаляций дозированный | 1 распыление |
| активное вещество: | |
| циклесонид | 0,04 мг |
| 0,08 мг | |
| 0,16 мг | |
| вспомогательные вещества: норфлуран (HFA-134а) — 54,51/54,46/54,37 мг; этанол — 4,74/4,74/4,73 мг |
Описание лекарственной формы
Бесцветный прозрачный раствор в алюминиевом баллончике.
Фармакологическое действие
Фармакодинамика
Циклесонид проявляет низкое сродство к ГКС-рецепторам. После ингаляции он с помощью ферментов превращается в легких в основной метаболит (дезциклесонид, С21-дезметилпропионилциклесонид), который обладает выраженной противовоспалительной активностью и поэтому считается активным метаболитом.
Циклесонид подавляет воспалительные реакции в дыхательных путях и таким образом ослабляет симптомы бронхиальной астмы, улучшает функцию легких.
Фармакокинетика
Всасывание. Пероральное или в/в введение меченного радиоактивным изотопом циклесонида показало, что степень абсорбции составляет 24,5%. При приеме препарата внутрь биодоступность как циклесонида, так и активного метаболита незначительна (<0,5% — для циклесонида и <1% — для метаболита) в связи со значительным влиянием пресистемного метаболизма. Накопление циклесонида у здоровых пациентов в легких — свыше 50%. В соответствии с этой цифрой системная биодоступность для активного метаболита после ингаляционной дозы — свыше 50%. В связи с тем, что биодоступность активного метаболита при приеме циклесонида внутрь менее 1%, принятая доля ингаляционного средства не оказывает системного воздействия.
Распределение. После в/в введения здоровым пациентам циклесонид быстро распределяется вследствие его высокой липофильности. Vd составляет в среднем 2,9 л/кг — для циклесонида и 12,1 л/кг — для дезциклесонида. Связь с белками плазмы для циклесонида — около 99%, для активного метаболита — 98–99%, что показывает почти полное связывание циркулирующего циклесонида/активного метаболита с белками плазмы.
Метаболизм. Циклесонид гидролизуется до биологически активного метаболита посредством фермента эстеразы в легких. Активный метаболит циклесонида главным образом метаболизируется до гидроксилированных неактивных метаболитов посредством катализа с участием изофермента CYP3A4.
Клиренс циклесонида составляет около 152 л/ч, дезциклесонида — около 228 л/ч, что свидетельствует о высокой степени экстракции вещества печенью.
Выведение. Циклесонид выводится главным образом с калом, как после перорального, так и после в/в введения, что говорит о преимущественном выделении его с желчью.
Фармакокинетика у отдельных групп пациентов
Пациенты с почечной или печеночной недостаточностью, пожилые пациенты. Корректировка дозы у данной группы пациентов не требуется.
В связи с тем, что активный метаболит не выводится через почки, исследования у пациентов с ослабленной почечной функцией не проводились.
У пациентов с печеночной недостаточностью были отмечены удлиненный T1/2 и небольшое увеличение времени удержания дезциклесонида (активного метаболита) в крови. Вследствие чего не исключается накопление этого вещества при приеме препарата в высоких дозах.
Дети. Фармакокинетические параметры дезциклесонида идентичны для детей и взрослых.
Показания
Бронхиальная астма.
Противопоказания
- повышенная чувствительность к препарату;
- возраст до 6 лет.
С осторожностью: пациенты с легочным туберкулезом в активной или хронической форме; пациенты с бактериальными, вирусными или грибковыми инфекциями дыхательных путей.
Применение при беременности и кормлении грудью
Контролируемые исследования у беременных женщин не проводились. Тем не менее, после ингаляционного приема препарата концентрация циклесонида в сыворотке крови очень низкая, следовательно воздействие на эмбрион и потенциальная токсичность, влияющая на репродуктивную функцию, незначительны. Выделение циклесонида или его метаболитов через грудное молоко не исследовалось.
Как и другие ингаляционные ГКС, циклесонид может применяться во время беременности и лактации по назначению врача, если ожидаемый лечебный эффект превышает риск развития возможных побочных эффектов. Новорожденные от матерей, леченных ГКС, должны находиться под наблюдением врача для исключения гипофункции надпочечников.
Способ применения и дозы
Для пероральной ингаляции.
Альвеско® должен приниматься в течение длительного периода времени ежедневно. Препарат дозируют индивидуально. Начальная доза должна быть подобрана в зависимости от тяжести состояния. При достижении желаемого клинического эффекта дозу следует снизить до минимальной, необходимой для контролирования проявлений заболевания.
Взрослые, пожилые пациенты и подростки старше 12 лет
Астма от легкой до средней степени тяжести: рекомендованная ежедневная доза составляет от 160 до 640 мкг; дозу 640 мкг следует делить на 2 приема в день.
Тяжелая степень астмы: доза может быть увеличена максимально до 2 × 640 мкг, ежедневно.
Улучшение проявлений заболевания наступает в течение 24 ч после приема Альвеско®. Предполагается, что максимальный эффект от лечения — как и с другими ингаляционными ГКС — достигается после 2–3-месячного применения препарата.
Пациенты не должны прекращать лечение, даже при отсутствии симптомов астмы.
Дети старше 6 лет
Рекомендованная ежедневная доза — 80–160 мкг однократно или 80 мкг дважды в день.
Альвеско® может использоваться со спейсером или без него. Если использование спейсера необходимо, рекомендуется применять спейсер AeroChamberPlus.
Указания по отдельным случаям
Нет необходимости корректировать дозу для пожилых пациентов или пациентов с печеночной или почечной недостаточностью.
Взрослые и подростки, постоянно принимающие пероральные ГКС
У пациентов с тяжелым течением бронхиальной астмы, которые зависят от пероральной терапии ГКС (например преднизолон), доза Альвеско® составляет 640 мкг дважды в день. Для перевода пациентов с перорального ГКС на Альвеско® — пациенты должны находиться в стадии ремиссии. Доза Альвеско® (640 мкг дважды в день) должна применяться в течение 10 дней в комбинации с пероральным ГКС. Доза перорального ГКС должна затем постепенно снижаться каждую неделю до как можно более низкого уровня, с уменьшением ежедневной дозы не более чем на 2,5 мг каждый раз.
Инструкция по использованию ингалятора
Пациенты должны быть проинструктированы о правильном обращении с ингалятором. Если ингалятор новый или не использовался более 1 нед, то первые 3 нажатия клапана должны быть выполнены в воздух. Нет никакой необходимости встряхивания баллона, т.к. это растворенный аэрозоль.
Необходимо тщательно следовать этим инструкциям, используя рисунки в качестве руководства по применению.
1. Снять защитный колпачок с пульверизатора и проверить мундштук внутри и снаружи. Убедиться, что он чистый и сухой.
2. Перевернуть ингалятор дном вверх (дном баллона вверх), расположить свой указательный палец на дне баллона, а большой палец — под мундштуком.
3. Сделать максимальный выдох настолько, насколько это возможно. Не выдыхать в ингалятор.
4. Поместить мундштук в рот и сомкнуть губы вокруг него.
5. Только после того, как пациент начал вдыхать, необходимо нажать указательным пальцем на верхушку ингалятора для высвобождения лекарства во время медленного и глубокого вдоха. Следует позаботиться о том, чтобы лекарство не могло пройти через пространство между губами и мундштуком.
6. Задержать дыхание, удалить мундштук изо рта и снять палец с верхушки ингалятора. Продолжать задерживать дыхание в течение приблизительно 10 с или насколько можно дольше. Медленно выдохнуть через рот. Избегать выдыхать через мундштук.
7. Если необходимо сделать дополнительный вдох, следует подождать полминуты и повторить шаги 3–5.
8. После использования всегда надевать защитный колпачок для предохранения от пыли. Плотно закрыть и зафиксировать на месте.
9. В целях гигиены необходимо: регулярно очищать мундштук снаружи и внутри сухой салфеткой; используя сухую сложенную салфетку, протирать поверхность с маленьким отверстием, откуда поступает лекарство; не применять воду или какую-либо другую жидкость.
Побочные действия
Реклама: ООО «РЛС-Патент», ИНН 5044031277
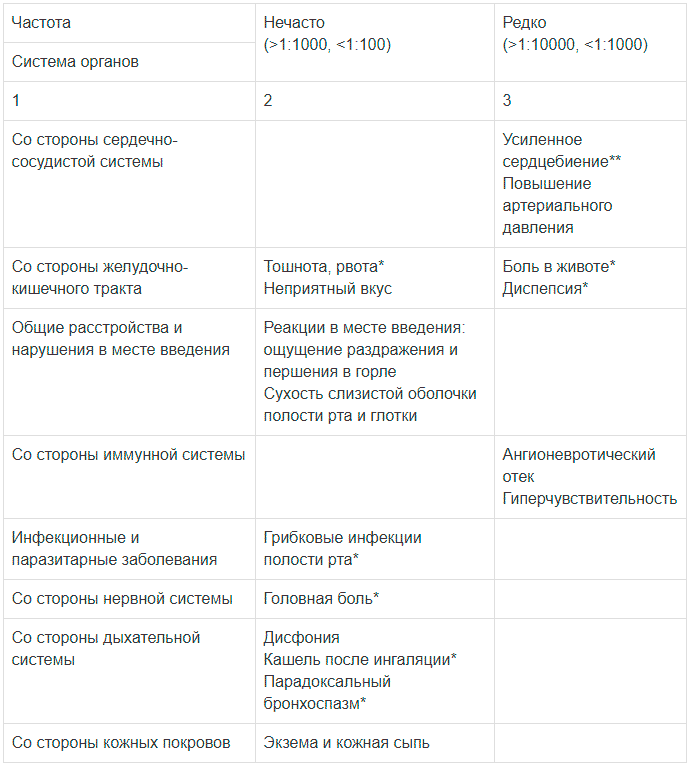
Побочные эффекты и частота их развития представлены в таблице.
Таблица
| Система органов | Частота | |
| Нечасто (>1:1000, <1:100) | Редко (>1:10000, <1:1000) | |
| Со стороны ССС | Усиленное сердцебиение**, повышение АД |
|
| Со стороны ЖКТ | Тошнота, рвота,* неприятный вкус |
Боль в животе*, диспепсия* |
| Общие расстройства и нарушения в месте введения | Реакции в месте введения: ощущение раздражения и першения в горле, сухость слизистой оболочки полости рта и глотки |
|
| Со стороны иммунной системы | Ангионевротический отек, гиперчувствительность | |
| Инфекционные и паразитарные заболевания | Грибковые инфекции полости рта* | |
| Со стороны нервной системы | Головная боль* | |
| Со стороны дыхательной системы | Дисфония, кашель после ингаляции*, парадоксальный бронхоспазм* |
|
| Со стороны кожных покровов | Экзема и кожная сыпь |
* идентичный или более низкий процент по сравнению с плацебо.
** сердцебиения наблюдались во время клинических исследований в случаях одновременного применения с препаратами, которые могут оказывать побочное действие на сердечный ритм (например теофиллин или сальбутамол).
Парадоксальный бронхоспазм может встречаться непосредственно после ингаляции и являться неспецифической острой реакцией на любые ингаляционные медицинские препараты, которая может быть связана с активным веществом, вспомогательными веществами или охлаждением вследствие испарения пропеллента в случае применения дозируемых ингаляторов. В большинстве случаев, это умеренно неблагоприятная реакция, которая не требует прекращения лечения Альвеско®, и которая может пройти сама.
Ингаляционные ГКС могут давать системные эффекты, особенно при высоких дозах, прописанных на длительный период. Возможные системные эффекты включают синдром Кушинга и кушингоподобные симптомы, такие как угнетение функции надпочечников (подавление надпочечников), замедление роста у детей и подростков, уменьшение плотности кости, катаракту и глаукому. Именно поэтому важно, чтобы доза ингаляционного ГКС снижалась до наименьшей, при которой ведется удовлетворительный контроль проявлений заболевания.
Взаимодействие
Данные in vitro показывают, что изофермент CYP3A4 является основным ферментом, вовлеченным в метаболизм активного метаболита циклесонида — M1 (дезциклесонида) у человека.
В исследованиях лекарственных взаимодействий между циклесонидом и кетоконазолом, в качестве мощного ингибитора изофермента CYP3A4, влияние на активный метаболит дезциклесонид увеличивалось примерно в 3,5 раза, тогда как влияние на циклесонид отмечено не было. Исходя из этого, следует избегать одновременного применения потенциальных ингибиторов изофермента CYP3A4 и циклесонида.
Исследование взаимодействия циклесонида и субстрата эритромицина изофермента CYP3A4 не показало никаких взаимодействий между двумя веществами.
Передозировка
Острая
Ингаляционное применение однократной дозы 2880 мкг циклесонида у здоровых добровольцев переносилось хорошо. Возможность острых токсических эффектов вслед за передозировкой ингаляционного циклесонида низка.
Симптомы: возможно усиление сухости слизистой оболочки полости рта и глотки, ощущения раздражения или першения в горле, дисфонии.
Лечение: после острой передозировки необходимость специфического лечения отсутствует.
Хроническая
Симптомы: после продолжительного введения 1280 мкг циклесонида не наблюдалось клинических признаков подавления надпочечников. Однако если превышение рекомендованной дозы продолжается в течение сверхдлительного периода времени, некоторая степень подавления надпочечников не может быть исключена.
Лечение: рекомендуется контролировать функцию надпочечников. В случаях передозировки Альвеско® терапия может быть продолжена дозой, достаточной для поддержания терапевтического эффекта.
Особые указания
Альвеско® не показан для лечения астматического статуса или других острых эпизодов астмы, требующих интенсивных терапевтических мер.
Действие ингаляционных ГКС при длительном применении у детей до конца не выяснено. Врач должен постоянно контролировать рост детей, принимающих ГКС в течение длительного периода. Если рост замедляется, терапия должна быть пересмотрена с целью уменьшения дозы ингаляционного ГКС. Если возможно, то до наименьшей дозы, с помощью которой поддерживается постоянный контроль проявлений астмы. Доза Альвеско® может быть уменьшена у пациентов, нуждающихся в пероральньтх ГКС.
Для пациентов, переведенных с пероральной ГКС-терапии на ингаляционное лечение Альвеско®, может сохраняться снижение функции коры надпочечников в течение значительного периода времени после перевода. Возможность развития нежелательных эффектов от применения пероральных ГКС может сохраняться в течение некоторого времени после их отмены. В подобных случаях рекомендуется проводить контроль резервной функции коры надпочечников. Всегда должна приниматься во внимание возможность остаточного ухудшения адренокортикального отклика в критической ситуации (терапевтической или хирургической) и в других индивидуальных случаях, которые могут быть вызваны стрессовой реакцией, вследствие чего следует начинать соответствующее ГКС-лечение.
В случае недостаточности адренокортикального отклика или серьезных обострений, дозу Альвеско® следует увеличить; если необходимо, следует применять пероральные ГКС. В случае инфекции должны использоваться антибиотики. Парадоксальный бронхоспазм с усилением хрипов и другие симптомы сужения бронхов, появившиеся непосредственно после ингаляции, должны лечиться с помощью быстродействующего бронхорасширяющего средства, что обычно приводит к быстрому облегчению. Пациент должен быть осмотрен, и терапия с Альвеско® должна продолжаться только в том случае, если после взвешенного рассмотрения, ожидаемый эффект выше, чем возможный риск. Должна быть принята во внимание взаимосвязь между степенью тяжести астмы и общей предрасположенностью к острым бронхиальным реакциям.
Перевод пациентов, принимавших пероральные ГКС, на Альвеско®.
Перевод пациентов, получавших лечение пероральными ГКС, на Альвеско® и их последующее ведение нуждается во внимании, т.к. восстановление сниженной функции надпочечников, вызванной продолжительной систематической ГКС-терапией, может занять некоторое время.
У пациентов, принимавших системные ГКС в течение длительного периода времени или в высокой дозе, может наблюдаться подавление функции надпочечников. Функция надпочечников у этих пациентов должна отслеживаться регулярно, и доза системных ГКС должна уменьшаться постепенно. После приблизительно одной недели может быть начато постепенное исключение системных ГКС с уменьшением их ежедневной дозы на 1 мг преднизолона или его эквивалент. Для поддерживающей дозы преднизолона свыше 10 мг ежедневно целесообразными могут оказаться осторожно предпринятые бóльшие снижения дозы на протяжении недельных интервалов.
Некоторые пациенты могут плохо себя чувствовать во время отмены препарата, несмотря на сохранение или даже улучшение дыхательной функции. Их необходимо обследовать на адренокортикальную недостаточность.
При переводе пациентов с приема системных ГКС на ингаляционную терапию могут проявляться аллергические реакции (например аллергический ринит, экзема), которые раньше подавлялись системными препаратами. Эти аллергии должны быть пролечены симптоматически антигистаминными средствами и/или средствами местного применения, включающими ГКС местного применения.
Влияние на способность управлять автомобилем или выполнять работы, требующие повышенной скорости физических и психических реакций. Нет данных о влиянии препарата на способность управлять транспортными средствами и механизмами.
Форма выпуска
Аэрозоль для ингаляций дозированный, 40 мкг/распыление, 80 мкг/распыление, 160 мкг/ распыление. По 5 мл (60 распылений) или 8 мл (120 распылений) в алюминиевом баллончике с дозирующим клапаном и мундштуком с защитной крышкой. Баллончик помещают в картонную пачку.
Производитель
Владелец регистрационного удостоверения: Такеда ГмбХ, Германия.
Юридический адрес: Бик-Гульден-Штрассе 2, 78467 Констанц, Германия.
Выпускающий контроль качества: Роберт-Бош-Штрассе 8, 78224 Зинген, Германия.
Адрес производственной площадки: 3М Хелс Кеа Лимитед, Великобритания. Дерби Роад, Лафборо, ЛЕ11 5CФ Лестершир, Великобритания.
Условия отпуска из аптек
По рецепту.
Условия хранения
При температуре не выше 25 °C.
Содержимое баллона находится под давлением. Баллон нельзя вскрывать и подвергать нагреванию выше 50 °C.
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не использовать после истечения срока годности, указанного на упаковке.
Не применять по истечении срока годности, указанного на упаковке.
Описание проверено
-
Крылов Юрий Федорович
(фармаколог, доктор медицинских наук, профессор, академик Международной академии информатизации)
Опыт работы: более 34 лет
Альвеско® (Alvesco®) инструкция по применению
📜 Инструкция по применению Альвеско®
💊 Состав препарата Альвеско®
✅ Применение препарата Альвеско®
📅 Условия хранения Альвеско®
⏳ Срок годности Альвеско®
Препарат отпускается по рецепту
Температура хранения: от 2 до 25 °С
⚠️ Государственная регистрация данного препарата отменена
Описание лекарственного препарата
Альвеско®
(Alvesco®)
Основано на официальной инструкции по применению препарата, утверждено компанией-производителем
и подготовлено для электронного издания справочника Видаль 2015
года, дата обновления: 2018.04.05
Владелец регистрационного удостоверения:
Код ATX:
R03BA08
(Циклесонид)
Лекарственные формы
|
Препарат отпускается по рецепту |
Альвеско® |
Аэрозоль для ингаляций дозированный 40 мкг/1 распыление: баллончики 5 мл (60 распылений) или 8 мл (120 распылений) с дозир. клапаном и мундштуком рег. №: ЛП-000823 |
|
Аэрозоль для ингаляций дозированный 80 мкг/1 распыление: баллончики 5 мл (60 распылений) или 8 мл (120 распылений) с дозир. клапаном и мундштуком рег. №: ЛП-000823 |
||
|
Аэрозоль для ингаляций дозированный 160 мкг/1 распыление: баллончики 5 мл (60 распылений) или 8 мл (120 распылений) с дозир. клапаном и мундштуком рег. №: ЛП-000823 |
Форма выпуска, упаковка и состав
препарата Альвеско®
Аэрозоль для ингаляций дозированный в виде бесцветного прозрачного раствора.
Вспомогательные вещества: норфлуран (HFA-134a) — 54.51 мг, этанол — 4.74 мг.
5 мл (60 распылений) — баллончики алюминиевые (1) с дозирующим клапаном и мундштуком с защитной крышкой — пачки картонные.
8 мл (120 распылений) — баллончики алюминиевые (1) с дозирующим клапаном и мундштуком с защитной крышкой — пачки картонные.
Аэрозоль для ингаляций дозированный в виде бесцветного прозрачного раствора.
Вспомогательные вещества: норфлуран (HFA-134a) — 54.46 мг, этанол — 4.74 мг.
5 мл (60 распылений) — баллончики алюминиевые (1) с дозирующим клапаном и мундштуком с защитной крышкой — пачки картонные.
8 мл (120 распылений) — баллончики алюминиевые (1) с дозирующим клапаном и мундштуком с защитной крышкой — пачки картонные.
Аэрозоль для ингаляций дозированный в виде бесцветного прозрачного раствора.
Вспомогательные вещества: норфлуран (HFA-134a) — 54.37 мг, этанол — 4.73 мг.
5 мл (60 распылений) — баллончики алюминиевые (1) с дозирующим клапаном и мундштуком с защитной крышкой — пачки картонные.
8 мл (120 распылений) — баллончики алюминиевые (1) с дозирующим клапаном и мундштуком с защитной крышкой — пачки картонные.
Фармакологическое действие
ГКС для местного применения в виде ингаляций. Циклесонид проявляет низкое сродство к глюкокортикоидным рецепторам. После ингаляции при участии ферментов превращается в легких в основной метаболит (дезциклесонид, С21-дезметилпропионилциклесонид), который обладает выраженной противовоспалительной активностью и поэтому считается активным метаболитом. Циклесонид подавляет воспалительные реакции в дыхательных путях и, таким образом, ослабляет симптомы бронхиальной астмы, улучшает функцию легких.
Фармакокинетика
Всасывание
Пероральное или в/в введение меченного радиоактивным изотопом циклесонида показало, что степень абсорбции составляет 24.5%. При приеме препарата внутрь биодоступность как циклесонида, так и активного метаболита незначительна (<0.5% для циклесонида, и <1% для метаболита) в связи со значительным влиянием пресистемного метаболизма.
Накопление циклесонида у здоровых пациентов в легких — свыше 50%. В соответствии с этой цифрой системная биодоступность для активного метаболита после ингаляционной дозы – свыше 50%. Т.к. биодоступность активного метаболита при приеме циклесонида внутрь менее 1%, препарат, принятый ингаляционно не оказывает системного воздействия.
Распределение
После в/в введения здоровым добровольцам циклесонид быстро распределяется вследствие его высокой липофильности. Vd составляет в среднем 2.9 л/кг для циклесонида и 12.1 л/кг для дезциклесонида.
Связывание циклесонида с белками плазмы составляет около 99%, активного метаболита — 98-99%.
Метаболизм
Циклесонид гидролизуется до биологически активного метаболита посредством фермента эстеразы в легких. Активный метаболит циклесонида, главным образом, метаболизируется до гидроксилированных неактивных метаболитов посредством катализа с участием изофермента CYP3A4. Клиренс циклесонида составляет около 152 л/ч и дезциклесонида — около 228 л/ч, что свидетельствует о высокой степени экстракции вещества печенью.
Выведение
Циклесонид выводится, главным образом, с калом, как после приема внутрь, так и после в/в введения, что говорит о преимущественном выделении его с желчью.
Фармакокинетика у отдельных групп пациентов
Пациенты с почечной и печеночной недостаточностью, пожилые пациенты
Коррекция дозы у данной группы пациентов не требуется.
Т.к. активный метаболит не выводится почками, исследования у пациентов с ослабленной почечной функцией почек не проводились.
У пациентов с печеночной недостаточностью были отмечены удлиненный T1/2 и небольшое увеличение времени удержания дезциклесонида (активного метаболита) в крови. Вследствие этого не исключается накопление данного вещества при приеме препарата в высоких дозах.
Дети
Фармакокинетические параметры дезциклесонида идентичны для детей и взрослых.
Показания препарата
Альвеско®
- бронхиальная астма.
Режим дозирования
Альвеско® применяют только для пероральной ингаляции. Препарат следует принимать ежедневно в течение длительного периода времени.
Альвеско® дозируют индивидуально. Начальную дозу следует подбирать в зависимости от тяжести состояния. При достижении желаемого клинического эффекта, дозу следует снизить до минимальной, необходимой для контролирования проявлений заболевания.
Взрослым и подросткам старше 12 лет, пациентам пожилого возраста при бронхиальной астме от легкой до средней степени тяжести рекомендованная ежедневная доза составляет от 160 мкг до 640 мкг; дозу 640 мкг следует делить на 2 приема в сут. При бронхиальной астме тяжелой степени доза может быть увеличена максимально до 640 мкг 2 раза/сут ежедневно.
Улучшение проявлений заболевания наступает в течение 24 ч после приема Альвеско®. Предполагается, что максимальный эффект от лечения — как и с другими ингаляционными ГКС — достигается после 2-3 месячного применения препарата.
Пациенты не должны прекращать лечение, даже при отсутствии симптомов бронхиальной астмы.
Пациентам пожилого возраста коррекция дозы не требуется.
Детям старше 6 лет рекомендованная ежедневная доза составляет 80-160 мкг 1 раз/сут или по 80 мкг 2 раза/сут.
Альвеско® можно применять со спейсером или без него. Если использование спейсера необходимо, рекомендуется применять спейсер AeroChamberPlus.
Пациентам с почечной или печеночной недостаточностью коррекция дозы не требуется.
Взрослые и подростки, постоянно принимающие пероральные ГКС: у пациентов с тяжелым течением бронхиальной астмы, которые зависят от пероральной терапии ГКС (например, преднизолоном), доза Альвеско® составляет 640 мкг 2 раза/сут. Перевод пациентов с перорального ГКС на Альвеско® возможен в стадии ремиссии. Альвеско® в дозе 640 мкг 2 раза/сут следует применять в течение 10 дней в комбинации с пероральным ГКС. Дозу перорального ГКС следует затем постепенно снижать каждую неделю до минимальной эффективной дозы, с уменьшением ежедневной дозы не более, чем на 2.5 мг каждый раз.
Инструкция по использованию ингалятора
Пациенты должны быть проинструктированы о правильном обращении с ингалятором.
Если ингалятор новый или не использовался более одной недели, то первые три нажатия клапана должны быть выполнены в воздух. Нет никакой необходимости встряхивания баллона, т.к. это растворенный аэрозоль.
1. Следует снять защитный колпачок с пульверизатора и проверить мундштук внутри и снаружи. Убедиться, что он чистый и сухой.
2. Следует перевернуть ингалятор дном вверх (дном баллона вверх), расположить свой указательный палец на дне баллона, а большой палец – под мундштуком.
3. Сделать максимальный выдох настолько, насколько это возможно. Не следует выдыхать в ингалятор.
4. Поместить мундштук в рот и сомкнуть губы вокруг него.
5. Только после того, как начался вдох, нажать указательным пальцем на верхушку ингалятора для высвобождения лекарства во время медленного и глубокого вдоха. Следует позаботиться о том, чтобы лекарство не могло пройти через пространство между губами и мундштуком.
6. Задержать дыхание, удалить мундштук изо рта и снять палец с верхушки ингалятора. Нужно продолжать задерживать дыхание в течение приблизительно 10 сек или насколько возможно дольше. Медленно выдохнуть через рот. Следует избегать выдыхать через мундштук.
Важно не торопиться во время проведения пунктов 3-6.
7. Если необходимо сделать дополнительный вдох, нужно подождать 30 сек и повторить пункты 3-6.
8. После использования всегда нужно надевать защитный колпачок для предохранения от пыли. Плотно закрыть и зафиксировать на месте.
9. В целях гигиены:
- следует очищать регулярно мундштук снаружи и внутри сухой салфеткой;
- используя сухую сложенную салфетку, нужно протереть поверхность с маленьким отверстием, откуда выходит лекарство;
- не следует использовать воду или какую-либо другую жидкость.
Побочное действие
* идентичный или более низкий процент по сравнению с плацебо
** сердцебиение наблюдалось во время клинических исследований в случаях одновременного применения с препаратами, которые могут оказывать побочное действие на сердечный ритм (например, теофиллин или сальбутамол).
Парадоксальный бронхоспазм может встречаться непосредственно после ингаляции и являться неспецифической острой реакцией на любые ингаляционные медицинские препараты, которая может быть связана с активным веществом, вспомогательными веществами или охлаждением вследствие испарения пропеллента в случае применения дозируемых ингаляторов. В большинстве случаев это умеренно неблагоприятная реакция, которая не требует прекращения лечения Альвеско® и может пройти самостоятельно.
Ингаляционные ГКС могут вызывать системные эффекты, особенно при применении в высоких дозах в течение длительного времени. Возможные системные эффекты включают синдром Кушинга и кушингоподобные симптомы, такие как подавление надпочечников, замедление роста у детей и подростков, уменьшение плотности кости, катаракту и глаукому. Именно поэтому важно, чтобы доза ингаляционного ГКС снижалась до минимальной эффективной, которая позволяет удовлетворительно контролировать симптомы заболевания.
Противопоказания к применению
- возраст до 6 лет;
- повышенная чувствительность к компонентам препарата.
С осторожностью следует применять препарат у пациентов с легочным туберкулезом в активной или хронической форме; у пациентов с бактериальными, вирусными или грибковыми инфекциями дыхательных путей.
Применение при беременности и кормлении грудью
Контролируемые исследования у беременных женщин не проводились. Тем не менее, после ингаляционного приема препарата концентрация циклесонида в сыворотке крови очень низкая, следовательно, воздействие на эмбрион и потенциальная токсичность для репродукции незначительны.
Выделение циклесонида или его метаболитов с грудным молоком не исследовалось.
Как и другие ингаляционные ГКС, Альвеско® можно применять при беременности и лактации по назначению врача, если ожидаемый лечебный эффект превышает риск развития возможных побочных эффектов. Новорожденные, матери которых при беременности получали ГКС, должны находиться под наблюдением врача для исключения гипофункции надпочечников.
Применение при нарушениях функции печени
Пациентам с печеночной недостаточностью коррекции дозы не требуется.
Применение при нарушениях функции почек
Пациентам с почечной недостаточностью коррекции дозы не требуется.
Применение у детей
Противопоказано применение у детей в возрасте до 6 лет. Детям старше 6 лет рекомендованная ежедневная доза составляет 80-160 мкг 1 раз/сут или по 80 мкг 2 раза/сут.
Применение у пожилых пациентов
Пациентам пожилого возраста коррекция дозы не требуется.
Особые указания
Альвеско® не показан для лечения астматического статуса или других острых приступов бронхиальной астмы, требующих проведения интенсивных терапевтических мер.
Доза Альвеско® может быть уменьшена у пациентов, нуждающихся в пероральных ГКС.
Для пациентов, переведенных с пероральной терапии ГКС на ингаляционное лечение препаратом Альвеско®, может сохраняться снижение функции коры надпочечников в течение значительного периода времени после перевода. Возможность развития нежелательных эффектов от применения пероральных ГКС может сохраняться в течение некоторого времени после их отмены. В подобных случаях рекомендуется проводить контроль резервной функции коры надпочечников. Всегда следует принимать во внимание возможность остаточного ухудшения функции коры надпочечников в критической ситуации (терапевтической или хирургической) и в других индивидуальных случаях, которые могут быть вызваны стрессовой реакцией, вследствие этого следует начинать соответствующее лечение ГКС.
В случае недостаточности функции коры надпочечников или серьезных обострений дозу препарата Альвеско® следует увеличить; если необходимо, то следует применять пероральные ГКС.
В случае развития инфекции следует применять антибиотики.
Парадоксальный бронхоспазм с усилением хрипов и другие симптомы сужения бронхов, появившиеся непосредственно после ингаляции, следует лечить с помощью быстродействующего бронхорасширяющего средства, что обычно приводит к быстрому облегчению. Пациента необходимо осмотреть, и продолжать терапию препаратом Альвеско® только в том случае, если после взвешенного рассмотрения ожидаемый эффект выше, чем возможный риск. Следует принимать во внимание взаимосвязь между степенью тяжести астмы и общей предрасположенностью к острым бронхиальным реакциям.
Перевод пациентов, принимавших пероральные ГКС, на Альвеско®
При переводе на Альвеско® и последующем ведении пациентов, получавших лечение пероральными ГКС, требуется контроль врача, т.к. восстановление сниженной функции надпочечников, вызванной продолжительной систематической терапии ГКС, может занять некоторое время.
У пациентов, получавших системные ГКС в течение длительного времени или в высокой дозе, может наблюдаться подавление функции надпочечников. Функцию надпочечников этих пациентов необходимо контролировать регулярно, и дозу системных ГКС следует уменьшать постепенно.
После приблизительно одной недели может быть начато постепенное исключение системных ГКС с уменьшением их ежедневной дозы на 1 мг преднизолона, или его эквивалент. При поддерживающей дозе преднизолона более 10 мг ежедневно, может оказаться целесообразным более значительное снижение дозы в течение недельных интервалов, при этом необходима осторожность.
Некоторые пациенты могут плохо себя чувствовать во время отмены препарата, несмотря на сохранение или даже улучшение дыхательной функции. Их необходимо обследовать на наличие адренокортикальной недостаточности.
При переводе пациентов с приема системных ГКС на ингаляционную терапию могут проявляться аллергические реакции (например, аллергический ринит, экзема), которые раньше были подавлены системными препаратами. В таких случаях следует проводить симптоматическую терапию антигистаминными средствами, в т.ч. препаратами для наружного и местного применения, содержащими ГКС.
Использование в педиатрии
Применение препарата у детей в возрасте до 6 лет противопоказано.
Действие ингаляционных ГКС при длительном применении у детей до конца не выяснено. Врач должен постоянно наблюдать за развитием роста детей, принимающих ГКС в течение длительного периода. Если рост замедляется, то терапию следует пересмотреть с целью уменьшения дозы ингаляционного ГКС, по возможности, до минимальной эффективной, которая позволяет контролировать симптомы бронхиальной астмы.
Влияние на способность к управлению транспортными средствами и механизмами
Данных о влиянии препарата на способность к управлению транспортными средствами и механизмами не имеется.
Передозировка
Острая передозировка
Симптомы: ингаляционное применение однократной дозы 2880 мкг циклесонида у здоровых добровольцев переносилось хорошо. Возможность острых токсических эффектов вслед за передозировкой ингаляционного циклесонида низка. Возможно усиление сухости слизистой оболочки полости рта и глотки, ощущения раздражения или першения в горле, дисфонии.
Лечение: после острой передозировки необходимость специфического лечения отсутствует.
Хроническая передозировка
Симптомы: после продолжительного введения 1280 мкг циклесонида не наблюдалось клинических признаков подавления надпочечников. Однако если превышение рекомендованной дозы продолжается в течение сверхдлительного периода времени, некоторая степень подавления надпочечников не может быть исключена.
Лечение: рекомендуется контролировать функцию надпочечников. В случаях передозировки Альвеско® терапия может быть продолжена дозой, достаточной для поддержания терапевтического эффекта.
Лекарственное взаимодействие
По данным in vitro CYP3A4 является основным ферментом, вовлеченным в метаболизм активного метаболита циклесонида — M1 (дезциклесонида) у человека.
В исследованиях лекарственного взаимодействия между циклесонидом и кетоконазолом, в качестве сильного ингибитора CYP3A4, влияние на активный метаболит дезциклесонид увеличивалось примерно в 3.5 раза, тогда как влияния на циклесонид отмечено не было. Исходя из этого, следует избегать одновременного применения потенциальных ингибиторов CYP3A4 и циклесонида.
Исследование взаимодействия циклесонида и субстрата CYP3A4 эритромицина не показало никакого взаимодействия между ними.
Условия хранения препарата Альвеско®
Препарат следует хранить в недоступном для детей месте при температуре не выше 25°С.
Срок годности препарата Альвеско®
Срок годности — 3 года. Не использовать после истечения срока годности, указанного на упаковке.
Содержимое баллона находится под давлением. Баллон нельзя вскрывать и подвергать нагреванию выше 50°С.
Условия реализации
Препарат отпускается по рецепту.
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Форма выпуска, состав и упаковка
аэрозоль д/ингаляций дозированный 80 мкг/1 доза: баллончики 5 мл (60 доз) или 8 мл (120 доз) с дозир. клапаном и мундштуком
Рег. №: 9798/11 от 04.10.2011 — Истекло
Аэрозоль для ингаляций дозированный в виде бесцветного прозрачного раствора.
Вспомогательные вещества: норфлуран (HFA-134a), этанол.
5 мл (60 доз) — баллончики алюминиевые (1) с дозирующим клапаном и мундштуком с защитной крышкой — пачки картонные.
8 мл (120 доз) — баллончики алюминиевые (1) с дозирующим клапаном и мундштуком с защитной крышкой — пачки картонные.
аэрозоль д/ингаляций дозированный 160 мкг/1 доза: баллончики 5 мл (60 доз) или 8 мл (120 доз) с дозир. клапаном и мундштуком
Рег. №: 9798/11 от 04.10.2011 — Истекло
Аэрозоль для ингаляций дозированный в виде бесцветного прозрачного раствора.
| 1 доза | |
| циклесонид | 160 мкг |
Вспомогательные вещества: норфлуран (HFA-134a), этанол.
5 мл (60 доз) — баллончики алюминиевые (1) с дозирующим клапаном и мундштуком с защитной крышкой — пачки картонные.
8 мл (120 доз) — баллончики алюминиевые (1) с дозирующим клапаном и мундштуком с защитной крышкой — пачки картонные.
Описание лекарственного препарата АЛЬВЕСКО® основано на официально утвержденной инструкции по применению препарата и сделано в 2013 году. Дата обновления: 19.03.2013 г.
Фармакологическое действие
ГКС для местного применения в виде ингаляций. Циклесонид проявляет низкое сродство к глюкокортикоидным рецепторам. После ингаляции при участии ферментов превращается в легких в основной метаболит (дезциклесонид, С21-дезметилпропионилциклесонид), который обладает выраженной противовоспалительной активностью и поэтому считается активным метаболитом. Циклесонид подавляет воспалительные реакции в дыхательных путях и, таким образом, ослабляет симптомы бронхиальной астмы, улучшает функцию легких.
Фармакокинетика
Всасывание
Пероральное или в/в введение меченного радиоактивным изотопом циклесонида показало, что степень абсорбции составляет 24.5%. При приеме препарата внутрь биодоступность как циклесонида, так и активного метаболита незначительна (<0.5% для циклесонида, и <1% для метаболита) в связи со значительным влиянием пресистемного метаболизма.
Накопление циклесонида у здоровых пациентов в легких — свыше 50%. В соответствии с этой цифрой системная биодоступность для активного метаболита после ингаляционной дозы – свыше 50%. Т.к. биодоступность активного метаболита при приеме циклесонида внутрь менее 1%, препарат, принятый ингаляционно не оказывает системного воздействия.
Распределение
После в/в введения здоровым добровольцам циклесонид быстро распределяется вследствие его высокой липофильности. Vd составляет в среднем 2.9 л/кг для циклесонида и 12.1 л/кг для дезциклесонида.
Связывание циклесонида с белками плазмы составляет около 99%, активного метаболита — 98-99%.
Метаболизм
Циклесонид гидролизуется до биологически активного метаболита посредством фермента эстеразы в легких. Активный метаболит циклесонида, главным образом, метаболизируется до гидроксилированных неактивных метаболитов посредством катализа с участием изофермента CYP3A4. Клиренс циклесонида составляет около 152 л/ч и дезциклесонида — около 228 л/ч, что свидетельствует о высокой степени экстракции вещества печенью.
Выведение
Циклесонид выводится, главным образом, с калом, как после приема внутрь, так и после в/в введения, что говорит о преимущественном выделении его с желчью.
Фармакокинетика в особых клинических случаях
Фармакокинетика циклесонида у пациентов с бронхиальной астмой легкой степени не меняется по сравнению со здоровыми пациентами.
Пациенты с почечной и печеночной недостаточностью, пожилые пациенты: коррекция дозы у данной группы пациентов не требуется. Т.к. активный метаболит не выводится почками, исследования у пациентов с ослабленной почечной функцией почек не проводились.
У пациентов с печеночной недостаточностью были отмечены удлиненный T1/2 и небольшое увеличение времени удержания дезциклесонида (активного метаболита) в крови. Вследствие этого не исключается накопление данного вещества при приеме препарата в высоких дозах.
В двух клинических исследованиях, изучающих безопасность и эффективность препарата у пациентов с бронхиальной астмой в возрасте от 4 до 11 лет образцы сыворотки были взяты у 53 пациентов для фармакокинетического анализа. Фармакокинетические параметры дезциклесонида сходны у детей и взрослых.
Реклама
Режим дозирования
Альвеско® применяют только для пероральной ингаляции. Препарат следует принимать ежедневно в течение длительного периода времени.
Альвеско® дозируют индивидуально. Начальную дозу следует подбирать в зависимости от тяжести состояния. При достижении желаемого клинического эффекта, дозу следует снизить до минимальной, необходимой для контролирования проявлений заболевания.
Взрослым и подросткам старше 12 лет, пациентам пожилого возраста при бронхиальной астме от легкой до средней степени тяжести рекомендованная ежедневная доза составляет от 160 мкг до 640 мкг; дозу 640 мкг следует делить на 2 приема в сут. При бронхиальной астме тяжелой степени доза может быть увеличена максимально до 640 мкг 2 раза/сут ежедневно.
Улучшение проявлений заболевания наступает в течение 24 ч после приема Альвеско®. Предполагается, что максимальный эффект от лечения — как и с другими ингаляционными ГКС — достигается после 2-3-месячного применения препарата.
Пациенты не должны прекращать лечение, даже при отсутствии симптомов бронхиальной астмы.
Пациентам пожилого возраста коррекция дозы не требуется.
Детям старше 6 лет рекомендованная ежедневная доза составляет 80-160 мкг 1 раз/сут или по 80 мкг 2 раза/сут.
Альвеско® можно применять со спейсером или без него. Если использование спейсера необходимо, рекомендуется применять спейсер AeroChamberPlus.
Пациентам с почечной или печеночной недостаточностью коррекция дозы не требуется.
Взрослые и подростки, постоянно принимающие пероральные ГКС: у пациентов с тяжелым течением бронхиальной астмы, которые зависят от пероральной терапии ГКС (например, преднизолоном), доза Альвеско® составляет 640 мкг 2 раза/сут. Перевод пациентов с перорального ГКС на Альвеско® возможен в стадии ремиссии. Альвеско® в дозе 640 мкг 2 раза/сут следует применять в течение 10 дней в комбинации с пероральным ГКС. Дозу перорального ГКС следует затем постепенно снижать каждую неделю до минимальной эффективной дозы, с уменьшением ежедневной дозы не более чем на 2.5 мг каждый раз.
Инструкция по использованию ингалятора
Пациенты должны быть проинструктированы о правильном обращении с ингалятором.
Если ингалятор новый или не использовался более одной недели, то первые три нажатия клапана должны быть выполнены в воздух. Нет необходимости встряхивания баллона, т.к. это растворенный аэрозоль.
1. Следует снять защитный колпачок с пульверизатора и проверить мундштук внутри и снаружи. Убедиться, что он чистый и сухой.
2. Следует перевернуть ингалятор дном вверх (дном баллона вверх), расположить свой указательный палец на дне баллона, а большой палец – под мундштуком.
3. Сделать максимальный выдох настолько, насколько это возможно. Не следует выдыхать в ингалятор.
4. Поместить мундштук в рот и сомкнуть губы вокруг него.
5. Только после того, как начался вдох, нажать указательным пальцем на верхушку ингалятора для высвобождения лекарства во время медленного и глубокого вдоха. Следует позаботиться о том, чтобы лекарство не могло пройти через пространство между губами и мундштуком.
6. Задержать дыхание, удалить мундштук изо рта и снять палец с верхушки ингалятора. Нужно продолжать задерживать дыхание в течение приблизительно 10 сек или насколько возможно дольше. Медленно выдохнуть через рот. Следует избегать выдыхать через мундштук.
Важно не торопиться во время проведения пунктов 3-6.
7. Если необходимо сделать дополнительный вдох, нужно подождать 30 сек и повторить пункты 3-6.
8. После использования всегда нужно надевать защитный колпачок для предохранения от пыли. Плотно закрыть и зафиксировать на месте.
9. В целях гигиены:
— следует очищать регулярно мундштук снаружи и внутри сухой салфеткой;
— используя сухую сложенную салфетку, нужно протереть поверхность с маленьким отверстием, откуда выходит лекарство;
— не следует использовать воду или какую-либо другую жидкость.
Побочные действия
Приблизительно у 5% пациентов отмечены побочные реакции во время клинических исследований при применении препарата Альвеско® в диапазоне доз от 80 до 1280 мкг в сут. В большинстве случаев побочные реакции были не выраженными и не потребовали прекращения приема Альвеско®.
Инфекции: нечасто — грибковые инфекции полости рта* (частота варьирует в зависимости от дозы, для средних и высоких доз [2×320 мкг] = 2%; риск возникновения грибковых инфекций полости рта может быть уменьшен с помощью полоскания рта водой или приема пищи непосредственно после ингаляции Альвеско®).
Со стороны иммунной системы: редко — ангионевротический отек, гиперчувствительность.
Со стороны нервной системы: нечасто — головная боль*.
Со стороны сердечно-сосудистой системы: редко — сердцебиение**, артериальная гипертензия.
Со стороны дыхательной системы: нечасто — дисфония, кашель после ингаляции*, парадоксальный бронхоспазм (1%).
Со стороны пищеварительной системы: нечасто — тошнота, рвота*, неприятные вкусовые ощущения; редко — боли в животе*, диспепсия*.
Со стороны кожных покровов и подкожных тканей: нечасто — кожная сыпь и экзема.
Местные реакции: нечасто — реакции со стороны полости рта, сухость во рту.
* Сходная или меньшая частота в сравнении с плацебо.
** Сердцебиение наблюдалось в клинических исследованиях главным образом при сопутствующем приеме препаратов с известными кардиальными эффектами (например, теофиллин или сальбутамол).
Парадоксальный бронхоспазм может встречаться непосредственно после ингаляции и являться неспецифической острой реакцией на любые ингаляционные медицинские препараты, которая может быть связана с активным веществом, вспомогательными веществами или охлаждением вследствие испарения пропеллента в случае применения дозируемых ингаляторов. В большинстве случаев это умеренно неблагоприятная реакция, которая не требует прекращения лечения Альвеско® и может пройти самостоятельно. В тяжелых случаях прием Альвеско® следует прекратить.
Ингаляционные ГКС могут вызывать системные эффекты, особенно при применении в высоких дозах в течение длительного времени.
Применение при беременности и кормлении грудью
Контролируемые исследования у беременных женщин не проводились. Тем не менее, после ингаляционного приема препарата концентрация циклесонида в сыворотке крови очень низкая, следовательно, воздействие на эмбрион и потенциальная токсичность для репродукции незначительны.
Выделение циклесонида или его метаболитов с грудным молоком не исследовалось.
Как и другие ингаляционные ГКС, Альвеско® можно применять при беременности и лактации по назначению врача, если ожидаемый лечебный эффект превышает риск развития возможных побочных эффектов. Новорожденные, матери которых при беременности получали ГКС, должны находиться под наблюдением врача для исключения гипофункции надпочечников.
Особые указания
С осторожностью следует применять препарат у пациентов с легочным туберкулезом в активной или хронической форме; у пациентов с бактериальными, вирусными или грибковыми инфекциями дыхательных путей.
Альвеско® не показан для лечения астматического статуса или других острых приступов бронхиальной астмы, требующих проведения интенсивных терапевтических мер.
Альвеско® не предназначен для снятия симптомов при обострении бронхиальной астмы, при котором требуется применение ингаляционных бронходилататоров короткого действия. Пациентам должны быть даны рекомендации иметь при себе такие препараты постоянно.
У пациентов с тяжелой степенью бронхиальной астмы существует риск возникновения приступа удушья. Такие пациенты должны регулярно проходить обследование, подтверждающее адекватность лечения, включая исследование функции легких. Увеличение использования бронходилататоров короткого действия для облегчения симптомов астмы указывает, что лечение неадекватно. В случае если пациент ощущает, что действие бронходилататоров короткого действия ослабевает или отмечается увеличение кратности ингаляций, состояние пациента должно быть переоценено и, если необходимо, увеличена доза Альвеско® или назначено парентеральное применение кортикостероидов. Лечение тяжелых обострений бронхиальной астмы обычное.
Ингаляционные кортикостероиды могут вызывать системные эффекты, особенно при применении в высоких дозах в течение длительного времени. Однако появление системных эффектов более вероятно при применении пеоральных кортикостероидов. Возможные системные эффекты включают синдром Кушинга и кушингоподобные симптомы, такие как угнетение функции надпочечников с гипогликемическими эпизодами, замедление роста у детей и подростков, уменьшение плотности кости, катаракту и глаукому. Именно поэтому важно, чтобы доза ингаляционного кортикостероида снижалась до наименьшей, при которой ведется удовлетворительный контроль за проявлениями заболевания.
Применение препарата Альвеско® должно сопровождаться снижением потребности в парентеральном применении кортикостероидов.
Для пациентов, переведенных с пероральной терапии ГКС на ингаляционное лечение препаратом Альвеско®, может сохраняться риск снижения функции коры надпочечников в течение значительного периода времени после перевода. Возможность развития нежелательных эффектов от применения пероральных ГКС может сохраняться в течение некоторого времени после их отмены. В подобных случаях перед лечением рекомендуется проводить специальное исследование с целью определения степени снижения функции надпочечников. Всегда следует принимать во внимание возможность остаточного ухудшения функции коры надпочечников в критической ситуации (терапевтической или хирургической) и в других индивидуальных случаях, которые могут быть вызваны стрессовой реакцией; вследствие этого следует начинать соответствующее лечение кортикостероидами.
В случае недостаточного терапевтического ответа или серьезных обострений дозу препарата Альвеско® следует увеличить; если необходимо, то следует применять пероральные ГКС.
В случае развития инфекции следует применять антибиотики.
Не следует резко прекращать лечение препаратом Альвеско®.
Парадоксальный бронхоспазм с усилением хрипов и другие симптомы сужения бронхов, появившиеся непосредственно после ингаляции, следует лечить с помощью быстродействующего бронхорасширяющего средства, что обычно приводит к быстрому облегчению. Пациента необходимо осмотреть, и продолжать терапию препаратом Альвеско® только в том случае, если после взвешенного рассмотрения ожидаемый эффект выше, чем возможный риск. Следует принимать во внимание взаимосвязь между степенью тяжести астмы и общей предрасположенностью к острым бронхиальным реакциям.
Следует проводить регулярный контроль техники выполнения ингаляции пациентами, чтобы убедиться, что прием ингаляционной дозы происходит правильно и поступление активного вещества в легкие оптимально.
Перевод пациентов, принимавших пероральные ГКС, на Альвеско®
При переводе на Альвеско® и последующем ведении пациентов, получавших лечение пероральными ГКС, требуется контроль врача, т.к. восстановление сниженной функции надпочечников, вызванной продолжительной систематической терапии ГКС, может занять некоторое время.
У пациентов, получавших системные ГКС в течение длительного времени или в высокой дозе, может наблюдаться подавление функции надпочечников. Функцию надпочечников у этих пациентов необходимо контролировать регулярно, и дозу системных ГКС следует уменьшать постепенно.
После приблизительно одной недели может быть начато постепенное исключение системных ГКС с уменьшением их ежедневной дозы на 1 мг преднизолона, или его эквивалент. При поддерживающей дозе преднизолона более 10 мг ежедневно, может оказаться целесообразным более значительное снижение дозы в течение недельных интервалов, при этом необходима осторожность.
Некоторые пациенты могут плохо себя чувствовать во время отмены препарата, несмотря на сохранение или даже улучшение дыхательной функции. Их необходимо обследовать на наличие адренокортикальную недостаточность.
Пациенты, переведенные с перорального приема кортикостероидов, у которых функция надпочечников еще ослаблена, должны иметь при себе карту предупреждения, указывающую, что они нуждаются в дополнительных системных ГКС во время периодов стресса (например, ухудшении приступов удушья, торакальных инфекциях, значительных интеркуррентных заболеваниях, оперативных вмешательствах, травмах и т.д.).
При переводе пациентов с приема системных ГКС на ингаляционную терапию могут проявляться аллергические реакции (например, аллергический ринит, экзема), которые раньше были подавлены системными препаратами. В таких случаях следует проводить симптоматическую терапию антигистаминными средствами, в т.ч. препаратами для наружного и местного применения, содержащими ГКС.
Использование в педиатрии
Применение препарата у детей в возрасте до 6 лет противопоказано.
Действие ингаляционных ГКС при длительном применении у детей до конца не выяснено. Врач должен постоянно наблюдать за развитием роста детей, принимающих ГКС в течение длительного периода. Если рост замедляется, то терапию следует пересмотреть с целью уменьшения дозы ингаляционного ГКС, по возможности, до минимальной эффективной, которая позволяет контролировать симптомы бронхиальной астмы.
Влияние на способность к вождению автотранспорта и управлению механизмами
Влияние Альвеско® на способность к вождению автотранспорта и управлению механизмами не специально не изучалось и представляется маловероятным.
Передозировка
Острая передозировка
Симптомы: ингаляционное применение однократной дозы 2880 мкг циклесонида у здоровых добровольцев переносилось хорошо. Возможность острых токсических эффектов вслед за передозировкой ингаляционного циклесонида низка. Возможно усиление побочных эффектов.
Лечение: после острой передозировки необходимость специфического лечения отсутствует.
Хроническая передозировка
Симптомы: после продолжительного введения 1280 мкг циклесонида не наблюдалось клинических признаков подавления надпочечников. Однако если превышение рекомендованной дозы продолжается в течение сверхдлительного периода времени, некоторая степень подавления надпочечников не может быть исключена. Возможно усиление побочных эффектов.
Лечение: рекомендуется контролировать функцию надпочечников. В случаях передозировки Альвеско® терапия может быть продолжена дозой, достаточной для поддержания терапевтического эффекта.
Лекарственное взаимодействие
По данным in vitro CYP3A4 является основным ферментом, вовлеченным в метаболизм активного метаболита циклесонида — M1 (дезциклесонида) у человека.
Концентрация циклесонида и его активных метаболитов в сыворотке низкая, обычно не предполагается его существенное влияние на метаболизм других медицинских препаратов. Однако при совместном применении сильного ингибитора изофермента CYP3А4 (например, кетоконазола, итраконазола, нелфинавира или ритонавира) должно быть тщательно обосновано, т.к. концентрация циклесонида и его метаболитов в сыворотке может увеличиться и риск системных побочных эффектов кортикостероидов (например, синдром Кушинга) не может быть исключен.
В исследованиях лекарственного взаимодействия между циклесонидом и кетоконазолом, в качестве сильного ингибитора CYP3A4, влияние на активный метаболит дезциклесонид увеличивалось примерно в 3.5 раза, тогда как влияния на циклесонид отмечено не было. Исходя из этого, следует избегать одновременного применения потенциальных ингибиторов CYP3A4 и циклесонида, за исключение случаев, когда ожидаемая польза терапии превышает риск развития системных побочных эффектов ГКС.
Исследование взаимодействия циклесонида и субстрата CYP3A4 эритромицина не показало никакого взаимодействия между ними.
Срок годности препарата
Срок годности — 3 года.
Содержимое баллона находится под давлением. Баллон нельзя вскрывать и подвергать нагреванию выше 50°С.