При произношении таких словосочетаний как «аппарат ИВЛ», «искусственная вентиляция», большая часть обычных людей рисуют для себя в голове очень большое и шумное устройство, позволяющее поддерживать дыхание человека. На самом деле, на сегодняшний день, габариты и вес таких аппаратов может существенно различаться. Так, например, вес портативного аппарата ИВЛ составляет приблизительно 1,5 кг.
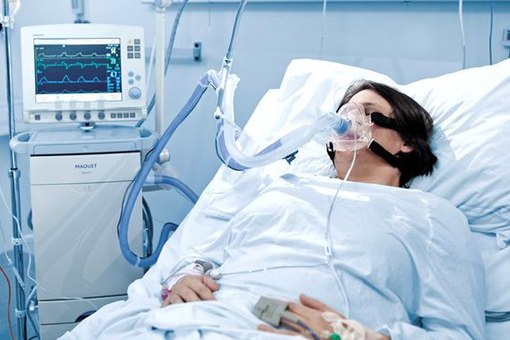
Рис. 1. Применение аппарата ИВЛ
Многие пациенты испытывают беспокойство по поводу работы аппарата ИВЛ, и это достаточно обосновано в связи с тем, что безопасность и наибольшая эффективность функционирования аппарата достигается благодаря правильному выбору и настройке прибора. Группа пациентов, которая может поддерживать дыхательные функции организма в домашних условиях, как правило, останавливает свой выбор на портативных устройствах и производят их настройку исходя из назначений медицинских специалистов. Необходимость аппарата ИВЛ возникает при остановке дыхания (для респираторной поддержки) или при возникновении одышки.
При выборе аппарата ИВЛ пациентам необходимо обратить внимание на несколько основополагающих моментов, среди которых — возможность насыщения воздуха кислородом, поскольку одна группа приборов производит введение кислорода только под высоким давлением, а другая часть устройств подключается к кислородным концентраторам, однако процесс их настройки несколько более сложный.
В связи с технологическим прогрессом, доступность аппаратов ИВЛ для домашнего применения увеличивается с каждым днем, но перед осуществлением покупки такого рода оборудования необходима консультация врача.
Аппарат ИВЛ: принцип работы
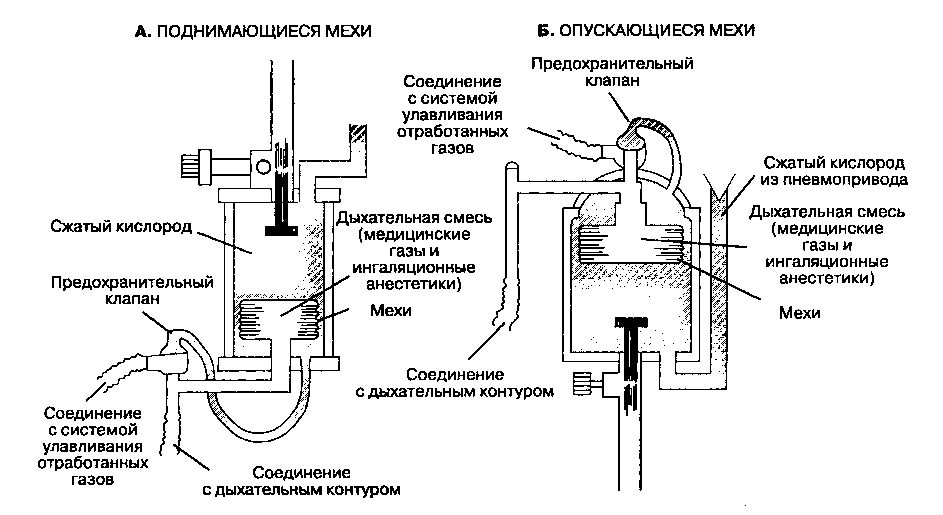
Рис. 2 Принцип работы аппарата ИВЛ
Аппарат ИВЛ состоит из нескольких основных частей таких как компрессор, электронные схемы, датчики, система клапанов.
Прибор способствует поступлению газовой смеси с необходимой и допустимой концентрацией кислорода в легкие пациента под давлением. В процессе его функционирования должна быть соблюдена цикличность воздуха, переключение инспирации и экспирации должно производиться с соблюдением потока, объема и давления воздуха при определенных временных параметрах. На этапе инспирации производится контролируемая вентиляция, в остальных случаях прибор осуществляет поддержку инстинктивному дыханию пациента.
Подключаться аппарат ИВЛ может двумя способами: инвазивным и неинвазивным. При неинвазивном способе подключения подача воздуха осуществляется по трубке и выводится через маску, при инвазивном же способе подключения воздушная смесь подается по интубационной трубке, введенной в трахеостому или дыхательные пути.
Клинические показания к ИВЛ
В тяжелых случаях, когда состояние больного невозможно детально обследовать или отсутствует необходимое оснащение медицинского учреждения, основными показаниями к искусственной вентиляции являются:
- остро развившееся нарушение ритма дыхания, патологические ритмы;
- отсутствие самостоятельного дыхания (апноэ);
Данные пункты являются абсолютными показаниями к ИВЛ. Остро возникшие нарушения дыхательного ритма свидетельствуют о глубоких нарушениях центральной регуляции дыхания. Исключением являются больные с сердечной недостаточностью и диффузным атеросклеротическим поражением головного мозга. В данном случае достаточно часто возникает дыхание типа Чейна — Стокса, которое получается устранить фармакологическими препаратами.
- учащение дыхания более 40/мин., в случае, не связанном с гипертермией (t тела более 38,5°С) или выраженной не устраненной гиповолемией;
Данное показание является относительным. Значение 40 — условное, однако его принимают за рубеж, при наступлении которого с легкостью может наступить декомпенсация самостоятельного дыхания.
- клинические проявления нарастающей гипоксемии и/или гиперкапнии.
В случае их сохранения после использования консервативных методов (кислородная терапия, обезболивание, восстановление дыхательных путей).
Данные проявления можно считать одними из самых важных критериев. Благодаря динамическому наблюдению можно выявить и определить степень выраженности основных симптомов, особенное значение, как правило, придают нарушениям сознания и психики, которые являются свидетельством гипоксической энцефалопатии. В отдельных случаях настоящие симптомы регрессируют после восстановления дыхательных путей, обезболивания и кислородных ингаляций. В случае же быстрого нарастания гипоксической клиники, не следует ожидать положительных эффектов от консервативных мероприятий, и необходима ИВЛ.
Классификация высокотехнологичных аппаратов ИВЛ
Современные высокотехнологичные аппараты ИВЛ позволяют осуществлять поддержку дыхания больным по составу, давлению и объему поступающего кислорода. Кроме того, современные устройства могут синхронизировать состояние больного и поступление воздуха: управляющие сигналы направляются в диафрагму по диафрагмальному нерву после чего датчики прибора их фиксируют.
Еще одним важным критерием является наличие во всех современных аппаратах сигнализации, срабатывающей в случае поломки или возникновении неконтролируемых ситуаций.
Классификация приборов производится по следующим группам:
- возраст пациента,
- разделяется на пять групп: с 1 по 3 — для детей старше 6 лет и взрослых; 4 группа — дети до 6 лет; 5 группа — новорожденные до 1 года.
Способ действия:
- внутренний;
- наружный;
- с использованием дыхательных электростимуляторов;
Тип привода:
- электрический;
- ручной;
- пневматический;
- комбинированный.
Предназначение:
- стационарные;
- портативные (переносные).
Сфера применения:
- Специального медицинского назначения.
- Применяются для поддержания жизни новорожденных, оказания неотложной помощи, проведения бронхоскопии и т. д.
- Общего медицинского назначения.
- Необходимы для лечебных учреждений, осуществляющих терапию, анестезию, реанимацию и т. д.
Тип управляющего устройства:
- микропроцессорные (интеллектуальные);
- мемикропроцессорные.
Аппараты ИВЛ высокочастотного струйного типа
Рис. 3 Высокочастотный аппарат ИВЛ TwinStream Carl Reiner (Австрия)
Одним из наиболее важных медицинских приборов является высокочастотный струйный аппарат ИВЛ, который позволяет производить обеспечение как высокочастотной струйной вентиляцией (циклическая частота более 50 мин), так и нормочастотной, и сочетанной ИВЛ. Благодаря контролю давления, аппарат позволяет предотвратить возможность возникновения легочной баротравмы, а новейшие специальные системы способствуют насыщению поступающего воздуха влагой, что позволяет исключить риск осушения или переохлаждения организма пациента.
На сегодняшний день, наличие аппаратов ИВЛ необходимо как в службах скорой и неотложной помощи, так и в стационарных отделениях.
4.1. ОСТРАЯ ДЫХАТЕЛЬНАЯ НЕДОСТАТОЧНОСТЬ
А.Л. Ершов, В.А. Волчков
ОПРЕДЕЛЕНИЕ
Под синдромом острой дыхательной недостаточности (ОДН) понимают быстро развивающееся патологическое состояние, при котором самостоятельное дыхание пациента окружающим воздухом или не в состоянии обеспечить нормальный газовый состав крови (paO2-92-100 мм рт.ст., мм рт.ст.), или это достигается за счет чрезмерного напряжения компенсаторных механизмов, приводящему к их быстрому истощению.
В значительной части случаев ОДН характеризуется гипоксемией в сочетании с гипоили гиперкапнией. Как правило, синдрому сопутствуют нарушения гемодинамики различной степени выраженности.
Для развития ОДН требуется небольшой промежуток времени (минуты и часы, реже — сутки). В этом заключается одно из его отличий от синдрома хронической дыхательной недостаточности, когда респираторные расстройства нарастают на протяжении многих месяцев или даже лет. Второе отличие — пациент с впервые развившейся ОДН всегда плохо адаптирован к резким изменениям газового состава крови, в связи с чем его общее состояние значительно тяжелее, чем у больного с хронической дыхательной недостаточностью, имеющего близкие или даже более выраженные отклонения от нормы в лабораторных показателях. Пациенту с ОДН во всех случаях показана экстренная медицинская помощь.
В качестве особого варианта развития синдрома ОДН следует рассматривать эпизоды резкого ухудшения хронической дыхательной недостаточности, когда состояние пациента становится существенно более тяжелым, чем во время привычных для него суточных колебаний самочувствия. В подобных ситуациях стандартная для больного медикаментозная терапия обычно не приносит облегчения.
КЛАССИФИКАЦИЯ
Предложено много подходов к классификации ОДН. Часть из них основаны на различиях в этиологии синдрома, другие — на особенностях клинических проявлений ОДН, а третьи — на патогенетических вариантах формирования состояния. Все эти подходы в той или иной степени используются в практической и научно-исследовательской работе, взаимно дополняя друг друга.
Наиболее часто применяют этиологическую, патогенетическую и клиническую классификацию ОДН.
Этиологическая классификация острой дыхательной недостаточности
Различают первичную (нарушение доставки кислорода к альвеолам) и вторичную (нарушение транспортировки кислорода от альвеол к тканям) ОДН. Причины первичной ОДН:
-
нарушение проходимости дыхательных путей;
-
уменьшение дыхательной поверхности легких;
-
нарушение центральной регуляции дыхания;
-
нарушение передачи импульсов в нервно-мышечном аппарате, вызывающее расстройство механики дыхания;
-
другие патологии, нарушающие доставку кислорода к альвеолам.
Причины вторичной ОДН:
-
гипоциркуляторные нарушения;
-
нарушения микроциркуляции;
-
гиповолемические расстройства;
-
кардиогенный отек легких;
-
ТЭЛА;
-
шунтирование (депонирование) крови при шоковых состояниях.
Патогенетическая классификация острой дыхательной недостаточности
Различают вентиляционную и паренхиматозную (легочную) форму ОДН.
Причины паренхиматозной формы ОДН (ОДН I типа):
-
нарушение эластичности легочной ткани, сужение и обструкция дыхательных путей;
-
нарушение диффузии газов и кровотока в легких.
Причины вентиляционной формы ОДН (ОДН II типа):
-
поражение дыхательного центра любой этиологии;
-
нарушения в передаче импульсов в нервно-мышечном аппарате;
-
повреждение грудной клетки, легких;
-
изменение нормальной механики дыхания при патологии органов брюшной полости.
Клиническая классификация острой дыхательной недостаточности
В клинической практике принята следующая классификация ОДН:
-
ОДН центрального генеза — наблюдают при некоторых отравлениях, ЧМТ, инсульте и др.;
-
ОДН, связанная с обструкцией дыхательных путей, — при попадании ИТ в дыхательные пути, ларинго- и бронхоспазме и др.;
-
ОДН, обусловленная нарушениями нервно-мышечной передачи, — при миастении, столбняке, миопатиях и др.;
-
ОДН при нарушении диффузии газов через альвеолярно-капиллярную мембрану — при пневмониях, отеке легких, обострении хронических заболеваниях легких с нарастанием дыхательной недостаточности (эмфизема, пневмосклероз);
-
ОДН, связанная с повреждениями и заболеваниями дыхательного аппарата, — при тяжелых травмах грудной клетки, пневмо- и гемотораксе и др.;
-
ОДН смешанного типа — при сочетании нескольких механизмов формирования синдрома ОДН.
КЛИНИЧЕСКАЯ КАРТИНА
Клинические проявления ОДН могут варьировать от скудных, маловыраженных признаков до чрезвычайно ярких симптомов. Так, например, вентиляционная дыхательная недостаточность на фоне комы, вызванной передозировкой опиатов и седативных лекарственных препаратов, сопровождается умеренно выраженной клинической симптоматикой — обращает на себя внимание лишь миоз, поверхностное дыхание. У большинства пациентов нарастание paCO2 приводит к стимуляции дыхательного центра, что проявляется увеличением частоты и глубины дыхания. У лиц, находящихся в состоянии наркотического опьянения, этого не происходит. Более того, ингаляция кислорода может привести к дальнейшему снижению объема вентиляции легких, иногда вплоть до развития апноэ. Похожую реакцию на оксигенотерапию с избыточным потоком кислорода нередко отмечают у пациентов с обострением ХОБЛ.
Первым клиническим симптомом дыхательной недостаточности чаще всего бывает ощущение больным нехватки воздуха (диспноэ). Дыхание становится вначале более глубоким, затем — частым. При непроходимости верхних дыхательных путей одышка носит инспираторный, при бронхиальной непроходимости — экспираторный характер. В случае преобладания рестриктивных процессов и шунтирования крови сразу повышается частота дыхания.
Если гипоксемия протекает с гипокапнией (паренхиматозный вариант ОДН), то в развитии клинической картины можно выделить три последовательных стадии (по В.Л. Кассиль и Н.М. Рябовой, 1977).
-
I стадия. Первые симптомы — изменения психики. Больные несколько возбуждены, напряжены, негативны по отношению к окружающим, жалуются на головную боль. Кожа холодная, бледная и влажная. Характерен легкий цианоз видимых слизистых оболочек, ногтевых лож. Артериальное давление (АД), особенно диастолическое, повышено; наблюдают тахикардию.
-
II стадия. Сознание спутано, отмечают агрессивность и двигательное возбуждение. При быстром нарастании гипоксии могут быть судороги. Выражен цианоз кожных покровов. Характерны стойкая артериальная гипертензия, тахикардия, иногда экстрасистолия. Возможны непроизвольное мочеиспускание и дефекация.
-
III стадия (гипоксическая кома). Сознание отсутствует, возникают судороги, зрачки расширены. Кожные покровы синюшного цвета, с мраморным рисунком. АД критически падает. Выявляют стойкие, угрожающие жизни нарушения ритма сердца. Если больному не оказывают адекватную помощь, то наступает летальный исход.
При сочетании гипоксемии с гиперкапнией (вентиляционный вариант ОДН) также выделяют три стадии.
-
I стадия. Больные эйфоричны, много разговаривают, но речь из-за одышки прерывистая. Кожа теплая, гиперемированная; отмечают усиленное потоотделение. Характерны тахикардия, высокое АД и ЦВД.
-
II стадия. Больные возбуждены, иногда беспричинно веселы, не отдают себе отчета в тяжести своего состояния. Кожный покров синюшно-багрового цвета. Отмечают обильное потоотделение, гиперсаливацию и бронхиальную гиперсекрецию. Характерны выраженная артериальная и венозная гипертензия, сохраняется стойкая тахикардия.
-
III стадия — гиперкапническая кома. Сознание постепенно угасает. Внешне может создаваться обманчивое впечатление, что больной «успокоился», задремал, однако без оказания адекватной помощи пациент довольно быстро впадает в карбонаркоз. Зрачки вначале сужены, затем быстро расширяются до максимальных размеров. Отмечают арефлексию. Кожные покровы цианотичны. АД снижено, пульс аритмичный. При отсутствии квалифицированной помощи наступает летальный исход. Следует отдельно рассмотреть развитие утомления и недостаточности дыхательной мускулатуры — важнейших клинических симптомов ОДН.
-
Начальным признаком утомления дыхательных мышц нередко служит изменение частоты дыхания. Повышение частоты вдохов свыше 25 в минуту, как правило, отражает начальную стадию утомления респираторной мускулатуры. Смена тахипноэ на брадипноэ — более серьезный прогностический симптом (вслед за этим нередко наступает остановка дыхания).
-
Вовлечение в акт дыхания вспомогательной мускулатуры (мышцы верхнего плечевого пояса, экспираторной мускулатуры, раздувание крыльев носа, синхронное с дыханием активное сокращение брюшных мышц во время выдоха) — важный клинический признак наступающей декомпенсации у пациентов с ОДН. В крайних случаях утомления и слабости дыхательных мышц наблюдают дискоординированные подергивания межреберных мышц, развитие парадоксального дыхания (втягивание брюшной стенки на вдохе).
По современным представлениям, цианоз ногтевых лож и слизистой оболочки губ — достаточно поздний симптом ОДН. Его преимущественно наблюдают в запущенных случаях, когда значительно снижается напряжение кислорода в артериальной крови. Исследования, выполненные L. Martin и соавт. еще в начале 1990-х годов, показали, что у лиц с нормальным содержанием гемоглобина заметный для глаза цианоз возникает при paCO2 <50 мм рт.ст. (или при значениях SaO2 <85%). У пациентов с низким уровнем гемоглобина цианоз вовсе может отсутствовать, несмотря на очевидные внешние проявления других симптомов ОДН. Следует учитывать, что оценка выраженности цианоза у пациентов с ОДН отличается субъективностью, существенно зависит от условий освещенности, а также от особенностей врожденной окраски кожного покрова у больного (у смуглых людей цианоз выявляют позднее).
Для верификации диагноза ОДН врач СМП использует доступные средства инструментального и лабораторного контроля. На современном этапе оснащения бригад обязательно применение пульсоксиметрии. Включение в табель оснащения портативных капнометров или капнографов значительно расширяет диагностические возможности при оказании экстренной медицинской помощи. Данные капнометрии (оценки содержания углекислого газа в выдыхаемом воздухе) служат ценной информацией о процессах вентиляции, позволяющей дифференцировать варианты развития ОДН и объективно оценивать степень ее тяжести.
Концентрация углекислого газа в конце фазы выдоха (petCO2) у большинства пациентов совпадает или незначительно отличается от напряжения углекислого газа в артериальной крови. Признаком вентиляционной ОДН следует считать выявление petCO2, равное или превышающее 50 мм рт.ст., особенно при тенденции к дальнейшему увеличению данного показателя в процессе наблюдения за пациентом. Нормальные значения petCO2 составляют 35-45 мм рт.ст.
В последние годы часть специализированных машин СМП оснащают портативными биохимическими анализаторами, позволяющими, в числе прочих исследований, выполнить анализ газового состава артериальной крови. Это исследование имеет определяющее значение при оценке формы (вентиляционная, паренхиматозная) и степени тяжести ОДН.
В табл. 4-1 представлены критерии оценки типа и глубины ОДН по данным исследования газового состава крови.
Советы позвонившему
Диспетчер СМП должен уточнить обстоятельства, предшествующие эпизоду нарушения дыхания, а также выяснить ключевые данные анамнеза (указания на хроническую легочную или сердечнососудистую патологию, наличие подобных приступов в прошлом). Дальнейшие советы по оказанию первой помощи зависят от полученной информации и носят, по возможности, дифференцированный характер.
Основные положения по оказанию первой помощи при заболеваниях и патологических состояниях, сопровождающихся высокой вероятностью развития ОДН, изложены в соответствующих разделах данного пособия. В тех случаях, когда позвонивший диспетчеру не обладает достаточной информацией о пациенте, следует исходить из двух возможных вариантов: пациент в сознании или в бессознательном состоянии.
Таблица 4-1. Тип и глубина острой дыхательной недостаточности по данным исследования газового состава артериальной крови (по Ю.Н. Шанину и А.Л. Костюченко, 1982)
|
Состояние |
Вентиляционная ОДН |
Паренхиматозная ОДН |
|||
|
paCO2, мм рт.ст. |
paCO2, мм рт.ст. |
paCO2, мм рт.ст.. |
paCO2, мм рт.ст. |
гемоглобин оксигениро-ванный (HbO2), % |
|
|
Норма |
36-44 |
80-96 |
36-44 |
80-96 |
94-97 |
|
Умеренная ОДН |
46-55 |
79-65 |
32-38 |
65-79 |
90-93 |
|
Выраженная ОДН |
56-65 |
64-55 |
30-40 |
55-64 |
80-89 |
|
Запредельная ОДН |
70-85 |
54-45 |
28-42 |
45-54 |
70-79 |
|
Гиперкапническая кома |
90-130 |
44-35 |
— |
— |
— |
|
Гипоксемическая кома |
— |
— |
26-44 |
30-39 |
55-69 |
Если пациент с ОДН находится в бессознательном состоянии, позвонившему необходимо выполнить следующее:
-
при подозрении на ингаляционное отравление токсичными соединениями (угарный газ и другие ядовитые продукты горения, пары и аэрозоли токсичных жидкостей и т.д.) пациента, находящегося в помещении, немедленно перенести в безопасную зону с доступом свежего воздуха;
-
освободить полость рта от возможных ИТ (рвотные массы, зубные протезы и др.) — обследование полости выполняют указательным пальцем с намотанным на него носовым платком или тряпкой;
-
принять меры к снижению риска обтурации верхних дыхательных путей языком, придав пациенту соответствующее положение на боку или запрокинув голову назад и выдвинув вперед нижнюю челюсть;
-
расстегнуть или снять тесную одежду, мешающую нормальному дыханию пациента;
-
тучным пациентам желательно придать полусидячее положение для увеличения экскурсий диафрагмы;
-
при наступлении у пациента апноэ — провести ИВЛ методом «изо рта в рот» до прибытия бригады скорой помощи;
-
при сочетании апноэ с остановкой сердечной деятельности — приступить к первичной СЛР по стандартной схеме (чередовать 30 компрессий грудной клетки за счет толчкообразного нажатия на нижнюю треть грудины с частотой от 100 до 110 в минуту с двумя вдохами «изо рта в рот»).
Если пациент в сознании и способен к продуктивному общению, следует уточнить обстоятельства ухудшения дыхания (обострение хронического легочного заболевания, предшествующие интенсивные боли в области сердца, аллергическая реакция на запахи или прием пищи, тупая травма груди, проникающее ранение грудной клетки; попадание в дыхательные пути ИТ и т.д.) и дать рекомендации по оказанию помощи в зависимости от полученной информации (см. соответствующие разделы настоящего руководства).
ЛЕЧЕНИЕ
Скорая медицинская помощь на догоспитальном этапе
При оказании помощи пациенту с проявлениями ОДН на догоспитальном этапе целесообразно придерживаться следующей тактики.
-
Краткий сбор анамнеза и одновременно — первичный осмотр пациента [14] (оценка цвета и влажности кожного покрова, частоты дыхания, показателей гемодинамики; аускультация сердца и легких; оценка сатурации кислорода — SpO2).
-
Проведение экстренной терапии — восстановление проходимости дыхательных путей при наличии самостоятельного дыхания с удовлетворительной глубиной и частотой (от 8 до 25-30 в минуту). Необходимо начать оксигенотерапию и быть готовым к переводу пациента на ИВЛ при более выраженных изменениях частоты дыхания, возникновении апноэ или при очевидной неэффективности оксигенотерапии.
-
Повторный, более углубленный осмотр пациента; применение средств инструментальной диагностики — пульсоксиметрии, капнометрии, ЭКГ, контроль уровня гликемии и т.д.
-
Постановка предварительного диагноза.
-
Проведение дифференцированной медикаментозной терапии в зависимости от индивидуальных, нозологических и патогенетических особенностей развития ОДН у пациента.
-
У пациентов, переведенных на ИВЛ, — оптимизация режима (в том случае, если аппарат имеет несколько режимов ИВЛ), подбор параметров респираторной поддержки.
-
Принятие решения о транспортабельности и оправданности госпитализации пациента; целесообразности вызова специализированной бригады скорой помощи, а также допустимости оставления больного на дому с дальнейшим амбулаторно-поликлиническим наблюдением.
[15]
При сборе анамнеза в первую очередь необходимо уточнить обстоятельства ухудшения состояния. Немаловажное значение имеют сведения об эпизодах нарушения дыхания в прошлом: чем вызывались, какое лечение проводилось и с каким эффектом; знает ли пациент о наличии у него легочной или сердечнососудистой патологии, лекарственной или пищевой непереносимости, аллергии при контакте с теми или иными веществами. Следует выяснить данные о принимаемых лекарственных препаратах, применении наркотических веществ в немедицинских целях.
При внешнем осмотре пациента с ОДН оценивают степень сохранности сознания, наличие или отсутствие вынужденного положения тела, степень вовлеченности в акт дыхания вспомогательной респираторной мускулатуры, наличие цианоза и гипергидроза, глубину и частоту дыхания, равномерность дыхательных движений грудной клетки справа и слева, патологическое дыхание. Затем выполняют перкуссию и аускультацию органов грудной клетки, пальпацию органов брюшной полости (ОДН может сопутствовать панкреатиту, перитониту). Перкуссия легких — более чувствительный метод по сравнению с аускультацией на начальных этапах развития сегментарной и долевой пневмонии, а также при диагностике пневмоторакса. Именно поэтому выполнение данного метода считают обязательным.
Восстановление проходимости дыхательных путей включает освобождение полости рта от ИТ и санацию ТБД. При попытках откашливания полезно провести вибрационный массаж грудной клетки (быстрые и интенсивные похлопывания ладонной поверхностью кистей рук по задним и боковым участкам грудной клетки). У пациентов в бессознательном состоянии для профилактики западания языка вводят ротовой или носовой воздуховод. Последний тип воздуховодов предпочтительнее, так как они плотно фиксируются в носовых ходах и не склонны к дислокации. Кроме того, носовые воздуховоды не могут быть пережаты зубами в случае возникновения непроизвольного гипертонуса жевательной мускулатуры.
Пациентам с явлениями ОДН показано постоянное мониторирование с помощью портативного пульсоксиметра, а также капнометра или капнографа (при их наличии). Капнография — ценный метод контроля эффективности процессов вентиляции в альвеолах, предоставляющей врачу информацию, которую невозможно получить с помощью пульсоксиметрии. Капнографию относительно давно и широко используют при оценке адекватности параметров ИВЛ, однако этим далеко не исчерпываются диагностические возможности данного метода. Так, например, капнография позволяет верифицировать нахождение интубационной трубки в трахее, своевременно корректировать параметры ИВЛ при гипер- и гиповентиляции, выявить разгерметизацию дыхательного контура аппарата ИВЛ и т.д. Кривая капнографии может помочь при диагностике остановки сердечной деятельности, а значения petCO2 обладают высокими прогностическими свойствами в ходе выполнения СЛР.
Пациентам с ОДН показано постоянное монито-рирование ЭКГ. АД измеряют 1 раз в 10-15 мин, а при нестабильной гемодинамике интервалы между измерениями еще больше сокращают.
У пациентов с частым и поверхностным дыханием на фоне нарушенного сознания рекомендуют определение уровня гликемии, так как подобная симптоматика нередко встречается при кетоацидотической диабетической коме (вариант дыхания Куссмауля). При выявлении высокого уровня глюкозы в плазме крови тахипноэ не следует рассматривать в качестве показания к переводу на ИВЛ. Этот феномен, как правило, носит компенсаторный характер и служит своеобразным «противодействием» прогрессирующему кетоацидозу за счет респираторного алкалоза. Попытки во время ИВЛ принудительно навязать «нормальную» частоту дыхания у больных с диабетическим кетоацидозом закономерно приводят к нарастанию метаболических расстройств и дальнейшему ухудшению их состояния. Частота дыхания у пациентов с кетоацидотической комой нормализуется на фоне адекватного медикаментозного лечения и улучшения общего состояния больного (см. соответствующий раздел настоящего руководства).
Оксигенотерапия предусматривает ингаляцию кислорода через носовой катетер или лицевую маску (при отсутствии нарушений сознания). С помощью носовых катетеров подают 100% кислород со скоростью 1-6 л/мин. Преимущество носовых катетеров — быстрая и легкая адаптация к ним пациентов. Носовые катетеры удобнее и меньше ограничивают больного, чем лицевые маски. При потоке кислорода со скоростью 5-6 л/мин использование носовых катетеров позволяет повысить фракционную концентрацию кислорода во вдыхаемой дыхательной смеси (FiO2) до 45%. Дальнейшее повышение потока кислорода, подаваемого через катетер, обычно не сопровождается повышением FiO2.
Альтернативой носовым катетерам служит носоротовая маска для ингаляции кислорода. Стандартные ингаляционные маски снабжены открытыми клапанами, позволяющими выдыхаемому воздуху выводиться в окружающую среду. Однако такие клапаны при чрезмерной минутной вентиляции легких способствуют разбавлению кислорода атмосферным воздухом. Стандартные лицевые маски позволяют быстрее подавать кислород (до 15 л/мин), чем носовые катетеры, и соответственно обеспечивать более высокую FiO2 (до 50-60%). Вместе с тем присутствуют некоторые конструктивные ограничения при использовании таких масок у пациентов с высокой минутной вентиляцией легких.
Первоначальный поток кислорода при оксигенотерапии устанавливают на уровне 4-6 л/мин, затем осуществляют корректировку потока исходя из значений пульсоксиметрии. Как правило, эффект от оксигенотерапии расценивают как удовлетворительный, если уровень SpO2 ≥92%. В таких случаях поток кислорода можно постепенно уменьшить, не допуская при этом снижения сатурации гемоглобина менее 92%.
У пациентов с тяжелым обострением ХОБЛ при оксигенотерапии поток кислорода не должен превышать 1-2 л/мин. Кратковременное превышение данного значения допустимо лишь для ликвидации крайне выраженной гипоксемии. Следует иметь в виду, что при длительном течении ХОБЛ практически прекращается стимуляция дыхания повышенным содержанием в крови углекислого газа (таким образом, больные «адаптируются» к постоянной гиперкапнии), но ответная реакция организма на снижение в крови концентрации кислорода не нарушается. Активная оксигенотерапия, быстро приводящая к нормализации уровня кислорода в крови, а затем и к гипероксии, опасна возможным наступлением апноэ. При чрезмерном потоке кислорода у пациентов с обострением ХОБЛ, как правило, остановке дыхания предшествует тяжелая и малочувствительная к медикаментозному лечению артериальная гипотензия.
Больным с тяжелой формой ОДН необходима экстренная госпитализация. Транспортировку пациента до машины скорой помощи и от машины до ОСМПС осуществляют на каталке с приподнятым головным концом или в полусидячем положении. При угрозе западения языка пациента укладывают на бок, при наличии показаний используют воздуховоды или выполняют интубацию трахеи. Некоторые пациенты с ОДН лучше переносят транспортировку на сидячей («кресельной») каталке. Во время транспортировки продолжают ранее начатую респираторную поддержку, контролируя проходимость дыхательных путей и параметры гемодинамики.
Скорая медицинская помощь на стационарном этапе
Скорая помощь в условиях ОСМПС служит продолжением терапии, начатой на догоспитальном этапе. Однако стационар обладает существенно более широкими диагностическими возможностями по сравнению с бригадой СМП.
При поступлении в ОСМПС пациента с ОДН в тяжелом или крайне тяжелом состоянии переводят в ОРИТ или БИТ в составе профильного отделения больницы.
В ОРИТ обеспечивают постоянное наблюдение и интенсивный уход за больным. При наличии показаний пациента подключают к аппарату ИВЛ (или продолжают ранее начатую ингаляцию кислорода), выполняют катетеризацию центральной вены, по показаниям — артерии, а также проводят соответствующую медикаментозную терапию. Одновременно исследуют газовый состав и КОС артериальной или капиллярной крови, начинают мониторирование жизненно важных параметров организма. При отсутствии противопоказаний (острый ИМ, ОКС) выполняют лечебно-диагностическую бронхоскопию. У пациентов с чрезмерным образованием мокроты и ослабленным кашлевым рефлексом целесообразно проводить данную манипуляцию несколько раз в сутки. По показаниям выполняют КТ и МРТ органов грудной клетки, УЗИ внутренних органов и магистральных сосудов.
Пациенты, состояние которых оценивают как средней степени тяжести, наблюдаются и проходят первоначальное клинико-лабораторное обследование в ОСМПС. С учетом нозологической формы заболевания, вызвавшей развитие ОДН, показана консультация врача соответствующей специальности. Вопросы об объеме обследования, проводимой терапии, целесообразности госпитализации в профильное отделение решают коллегиально с врачом-специалистом.
В связи с высокой практической значимостью вопроса следует отдельно рассмотреть некоторые принципы ИВЛ при оказании СМП взрослым пациентам.
ИСКУССТВЕННАЯ ВЕНТИЛЯЦИЯ ЛЕГКИХ
Показания к применению искусственной вентиляции легких
В клинической практике для принятия решения о целесообразности перевода пациента с ДН на ИВЛ используют три группы критериев: клинические, инструментальные и лабораторные. В настоящее время на догоспитальном этапе применение портативных инструментальных и лабораторных средств контроля состояния пациентов с ОДН не представляет технических сложностей. Широкое внедрение данного оборудования ограничивается только относительно высокой стоимостью самих устройств и расходных материалов к ним. Нередко врач СМП начинает ИВЛ на основании краткого анамнеза и осмотра пациента.
Клинические показания к переводу пациента на ИВЛ:
-
остановка сердечной деятельности (в составе других реанимационных мероприятий);
-
остановка дыхательных движений (апноэ);
-
выраженные отклонения от нормы частоты дыханий (брадипноэ менее 8 или тахипноэ свыше 35 в минуту);
-
быстро нарастающая ДН, резистентная к проводимой ингаляции кислорода;
-
быстро нарастающее угнетение сознания у пациента с проявлениями гипоксии;
-
чрезмерное дыхание, приводящее к прогрессирующей усталости дыхательной мускулатуры и угрозе наступления апноэ;
-
быстро прогрессирующий цианоз и гипергидроз кожных покровов у пациента с ДН;
-
отек легких, резистентный к медикаментозной терапии;
-
кома с нарушением кашлевого и глотательного рефлекса;
-
появление и быстрое нарастание аускульта-тивного феномена «немой зоны» у пациентов с выраженной обструктивной или рестриктив-ной патологией.
Из методов инструментальной диагностики, используемых при решении вопроса о переводе пациента на ИВЛ, для службы скорой помощи наиболее доступна пульсоксиметрия. Показанием для ИВЛ следует считать падение SpO2 ниже 85%. Нормальные значения SpO2 — 94-98%%. У больных с хОбЛ нижняя граница относительной нормы SpO2 составляет 88-92%.
В тех случаях, когда бригада может использовать капнометрию (или капнографию), показанием к началу ИВЛ служит petCO2 ниже 25 или выше 60 мм рт.ст. У здоровых людей значения petCO2 составляют 36-43 мм рт.ст.
В настоящее время накапливается опыт применения некоторыми специализированными бригадами СМП портативных биохимических анализаторов. С их помощью стало возможным в течение нескольких минут оценить газовый состав крови и параметры КОС. В клинических условиях эти показатели играют важнейшую роль при оценке варианта развития и степени тяжести ДН. Перевод на ИВЛ показан при paO2 <60 мм рт.ст. и/или paO2 >55-60 мм рт.ст., pH ≤7,25.
В ситуациях, когда клинические признаки ОДН ярко манифестированы, нет оснований дожидаться снижения уровня SpO2 или повышения petCO2 до критических значений, указанных выше. В подобных случаях врач скорой помощи должен незамедлительно приступить к проведению респираторной поддержки, опираясь на данные осмотра и динамики состояния пациента.
Особенно тщательно следует подойти к решению вопроса о переводе на ИВЛ пациентов с обострением хронической дыхательной недостаточности. У данной категории больных инструментальные и лабораторные показатели, упомянутые выше, могут резко отличаться от нормальных значений даже в период относительного благополучия. По этой причине указанные критерии при решении вопроса о переводе на ИВЛ не всегда принципиально важны. У пациентов с хронической легочной патологией следует ориентироваться на степень выраженности клинических проявлений хронической дыхательной недостаточности.
Все случаи перевода пациента на ИВЛ необходимо обосновывать в карте вызова!
Обеспечение проходимости дыхательных путей
Различают инвазивный и неинвазивный варианты проведения ИВЛ. Инвазивный вариант ИВЛ подразумевает предварительную интубацию трахеи или наложение трахеостомы. Неинвазивный вариант ИВЛ (нИВЛ) предполагает использование средств доставки дыхательной смеси, не достигающих нижних дыхательных путей (т.е. не заходящих за уровень голосовых связок). К таким средствам можно отнести различные виды лицевых масок для ИВЛ, воздуховоды, ларингеальные маски и т.д.
В последние два десятилетия при оказании СМП нИВЛ рассматривают в качестве предпочтительного метода вентиляции. Его использование позволяет избежать многих осложнений, связанных с интубацией трахеи, а также обеспечивает больший комфорт во время ИВЛ у пациентов в сознании. Однако существует целый ряд противопоказаний и ограничений для применения нИВЛ (табл. 4-2). Врачам скорой помощи необходимо соблюдать их в своей работе.
Основной недостаток нИВЛ — сложность герметизации дыхательных путей, сопровождающаяся двумя негативными процессами: сбросом во время вдоха части дыхательного объема в атмосферу и повышенным риском аспирационных осложнений. В наибольшей степени эти недостатки свойственны нИВЛ, проводимой с помощью лицевых масок.
Как правило, у пациентов с гипоксическим вариантом ОДН эффективность нИВЛ ниже, чем при гиперкапнической форме синдрома. В последующем у 30-50% больных с исходной тяжелой гипоксией возникает необходимость в переводе на инвазивную ИВЛ. При гиперкапнической ОДН перевод пациента с нИВЛ на инвазивный вариант требуется значительно реже.
При использовании инвазивной ИВЛ традиционным способом обеспечения проходимости дыхательных путей служит оротрахеальная интубация под контролем прямой ларингоскопии. Данной методикой интубации должны владеть все врачи СМП.
В качестве возможной альтернативы оротрахеальной интубации рассматривают назотрахеальную интубацию, а также операцию трахеотомии или крикотиреотомии. В этом случае удобнее использовать одноразовые наборы для чрескожной дилатационной трахеостомии и коникотомии. На этапе оказания скорой помощи к выполнению указанных манипуляций допускают врачей, прошедших дополнительное обучение и имеющих необходимые навыки.
На некоторых современных аппаратах транспортной ИВЛ конструктивно предусмотрена возможность переключения с инвазивного варианта на неинвазивный [на импортных аппаратах «нИВЛ» нередко обозначают аббревиатурой «NIV» (от non-invasive ventilation)]. Активизация данной функции обычно предполагает частичную или полную компенсацию утечек нагнетаемого в легкие воздуха, так как выявленный аппаратом объем потерь дыхательной смеси автоматически добавляется к следующему принудительному вдоху.
Ниже представлены обобщенные данные о наиболее частых осложнениях интубации трахеи, а также подходы к выбору между инвазивным и неинвазивным способом ИВЛ (табл. 4-3).
Мерой профилактики некоторых из перечисленных осложнений интубации трахеи служит тщательная предварительная подготовка необходимого оборудования и инструментария:
Таблица 4-2. Противопоказания для неинвазивной вентиляции и критерии для перевода пациента на инвазивную вентиляцию легких
| Противопоказания для неинвазивной (масочной) вентиляции легких | Критерии для прерывания неинвазивной вентиляции легких и перехода к инвазивной ИВЛ |
|---|---|
|
Высокий риск аспирации — необходимость интубации для защиты дыхательных путей от аспирации (например, у пациентов с «полным желудком», при коме и т.д.) |
Неспособность больного переносить маску вследствие дискомфорта или боли |
|
Неспособность больного к откашливанию обильного секрета ТБД |
Неспособность масочной вентиляции улучшить газообмен или уменьшить диспноэ |
|
Невозможность плотного прилегания маски к лицу, приводящая к значительным утечкам воздуха, в том числе при челюстно-лицевых травмах или деформациях лица |
Необходимость эндотрахеальной интубации для удаления секрета или защиты дыхательных путей |
|
Неспособность больного из-за тяжести состояния или нарушения сознания выполнять указания медперсонала, связанные с проводимой ИВЛ |
Нестабильность гемодинамики |
|
Выраженное ожирение (более 200% идеальной массы тела) |
Появление признаков ишемии миокарда или клинически значимых желудочковых аритмий на ЭКГ |
|
Артериальная гипотензия (САД ниже 90 мм рт.ст.). Сочетание ОДН, требующей начала иВл, с нестабильной стенокардией или острым инфарктом миокарда, гемодинамически значимыми аритмиями |
Нарастание энцефалопатии у больного |
|
Неспособность больного убрать маску с лица при рвоте |
Остановка спонтанного дыхания |
|
Указания на желудочно-кишечное кровотечение |
— |
|
Обструкция верхних дыхательных путей |
— |
|
Недавно перенесенные операции в полости рта, на пищеводе или желудке |
— |
|
Переломы основания черепа |
— |
Таблица 4-. Осложнения, связанные с интубацией трахеи, и действия врача скорой помощи
| Возможное осложнение | Действия врача при выявлении осложнения |
|---|---|
|
Осложнения в процессе интубации трахеи |
|
|
Травма зубов, губ, языка, глотки, трахеи, шейного отдела позвоночника, носа или глаз |
Доставка в приемное отделение стационара для лечения специалистом соответствующего профиля |
|
Аспирация (крови, зубов или желудочного содержимого) |
Санация ТБД с помощью отсоса. Доставка в приемное отделение стационара для срочной фибробронхоскопии |
|
Непреднамеренная интубация пищевода (запоздалое распознавание) |
Срочная экстубация. Выполнение масочной ИВЛ 100% кислородом. После стабилизации состояния пациента возможна интубация новой трубкой с аускультативным контролем ее положения |
|
Однолегочная интубация |
Наиболее часто трубка смещается из трахеи в правый главный бронх. Показано удаление воздуха из манжеты ЭТТ, затем ее аккуратное подтягивание кнаружи при одновременном аускультативном контроле в левой подключичной области. В дальнейшем фиксируют ЭТТ в положении, когда дыхательные шумы одинаково проводятся в обе стороны грудной клетки |
|
Рефлекторные вегетативные реакции |
Симптоматическая терапия |
|
Осложнения, связанные с введением ЭТТ |
|
|
Бронхоспазм |
Углубление анестезии! Возможно введение глюкокортикоидов и препаратов с бронхорасширяющим эффектом |
|
Перфорация или разрыв трахеи |
Срочная госпитализация в стационар с дальнейшим переводом в отделение торакальной хирургии |
|
Неадекватная санация ТБД |
Проверка исправности отсоса. Перкуссионный массаж грудной клетки в сочетании с санацией дыхательных путей. После госпитализации — выполнение срочной лечебно-санационной бронхоскопии |
|
Обтурация перераздутой манжетой ЭТТ просвета трахеи |
Уменьшение объема воздуха в манжете ЭТТ |
|
Повреждение манжеты ЭТТ |
Замена ЭТТ. Допустима тугая тампонада ротоглотки смоченным в физиологическом растворе марлевым бинтом |
|
Осложнения в ходе экстубации трахеи |
|
|
Травма гортани или глотки раздутой манжетой |
Срочный осмотр оториноларингологом |
|
Аспирация надманжеточного содержимого |
Одна из причин развития пневмонии, связанной с ИВЛ. Осложнение редко своевременно распознают. При выявлении аспирации — срочная санация ТБД, лечебно-санационная бронхоскопия. В процессе сброса давления в манжете ЭТТ и ее извлечения необходима непрерывная санация ТБД катетером, заведенным через интубационную трубку в трахею |
|
Ларингоспазм |
Стандартное лечение (устранение причины). Готовность к срочной интубации и госпитализации |
|
Отек дыхательных путей |
Стандартное лечение. Готовность к срочной интубации и госпитализации |
|
Осложнения после экстубации |
|
|
Боль в горле, дисфагия |
Как правило, осложнение быстропроходящее и специальной терапии не требует. При сохранении явлений более суток — осмотр оториноларингологом |
|
Афония |
Как правило, осложнение быстропроходящее и специальной терапии не требует. При сохранении явлений афонии более 2-3 ч — осмотр оториноларингологом (состояние голосовых связок) |
|
Паралич подъязычного или язычного нерва |
Осмотр оториноларингологом и неврологом |
|
Отек, воспаление и изъявление дыхательных путей |
Осмотр оториноларингологом, диагностическая бронхоскопия (по показаниям), осмотр торакальным хирургом |
-
исправного аппарата ИВЛ, подключенного к источнику кислорода с достаточным запасом газа [16];
-
отсоса-аспиратора с комплектом одноразовых санационных катетеров;
-
ручного дыхательного мешка с маской;
-
исправного ларингоскопа с набором клинков;
-
ЭТТ соответствующего пациенту размера;
-
шприца на 10 мл (для раздувания манжеты на ЭТТ после интубации);
-
приспособления для фиксации ЭТТ после интубации трахеи (полоски лейкопластыря, марлевой тесемки, фиксатора Томаса и т.д.);
-
проводника для ЭТТ в случае сложной интубации;
-
ротового и/или носового воздуховода.
Ингаляцию кислорода, проводимую непосредственно перед интубацией трахеи («преоксигенация»), осуществляют при потоке газа 5-6 л/мин в течение 2-3 мин. Она позволяет избежать быстрого развития гипоксемии во время ларингоскопии. При неэффективном самостоятельном дыхании предварительную гипервентиляцию проводят через лицевую маску с помощью ручного дыхательного мешка (оптимально — с подключением его к источнику кислорода) или аппаратом ИВЛ, используя принудительный режим со 100% содержанием кислорода в дыхательной смеси.
Непосредственно перед интубацией трахеи внутривенно вводят атропин, седативные препараты, миорелаксанты (премедикация). Отказ от премедикации допустим у пациентов с остановкой сердечной деятельности или явлениями апноэ, а также при наличии противопоказаний к назначению препаратов из вышеперечисленных групп.
Искусственная вентиляция легких при коме, обусловленной тяжелой травмой головного мозга
Основания для перевода на ИВЛ пациента с тяжелой ЧМТ
-
Необходимость коррекции гиповентиляции или апноэ, вызванных прямым повреждением головного мозга или формированием отека вещества мозга, гематомы.
-
Необходимость восстановления проходимости дыхательных путей у пациентов в коме. После интубации показана санация ТБД с помощью отсоса-аспиратора.
-
Купирование центральной гипервентиляции, резко повышающей потребление кислорода при интенсивной работе дыхательной мускулатуры.
Главная задача ИВЛ — борьба с гипоксемией, оказывающей выраженное негативное воздействие на поврежденную мозговую ткань (целевое значение SaO2 ≥92%), а также достижение умеренной гипокапнии (30-35 мм рт.ст.) — способствует сокращению сосудов головного мозга и уменьшению его отека.
В настоящее время на некоторых станциях СМП используют высококлассные аппараты ИВЛ, обладающие достаточно большими функциональными возможностями. Они позволяют врачу осуществлять эффективный контроль проводимой ИВЛ и выбирать оптимальные параметры респираторной поддержки. При выполнении ИВЛ у пациентов с ЧМТ по возможности не допускают высокого среднего давления в дыхательных путях (pmean), так как это ухудшает венозный отток от головного мозга. В таких случаях рекомендуют применять положительное давление в конце выдоха (ПДКВ) не выше 6 см вод. ст., использовать дыхательный объем, не превышающий 8-9 мл/кг массы тела [17], а отношение вдоха к выдоху необходимо сохранять на уровне 1:2-1:2,5.
При изолированной травме головного мозга легкие остаются относительно интактными. В подобной ситуации следует использовать принудительный режим ИВЛ с контролем по объему — VC-CMV (классификация режимов ИВЛ здесь и в дальнейшем — по R.L. Chatburn), обеспечивающий надежную оксигенацию и наиболее эффективное удаление углекислого газа из крови. Метод доставки дыхательной смеси в легкие — инвазивная ИВЛ.
Первоначальные установки параметров ИВЛ
-
Дыхательный объем (VT) = 8-9 мл/кг (обычно 600-700 мл).
-
f = 12-14 в минуту.
-
ПДКВ = 3-5 см вод. ст.
-
FiO2 = 0,3-0,6.
-
Триггер (по давлению) = 3-4 см вод. ст.
-
Форма потока дыхательной смеси во время вдоха — нисходящая.
-
Пауза вдоха = 0,1-0,3 с.
-
Скорость пикового потока = 35-40 л/мин.
-
Продолжительность вдоха (Ti): продолжительность выдоха (Te) = 1:2.
-
У пострадавших с затрудненным выдохом скорость потока можно увеличить до 70-90 л/мин, а отношение Ti: Te — уменьшить до 1:3-1:4.
Во время проведения ИВЛ у пациентов с тяжелой ЧМТ рекомендовано возвышенное положение головы и плечевого пояса (для улучшения оттока венозной крови от головного мозга).
Искусственная вентиляция легких при тяжелой травме грудной клетки
Основания для перевода на ИВЛ пациента с тяжелой травмой грудной клетки
-
Механическая асфиксия (повреждения трахеи и крупных бронхов).
-
Нарушение «каркасности» грудной клетки при множественном переломе ребер.
-
Тяжелый ушиб ткани легких.
Перед началом ИВЛ у пациента с травмой грудной клетки необходимо убедиться в отсутствии клинических признаков напряженного пневмоторакса!
При получении данных в пользу напряженного пневмоторакса перед переводом на ИВЛ показано экстренное дренирование грудной клетки на стороне поражения. При выраженном болевом синдроме необходимо введение обезболивающих препаратов.
Предпочтительный режим ИВЛ — VC-CMV. При высоком пиковом давлении в дыхательных путях (больше 26-28 см вод. ст.) возможен переход на ИВЛ с контролем по давлению [PCV — режим принудительной ИВЛ с контролем давления (от pressure control ventilation); PC-SIMV — режим синхронизированной перемежающейся принудительной вентиляции с контролем давления (от pressure controlled continuous mandatory ventilation)]. Рекомендованный метод доставки дыхательной смеси в легкие при тяжелой механической травме грудной клетки — инвазивная ИВЛ.
Первоначальные установки параметров ИВЛ
-
Дыхательный объем (VT) = 8-10 мл/кг.
-
f = 12-14 в минуту.
-
ПДКВ = 4-5 см вод. ст.
-
FiO2 = 0,3-0,7.
*Триггер (по давлению) = 3-4 см вод. ст.
-
Форма потока дыхательной смеси во время вдоха — нисходящая.
-
Пауза вдоха = 0,1-0,3 с.
-
Скорость пикового потока = 50-60 л/мин.
-
Ti: Te = 1:2, при затрудненном выдохе — 1:2,51:3.
После интубации трахеи и начала ИВЛ необходимо выполнить санацию ТБД, так как у пациентов данной группы высока вероятность скопления в дыхательных путях мокроты и крови.
Искусственная вентиляция легких при гиповолемическом и геморрагическом шоке
Цель проведения ИВЛ в данном случае — борьба с выраженной гипоксией. Особое внимание следует уделить контролю гемодинамики, так как в ходе вентиляции может резко снизиться АД до критических значений. Это обусловлено уменьшением венозного возврата к сердцу из-за высокого внутригрудного давления во время аппаратного вдоха. Выраженность данного негативного явления усиливается по мере нарастания гиповолемии.
Современные транспортные дыхательные аппараты, обладающие режимами перемежающейся вентиляции, делают проведение ИВЛ у данной категории пациентов значительно менее рискованной. Спонтанные вдохи обладают менее выраженным негативным влиянием на общую гемодинамику, чем принудительные.
У пациентов с гиповолемическим и геморрагическим шоком наиболее приемлемым режимом становится BiLevel (режим ИВЛ с двумя уровнями поддержки), проводимый с помощью лицевой маски (нИВЛ). В настоящее время этот режим ИВЛ поддерживают только транспортные аппараты высокого класса.
Первоначальные установки параметров ИВЛ в режиме BiLevel
-
Phigh (максимальный уровень давления в дыхательных путях) = 12-15 см вод.ст.
-
Plow (минимальный уровень давления в дыхательных путях) = 2-3 см вод.ст.
-
f = 12-14 в минуту.
-
FiO2 = 0,4-0,5 или выше (целевое значение SpO2 ≥90%).
-
Триггер (по давлению) = 3-4 см вод.ст.
-
Триггер (по потоку) = 1,5-2 л/мин.
Искусственная вентиляция легких при тяжелом обострении хронической обструктивной болезни легких
Под обострением ХОБЛ понимают относительно длительное (более 24 ч) ухудшение состояния больного, по своей тяжести выходящее за пределы привычной для пациента суточной вариабельности симптомов. Обострение ХОБЛ характеризуется относительно острым началом и необходимостью в изменении ранее подобранной для пациента схемы терапии.
Обострение инфекционного процесса в бронхиальном дереве — ведущая причина ОДН у больных с ХОБЛ. Однако примерно в половине всех случаев причинами ОДН могут быть и неинфекционные факторы: застойные явления в малом круге кровообращения, ТЭЛА, бронхоспазм, пневмоторакс, ятрогенные причины (нерациональная оксигенотерапия, назначение седативных препаратов).
Гипоксемия представляет реальную угрозу для жизни больного, поэтому оксигенотерапия служит приоритетным направлением в лечении ОДН на фоне ХОБЛ. Цель оксигенотерапии — достижение у больного с обострением ХОБЛ уровня SpO2 превышающего 90-92%. Однако ингаляции кислорода у данной категории пациентов нередко приводит к нарастанию гиперкапнии (кислород-индуцированная гиперкапния). Причины гиперкапнии разнообразны, в значительной степени они связаны с патофизиологическими особенностями регуляции дыхания при ХОБЛ. Риск развития указанного осложнения тем выше, чем тяжелее была гипоксемия перед началом ингаляции кислорода.
При развитии кислород-индуцированной гиперкапнии грубой ошибкой считают прекращение кислородотерапии. В подобных ситуациях следует продолжить ингаляцию кислорода, но с объемной скоростью, не превышающей 1-2 л/мин; необходимо улучшить механику дыхания (бронходилататоры, мобилизация и удаление мокроты), использовать более активные варианты респираторной поддержки (нИВЛ).
При наличии показаний к проведению ИВЛ у пациентов с обострением ХОБЛ следует использовать неинвазивную методику. Обычно больной находится в сознании и не нуждается в применении седативных и тем более миорелаксирующих препаратов. Масочная вентиляция для пациента субъективно более комфортная процедура, чем инвазивная ИВЛ. Еще одно важное достоинство нИВЛ — возможность быстрого прекращения вентиляции при улучшении состояния пациента, а также немедленное ее возобновление, если это необходимо.
При решении вопроса о переводе пациента на нИВЛ в первую очередь ориентируются на тяжесть состояния. Показаниями к началу нИВЛ при обострении ХОБЛ можно считать частоту дыхания более 24 в минуту, участие вспомогательной дыхательной мускулатуры, появление парадоксального дыхания.
При осуществлении нИВЛ основной целью становится купирование выраженной гипоксемии, снижение работы дыхания (уменьшение нагрузки на дыхательные мышцы), улучшение условий для газообмена в легких.
Наиболее подходящими режимами нИВЛ для пациентов с обострением ХОБЛ служит CPAP (constant positive airway pressure — постоянное положительное давление в воздушных путях) и BiPAP — режимы вентиляции с положительным давлением в дыхательных путях.
Примерные начальные параметры нИВЛ.
-
При использовании CPAP.
-
Уровень CPAP = 12-14 см вод. ст.
-
FiO2 — достаточное для поддержания SpO2 выше 90%.
-
-
При использовании BiPAP.
-
Phigh (максимальный уровень давления в дыхательных путях) = 14-16 см вод. ст.
-
Plow (минимальный уровень давления в дыхательных путях) = 4-6 см вод. ст.
-
FiO2 — достаточное для поддержания SpO2 выше 90%.
-
Инвазивную ИВЛ лучше начинать с режимов VC-SIMV (синхронизированная перемежающаяся вентиляция легких с контролем по объему) или VC-CMV.
Параметры ИВЛ в режиме VC-SIMV
-
Дыхательный объем (VT) = 8-10 мл/кг.
-
f = 10-12 в минуту;
-
Тi;Te = 1:2,5-1:3,5.
-
ПДКВ = 4-5 см вод. ст.
-
FiO2 — достаточное для поддержания SpO2 ≥90%.
-
Триггер вдоха (по давлению) = 2-3 см вод. ст.
-
Пиковый инспираторный поток = 50-70 л/мин.
-
Максимальное давление в дыхательных путях — до 45 см вод.ст.
По мере улучшения состояния больного респираторную поддержку постепенно снижают (например, в режиме SIMV — за счет уменьшения принудительных вдохов).
Искусственная вентиляция легких при заболеваниях и травмах сердца
Ожидаемые позитивные эффекты от проведения ИВЛ у пациентов с ОДН на фоне сердечной недостаточности:
-
ликвидация или уменьшение гипоксии (уменьшение работы дыхательной мускулатуры);
-
уменьшение венозного возврата при принудительном вдохе (снижение преднагрузки на пораженный миокард без существенного уменьшения АД);
-
снижение постнагрузки на левый желудочек (во время принудительного вдоха легкие оказывают давление на левый желудочек и помогают выбросу крови).
Основное противопоказание к ИВЛ при острой патологии сердца — инфаркт ПЖ.
Показанием к переводу на ИВЛ (особенно в варианте нИВЛ) следует считать кардиогенный отек легких. Наиболее предпочтительно использовать режим CPAP, не уступающий по эффективности по эффективности режиму BiLevel.
Первоначальные параметры ИВЛ в режиме CPAP:
-
paw (давление в дыхательных путях) = 8-10 см вод. ст.;
-
FiO2 = 0,5-0,7.
При неэффективности нИВЛ в режиме CPAP показан переход на инвазивную ИВЛ в режимах VC-CMV или А/С.
Примерные установки аппарата ИВЛ в режиме А/С
-
Дыхательный объем (VT) = 8-9 л/мин.
-
f = 12-14 в минуту.
-
ПДКВ = 5-8 см вод. ст.
-
Триггер (по давлению) = 3-4 см вод.ст.
-
Форма потока — нисходящая.
-
Пауза вдоха = 0,1-0,3 с.
-
Скорость пикового потока = 35-40 л/мин.
-
Ti: Te = 1:2 (при затруднении выдоха скорость увеличивают до 70-90 л/мин, а Ti: Te — 1:3 или 1:4).
-
FiO2 — увеличивать концентрацию кислорода в дыхательной смеси до достижения уровня SpO2 ≥95% (обычно достаточно FiO2 = 0,5-0,7).
Контроль состояния пациента во время искусственной вентиляции легких на догоспитальном этапе
Пациенты, находящиеся на ИВЛ, требуют к себе постоянного пристального внимания членов бригады скорой помощи. Основанием для этого становятся риск отказа аппарата ИВЛ, разъединения элементов дыхательного контура, дислокации ЭТТ, случаи само-экстубации неадекватными больными, возникновения необходимости в срочной санации ТБД и т.д.
Недопустимо даже на непродолжительный отрезок времени оставлять пациента на ИВЛ без наблюдения медицинским работником!
Контроль состояния больного включает внешний осмотр, аускультацию и перкуссию грудной клетки, а также инструментальные методы исследования.
Внешний осмотр пациента позволяет оценить уровень сознания, степень двигательной активности, цвет и влажность кожного покрова, выраженность экскурсии грудной клетки, наличие и эффективность попыток спонтанного дыхания.
Цвет и влажность кожного покрова дает ориентировочное представление об адекватности режима и параметров ИВЛ. Появление или прогрессирование цианоза, гипергидроза требует незамедлительной аускультации грудной клетки (исключение дислокации ЭТТ, развития пневмоторакса), контроля герметичности дыхательного контура, проверки проходимости дыхательных путей (накопление мокроты), а также оценки необходимости в коррекции параметров респираторной поддержки.
При осмотре грудной клетки оценивают достаточность и равномерность дыхательных экскурсий. При корректном проведении ИВЛ грудная клетка заметно расширяется в момент вдоха и спадается при выдохе. При отставании или отсутствии движений в правой или левой половине грудной клетки в первую очередь следует исключить дислокацию ЭТТ. Другой, более редкой причиной данного феномена может быть пневмоторакс или обтурация одного из главных бронхов ИТ (или мокротой). Осмотр в этих случаях следует дополнить аускультацией и перкуссией.
При однолегочной ИВЛ, обусловленной дислокацией ЭТТ, необходимо раздуть манжету и подтянуть трубку кнаружи на 2-3 см. После выравнивания дыхания (при аускультации в правой и левой подключичных областях) следует вновь раздуть манжету, а ЭТТ — надежно зафиксировать.
Инструментальный контроль в доступном объеме (SpO2, petCO2, мониторирование ЭКГ, частоты пульса, АД) в процессе ИВЛ должен осуществляться у всех пациентов.
Во время ИВЛ персонал скорой помощи обязан контролировать исправность аппарата ИВЛ, оценивать запас кислорода в баллоне. При появлении очевидных признаков неисправности аппарата пациента следует незамедлительно перевести на ИВЛ ручным дыхательным мешком. Экономии кислорода в процессе ИВЛ способствует снижение концентрации газа в дыхательной смеси. Вентиляция 100% кислородом рекомендовано всем пациентам в начальном периоде ИВЛ, однако затем, при положительной динамике клинических и инструментальных критериев тяжести ОДН, возможен постепенный переход на вентиляцию с более низким уровнем FiO2 (0,4-0,5).
При интубации трахеи для санации ТБД необходимо использовать стерильные перчатки и одноразовые санационные катетеры, что существенно снижает риск бактериальной контаминации нижних дыхательных путей пациента и развития так называемой вентилятор-ассоциированной пневмонии.
Использование врачом в ходе интубации трахеи и санации ТБД хирургических перчаток, защитных очков и хирургической маски позволяет снизить риск заражения от пациентов с ВИЧ-инфекцией, гепатитом, туберкулезом и другими инфекционными заболеваниями.
СПИСОК ЛИТЕРАТУРЫ
-
Гесс Д.Р., Качмарек Р.М. Искусственная вентиляция — М.; СПб.: БИНОМ; Диалект, 2009. — 432 с.
-
Горячев А.С., Савин И.А. Основы ИВЛ. — 3-е изд. — М.: МД, 2013. — 258 с.
-
Гриппи М.А. Патофизиология легких / Под общ. ред. Ю.Н. Наточина. — М.: БИНОМ, 2005. — 304 с.
-
Интенсивная терапия: Национальное руководство: В 2 т. / Под ред. Б.Р. Гельфанда, А.И. Салтанова. — М.: ГЭОТАР-Медиа. 2011. — Т. 1. — С. 406-540.
-
Кассиль В.Л., Выжигина М.А., Лескин Г.С. Искусственная вентиляция легких. — М: Медицина, 2004. — 480 с.
-
Кассиль В.Л., Рябова Н.М. Искусственная вентиляция легких в реаниматологии. — М.: Медицина, 1977. — 259 с.
-
Марино П.Л. Интенсивная терапия: Пер. с англ. / Под общ. ред. А.П. Зильбера. — М.: ГЭОТАР-Медиа, 2010. — С. 275-394.
-
Мэскел Н., Миллер Э. Руководство по респираторной медицине: Пер. с англ. / Под ред. С.Н. Авдеева. — М.: ГЭОТАР-Медиа, 2013. — 600 с.
-
Парсонз П., Хеффнер Д. Секреты пульмонологии: Пер. с англ. — М.: МЕДпресс-информ, 2004. — С. 479-550.
-
Пульмонология: национальное руководство / Под ред. А.Г. Чучалина. — М.: ГЭОТАР-Медиа, 2013. — С. 691-749.
-
Российская Федерация. Министерство здравоохранения и социального развития РФ. Об утверждении порядка оказания скорой, в том числе скорой специализированной, медицинской помощи. 20 июня 2013 г. Приказ МЗ РФ № 388н.
-
Российская Федерация. Министерство здравоохранения и социального развития РФ. Стандарт скорой медицинской помощи при острой респираторной недостаточности. 20 декабря 2012 г. Приказ МЗ РФ № 1080н.
-
Сатишур О.Е. Механическая вентиляция легких. — М.: Медлит, 2007 — 352 с.
-
Сумин С.А. Неотложные состояния. — 7-е изд. — М.: Медицинское информационное агентство, 2012. — 656 с.
-
Шанин Ю.Н., Костюченко А.Л. Реанимационная терапия острых дыхательных расстройста // Реаниматология. — Л., 1975. — С. 39-195.
-
Chatburn R.L., Volsko T.A., Hazy J. et al. Determining the basis for a taxonomy of mechanical ventilation // Respir. Care. — 2012. — Vol. 57, N 4. — P. 514-524.
-
Gray A.J., Goodacre S., Newby D.E., et al. A multi-centre randomised controlled trial of the use of continuous positive airway pressure and non-invasive positive pressure ventilation in the early treatment of patients presenting to the emergency department with severe acute cardiogenic pulmonary oedema // Health Technol. Assess. — 2009. — Vol. 13, N 33. — P. 1-106.
-
Medha M. What’s new in emergencies, trauma and shock? Mechanical ventilation in trauma patients: A tightrope walk // J. Emerg. Trauma Shock. — 2014. — Vol. 7, N 1. — P. 1-2.
-
Richter T., Ragaller M. Ventilation in chest trauma // J. Emerg. Trauma Shock. — 2011. — Vol. 4, N 2. — P. 251-259.
-
Schonhofer B., Kuhlen R., Neumann P. et al. Clinical practice guideline: non-Invasive mechanical ventilation as treatment of acute respiratory failure // Dtsch Arztebl. Int. — 2008. — Vol. 105, N 24. — P. 424-433.
-
Singh G., Pitoyo C.W. Non-invasive ventilation in acute respiratory failure // Acta Med. Indones. — 2014. — Vol. 46, N 1. — P. 74-80.
-
Tobin M.J., Laghi F., Jubran A. Ventilatory failure, ventilator support and ventilator weaning // Compr. Physiol. — 2012. — Vol. 2, N 4. — P. 2871-2921.
4.2. ПНЕВМОНИЯ
О.Н. Титова, Н.А. Кузубова, А.Г. Козырев
ОПРЕДЕЛЕНИЕ
Пневмонии — группа различных по этиологии, патогенезу, морфологической характеристике острых инфекционных (преимущественно бактериальных) заболеваний, характеризующихся очаговым поражением респираторных отделов легких с обязательным наличием внутриальвеолярной экссудации.
Большинство пневмоний носят характер внебольничных, т.е. возникают вне стационара. Внебольничная пневмония (ВнП) — острое инфекционное заболевание, сопровождающееся поражением нижних дыхательных путей (лихорадка, кашель, выделение мокроты, боль в грудной клетке, одышка) и рентгенологическими признаками «свежих» очагово-инфильтративных изменений в легких. Пневмонию считают внебольничной, если она развивается вне стационара или спустя 4 нед после выписки из него, в первые 48 ч от момента госпитализации, или у пациента, не находившегося в домах сестринского ухода/отделениях длительного медицинского наблюдения ≥14 сут.
Тяжелая ВнП — особая форма заболевания, характеризующаяся выраженной дыхательной недостаточностью и/или признаками тяжелого сепсиса. Тяжелую ВнП отличает плохой прогноз и необходимость проведения интенсивной терапии.
ЭПИДЕМИОЛОГИЯ
В соответствии с проспективными популяционными исследованиями, выполнявшимися в различных странах, ежегодная заболеваемость ВнП составляет 5-11 случаев на 1000 взрослого населения. Частота пневмоний в Российской Федерации в 2011 г. составляла 365,2 случаев на 100 000 взрослого населения, что несколько меньше показателя 2010 г. (413,1). В абсолютных величинах было зарегистрировано 425 924 и 480 320 больных соответственно. Вероятно, истинные показатели заболеваемости ВнП в нашей стране заметно выше из-за гиподиагностики заболевания.
Смертность от ВнП в последние три-четыре десятилетия, несмотря на развитие медицины, снижается незначительно. Стандартизованные коэффициенты смертности населения Российской Федерации от пневмонии (число умерших на 100 тыс. населения) в 2009, 2010 и 2011 гг. составляли 25,0, 24,1 и 23,8 соответственно.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
ВнП способны вызывать многие микроорганизмы, однако основное значение имеет лишь небольшой список возбудителей. Основной возбудитель ВнП — Streptococcus pneumoniae (20-40% случаев). На долю атипичных микроорганизмов (Mycoplasma pneumoniae, Chlamydia pneumoniae, реже — Legionella pneumophila) приходится 10-35% случаев заболевания, Haemophilus influenzae — 2-7%. Следует отметить, что, несмотря на сравнительно редкую встречаемость (в сумме — до 5% случаев), Staphylococcus aureus, Pseudomonas aeruginosa, грамотрицательные энтеробактерии, Legionella spp. опосредуют более тяжелое течение заболевания и, как следствие, значительную часть неблагоприятных исходов.
Согласно исследованию С.А. Рачиной и соавт. (Смоленск, 2011), наиболее распространена ВнП пневмококковой этиологии, особенно в отношении больных с тяжелой ВнП (41,2% случаев). У пациентов с нетяжелой ВнП в генезе заболевания преобладает микоплазменная инфекция (32,1% случаев). В указанных группах существенно различается вероятность легионеллезной инфекции: 11,8 и 1,8% случаев. В структуре возбудителей фатальных ВнП лидируют энтеробактерии.
О.В. Молчанова и соавт. (Хабаровск, 2008) отмечают более чем троекратное преобладание ВнП, обусловленной S. pneumoniae, над случаями, связанными с Klebsiella pneumoniae — 30,54 и 8,11%, соответственно (атипичные возбудители не анализировались). Однако в 2/3 случаев от общего числа летальных исходов выявляется K. pneumoniae. В подгруппах пациентов старше 60 лет с иммунодефицитными состояниями, СД вероятность грамотрицательной инфекции сопоставима или выше по сравнению с пневмококковой.
Мнение о пневмококке как об основном возбудителе ВнП связано с преобладанием исследований, анализирующих этиологию пневмонии у госпитализированных пациентов. Если же обратить внимание на амбулаторных пациентов, то в структуре возбудителей ВнП могут преобладать атипичные микроорганизмы (M. pneumoniae и C. pneumoniae). На сопоставимую частоту обнаружения типичных и атипичных возбудителей ВнП (11,1-18,5%) указывают исследования Т.Л. Савиновой и соавт. (2009 г.).
Атипичные возбудители могут быть и причиной тяжелой ВнП у госпитализированных больных. При обследовании группы таких пациентов S. pneumoniae и H. influenzae были выделены в 22 и в 18% случаев соответственно, на долю M. pneumoniae и L. pneumophila пришлось по 5% (M.E. Sayed Zaki, T. Goda, 2009).
Ряд авторов сообщают о сопоставимом прогнозе «классической» и атипичной ВнП у госпитализированных больных (G. Lui et al., 2009). Так, необходимость кислородотерапии возникала в 29,8 и в 29,1% случаев соответственно, перемещения в реанимационное отделение — в 2,7 и в 4,5%; длительность госпитализации составляла 7 и 6 сут, смертность — 6,0 и 2,2% случаев соответственно.
Нельзя не отметить, что суждение об этиологии ВнП зависит от диагностических возможностей микробиологической лаборатории и может заметно измениться при использовании современных методик. В исследовании, выполненном на основе принципа ПЦР, распространенность S. pneumoniae и H. influenzae как возбудителей ВнП составляла 86 и 41% случаев соответственно, хотя преимущественно в составе ассоциаций микроорганизмов (Бруснигина Н.Ф. и соавт., 2009). В целом эти и другие сведения соответствуют выводам, сделанным еще в 90-х годах прошлого века, о существенном значении пневмококка как возбудителя ВнП у всех категорий пациентов, преобладании атипичной этиологии ВнП преимущественно у больных молодого возраста, повышении частоты выявляемости H. influenzae, энтеробактерий у пожилых пациентов и в случае сопутствующих заболеваний.
Заметное влияние на этиологическую картину ВнП оказывает предшествующий прием антибактериальных препаратов. В одном из исследований было продемонстрировано (van de Garde E.M. et al., 2008), что прием β-лактамного антибиотика в течение 2 нед перед госпитализацией повышал вероятность выявления атипичных возбудителей ВнП и одновременно минимизировал пневмококковую этиологию.
Следует отметить, что даже на современном этапе в 30-40% случаев этиология ВнП остается неуточненной.
Связь между анамнезом заболевания (сопутствующие болезни, предшествующее антибактериальное лечение), тяжестью течения ВнП, возможностями терапии в амбулаторных или стационарных условиях и этиологическим агентом позволяет выделить несколько групп больных (табл. 4-4). Такое разделение лежит в основе принципа эмпирического антибактериального лечения ВнП.
Таблица 4-4. Группы больных с внебольничной пневмонией и вероятные возбудители заболевания
| Характеристика пациента | Место лечения | Вероятные возбудители |
|---|---|---|
|
ВнП нетяжелого течения у лиц без сопутствующих заболеваний, не принимавших в последние 3 мес антибактериальные препараты |
Амбулаторно-поликлинические условия (с медицинских позиций) |
S. pneumoniae. M. pneumoniae. C. pneumoniae |
|
ВнП нетяжелого течения у лиц с сопутствующими заболеваниями и/или принимавших в последние 3 мес антибактериальные препараты |
S. pneumoniae. H. influenzae. C. pneumonia. S. aureus. Семейство Enterobacteriaceae |
|
|
ВнП нетяжелого течения |
Стационар (отделение общего профиля) |
S. pneumoniae. H. influenzae. C. pneumonia. S. aureus. Семейство Enterobacteriaceae |
|
ВнП тяжелого течения |
Стационар (ОРИТ) |
S. pneumonia. Legionella spp. S. aureus. Семейство Enterobacteriaceae |
Главный путь инфицирования респираторных отделов легких и основной патогенетический механизм развития ВнП — аспирация содержимого ротоглотки. В нормальных условиях ряд микроорганизмов, например S. pneumoniae, могут колонизировать ротоглотку, но нижние отделы дыхательных путей при этом остаются стерильными. Микроаспирация секрета ротоглотки — физиологический феномен, наблюдающийся практически у половины здоровых лиц, преимущественно во время сна. Однако кашлевой рефлекс, мукоцилиарный клиренс, антибактериальная активность альвеолярных макрофагов и секреторных иммуноглобулинов обеспечивают элиминацию инфицированного секрета из нижних дыхательных путей и их стерильность. При повреждении механизмов «самоочищения» ТБД, например при вирусной респираторной инфекции, когда нарушается функция ресничек эпителия бронхов и снижается активность альвеолярных макрофагов, возникают благоприятные условия для развития ВнП. В одних случаях определяющим патогенетическим фактором может быть массивность дозы микроорганизмов, в других — проникновение в респираторные отделы легких единичных, но высоковирулентных бактерий.
Менее распространенный путь инфицирования — вдыхание аэрозоля, содержащего микроорганизмы. Он играет основную роль при поражении нижних отделов дыхательных путей облигатными возбудителями, например Legionella spp. Еще реже встречается гематогенное распространение микроорганизмов из внелегочного очага инфекции, а также их проникновение из соседних пораженных органов (например, при абсцессе печени или вследствие инфицирования при проникающих ранениях грудной клетки).
КЛАССИФИКАЦИЯ
Основные разновидности ВнП представлены в табл. 4-5.
Таблица 4-5. Внебольничная пневмония в международной классификации МКБ-10
| Код МКБ-10 | Нозологическая единица |
|---|---|
|
J12 |
Вирусная пневмония, не классифицированная в других рубриках |
|
J13 |
Пневмония, вызванная S. pneumoniae |
|
J14 |
Пневмония, вызванная H. influenzae |
|
J15 |
Бактериальная пневмония, не классифицированная в других рубриках |
|
J16 |
Пневмония, вызванная другими инфекционными возбудителями и не классифицированная в других рубриках |
|
J17 |
Пневмония при болезнях, классифицированных в других рубриках |
|
J18 |
Пневмония без уточнения возбудителя |
КЛИНИЧЕСКАЯ КАРТИНА
Наиболее распространенные симптомы ВнП — остро развившееся повышение температуры тела, кашель, выделение мокроты, одышка, тахикардия, боль в грудной клетке. При обследовании пациента определяют ряд локальных изменений, включая усиление бронхофонии и голосового дрожания, укорочение или притупление перкуторного звука, жесткое или бронхиальное дыхание, а также влажные мелкопузырчатые хрипы или крепитацию над областью поражения.
Все перечисленные признаки не относятся к постоянным и специфичным симптомам ВнП. Клиническая картина заболевания в ряде ситуаций может быть стертой, в частности при ВнП, вызванной атипичными возбудителями (M. pneumoniae, C. pneumoniae), у пожилых и ослабленных пациентов.
Советы позвонившему
До прибытия бригады скорой помощи необходимо следующее:
-
обеспечить больному постельный режим;
-
обеспечить постоянное наблюдение за пациентом;
-
дать обильное питье с целью дезинтоксикации;
-
больным без осложнений и сопутствующих заболеваний дать жаропонижающие препараты при лихорадке выше 39 °С, при наличии осложнений — начиная с температуры 38 °С и выше (парацетамол в максимальной разовой дозе 1 г).
ЛЕЧЕНИЕ
Скорая медицинская помощь на догоспитальном этапе
Основное внимание следует уделить сбору жалоб, анамнеза и данных физикального обследования. Наиболее распространенные жалобы пациента с ВнП:
-
высокая температура тела;
-
кашель;
-
выделение мокроты;
-
одышка;
-
боль в грудной клетке.
При сборе анамнеза необходимо уделить внимание факторам, влияющим на течение пневмонии:
-
возраст пациента;
-
переохлаждение;
-
перенесенная респираторная инфекция;
-
курение;
-
сопутствующие хронические заболевания;
-
прием антибиотиков за последние 6 мес.
При физикальном обследовании над областью поражения могут быть выявлены следующие признаки:
-
усиление бронхофонии и голосового дрожания;
-
укорочение или тупость перкуторного звука;
-
зона жесткого или бронхиального дыхания;
-
влажные мелкопузырчатые хрипы или крепитация.
Не следует забывать, что клиническая картина заболевания в ряде ситуаций может быть стертой (например, при ВнП, вызванной атипичными возбудителями; у пожилых, ослабленных пациентов).
Всем пациентам с ВнП необходимо выполнить пульсоксиметрию для выявления гипоксемии (SpO2 ≤92% у пациентов ≤50 лет и SpO2 ≤90% у пациентов >50 лет).
На основании результатов обследования проводят стратификацию риска неблагоприятного исхода ВнП и определяют место лечения.
Стратификация риска неблагоприятного исхода заболевания показана всем больным ВнП. На догоспитальном этапе для этого используют шкалу CRB-65 (рис. 4-1), анализирующую нарушение сознания, частоту дыхания, АД и возраст пациента (confusion, respiratory rate, blood pressure, age >65).
-
Амбулаторное лечение ВнП показано больным с CRB-65 = 0 баллов, за исключением категорий (с CRB-65 = 0 баллов), указанных в следующем пункте.
-
Лечение в ОСМПС.
-
Больные ВнП с CRB-65 ≥1 балл;
-
Больные ВнП с CRB-65 = 0 баллов и следующими дополнительными характеристиками:
-
частота дыхания >20 и ЧСС >90 в минуту;
-
частота дыхания >20 в минуту и температура тела <36 °С или >38 °С;
-
неэффективность стартовой амбулаторной антибактериальной терапии;
-
сопутствующие заболевания (ХОБЛ, бронхоэктатическая болезнь, злокачественные новообразования, СД, хроническая почечная недостаточность, хронический алкоголизм, наркомания, выраженный дефицит массы тела, цереброваскулярные заболевания);
-
беременность;
-
невозможность адекватного ухода и выполнения всех врачебных предписаний в домашних условиях.
-
-
-
Лечение в ОРИТ, минуя ОСМПС (пациенты с угрожающим жизни течением ВнП):
-
больные ВнП с CRB-65 = 3-4 балла;
-
больные ВнП, осложненной септическим шоком и/или ОДН.
Л
ечебные мероприятия на догоспитальном этапе
-
-
При гипоксемии (SpO2 ≤92% у пациентов до 50 лет и SpO2≤90% у пациентов старше 50 лет) — ингаляция увлажненного кислорода через носовой катетер со скоростью 4-6 л/мин.
-
Жаропонижающие препараты при лихорадке выше 39 °С у больных без осложнений и сопутствующих заболеваний, а при наличии последних — начиная с температуры 38 °С и выше (парацетамол в максимальной разовой дозе 1 г, максимальная суточная доза — 4 г).
-
Ненаркотические анальгетики для обезболивания при плевральной боли — кеторолак внутривенно медленно (не менее чем за 15 с) 30 мг. При внутримышечном введении аналгетический эффект развивается через 30 мин. Препарат также обладает жаропонижающим эффектом. Не следует сочетать кеторолак с парацетамолом из-за повышения нефротоксичности. Вместо кеторолака можно использовать лорноксикам внутрь по 8 мг, запивая стаканом воды (обладает аналгетическим и жаропонижающим эффектом).
-
При бронхообструктивном синдроме — бронходилататоры (сальбутамол ингаляционно 100-200 мкг аэрозоля или 2,5-5 мг через небулайзер). При выраженной бронхообструкции необходимо вводить ГКК.
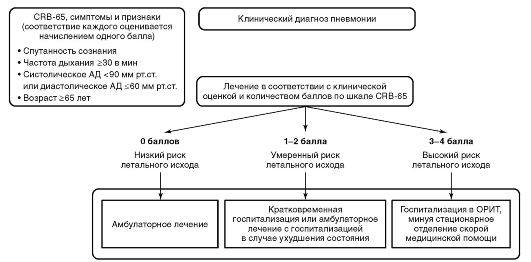
Рис.4-1. Алгоритм оценки результатов заполнения шкалы CRB-65
-
Дезинтоксикационная терапия — 0,9% раствор натрия хлорида, 5% раствор декстрозы (глюкозы♠), калия хлоридкальция хлорид+магния хлорид+натрия гидрокарбонатнатрия хлорид +повидон-8 тыс. (гемодез-Н♠). Объем однократного введения 200-400 мл.
-
При артериальной гипотензии (АД <90/60 мм рт.ст.) — восполнить потерю жидкости, учитывая, что при повышении температуры тела на 1 °С количество жидкости в организме уменьшается на 500 мл/сут (0,9% раствор натрия хлорида — 400 мл внутривенно, 5% раствор декстрозы — 400 мл внутривенно; быстрая инфузия).
-
При сохраняющейся артериальной гипотензии после восполнения объема — вазопрессорные амины до достижения систолического АД 90 мм рт.ст. (допамин внутривенно капельно со скоростью 4-10 мкг/кг в минуту, но не более 15-20 мкг/кг в минуту). Для этого следует развести 200 мг допамина в 400 мл 0,9% раствора натрия хлорида или 5% раствора декстрозы и вводить по 2-11 капель в минуту. Инфузию нельзя прекращать резко — необходимо постепенное снижение скорости введения. Противопоказания к введению допамина: феохромоцитома, ФЖ.
-
Следует всегда быть готовым к проведению ИВЛ и реанимационных мероприятий.
Скорая медицинская помощь на стационарном этапе
Минимальный объем обследования при поступлении пациента в ОСМПС, позволяющий подтвердить диагноз ВнП, а также определить степень тяжести и место лечения пациента, включает следующее.
-
Клинический анализ крови.
-
Биохимический анализ крови (глюкоза, мочевина, электролиты, печеночные ферменты).
-
Рентгенография органов грудной клетки в двух проекциях. При отсутствии возможности выполнения рентгенографии можно опираться на клинические признаки диагноза, однако это влечет за собой риск как гипо-, так и гипердиагностики ВнП.
-
Пульсоксиметрия. Больным с SpO2 ≤90%, а также с хроническими заболеваниями легких назначают исследование газового состава артериальной крови.
Выполнение КТ в рутинную практику обследования больных ВнП не входит. В ряде случаев КТ позволяет преодолеть недостаточную чувствительность рентгенографии в первые часы заболевания, когда в легочной ткани еще не сформирован достаточно контрастный инфильтрат.
Еще одним лучевым методом, зарекомендовавшим себя в последние годы в диагностике ВнП, служит УЗИ. Ценность его особенно высока при первичном обследовании пациентов с тяжелой ВнП.
После госпитализации больного ВнП в стационар проводят дальнейшую стратификацию риска неблагоприятного исхода. Это позволяет определить, нужна пациенту госпитализация в ОРИТ или нет.
В случае тяжелой ВнП шкала CRB-65 имеет высокую специфичность, но низкую чувствительность. Подавляющему большинству пациентов с CRB-65 ≥3 баллов действительно необходима интенсивная терапия, однако применение шкалы сопряжено с опасностью гиподиагностики тяжелой ВнП. Именно поэтому у госпитализируемых больных необходимость направления в ОРИТ уточняют с помощью шкалы IDSA/ATS, разработанной Американским обществом инфекционных болезней и Американским торакальным обществом в 2007 г. (табл. 4-5). Шкала IDSA/ATS позволяет с большой вероятностью выявить всех пациентов, кому показана госпитализация в ОРИТ. Низкий риск указывает на отсутствие необходимости наблюдения в ОРИТ (у части больных с высоким риском не исключается гипердиагностика тяжелой ВнП).
Таблица 4-5. Критерии тяжелой внебольничной пневмонии по шкале IDSA/ATS, 2007 г.
| Большие критерии | Малые критерии |
|---|---|
|
Инвазивная ИВЛ |
Частота дыхания >30 в мин |
|
PaO2/FiO2 < 250 мм рт.ст. |
|
|
Септический шок с необходимостью введения вазопрессоров |
Мультилобарная инфильтрация |
|
Спутанность сознания/дезориентация |
|
|
Мочевина сыворотки крови >7 ммоль/л |
|
|
Лейкоциты <4х109/л |
|
|
Тромбоциты <100х109/л |
|
|
Температура тела <36 °С |
|
|
Гипотензия, требующая введения большого объема растворов |
Выявление хотя бы одного большого или трех малых критериев IDSA/ATS указывает на необходимость направления пациента в ОРИТ.
Больным ВнП показано лечение в условиях ОСМПС, если в период кратковременной (24-72 ч) госпитализации еще уточняется необходимость перевода в отделение общего профиля или в ОРИТ, а также в случае нетяжелой ВнП с высокой степенью вероятности стабилизации состояния. Остальных пациентов, которым показана госпитализация, но нет оснований для лечения в условиях ОРИТ или ОСМПС, направляют в отделения общего профиля.
Всем больным с ВнП, госпитализируемым в ОСМПС, назначают микробиологическое исследование.
-
Микроскопия мазка мокроты, окрашенного по Граму, и бактериологическое исследование мокроты (или, при доступности, другого респираторного материала, полученного инвазивным методом) для выделения возбудителя и определения его чувствительности к антибиотикам.
-
Бактериологическое исследование крови. Для этого берут 2 образца венозной крови из двух разных вен до начала антибактериальной терапии.
Перед интерпретацией результатов анализа мазка мокроты, окрашенного по Граму, следует оценить качество исследуемого материала. При наличии менее 25 полиморфноядерных лейкоцитов и более 10 эпителиальных клеток (при просмотре не менее 10 полей зрения при увеличении в 100 раз) культуральное исследование образца нецелесообразно, так как в этом случае изучаемый материал, скорее всего, значительно контаминирован содержимым ротовой полости. Выявление в мазке большого количества грамположительных или грамотрицательных микроорганизмов с типичнойpморфологией (ланцетовидных грамположительных диплококков — S. pneumoniae; слабо окрашенных грамотрицательных бактерий — H. influenzae) служит ориентиром для выбора антибактериальной терапии. Исследование мокроты на кислотоустойчивые бактерии выполняют в случае отсутствия ответа на лечение.
Микробиологическое исследование может дополниться рядом других тестов.
-
Иммунохроматографическое определение антигена S. pneumoniae в моче. Иммунохромато-графический тест способен подтвердить пневмококковую этиологию ВнП. Вместе с тем положительный результат теста может быть получен в случаях недавно перенесенной пневмококковой инфекции или микробной колонизации у больного с ХОБЛ. Анализ включения в рутинную диагностику ВнП иммунохроматографического определения антигена S. pneumoniae в моче не подтвердил улучшения результатов лечения, поэтому указанный метод на данном этапе считается факультативным.
-
Иммунохроматографическое определение антигена L. pneumophila в моче. Учитывая существенную вероятность неблагоприятного прогноза легионеллезной ВнП, определение антигена L. pneumophila в моче желательно в случае тяжелого течения заболевания. Положительный результат теста становится высокоспецифичным для указанной этиологии ВнП; отрицательный результат, однако, полностью легионеллезную инфекцию не исключает.
-
Исследование биомаркеров. Определение уровня таких биомаркеров, как прокальцитонин и С-реактивный белок, применяют для уточнения бактериального генеза заболевания, комплексной оценки тяжести ВнП и длительности антибиотикотерапии. Следует отметить, что убедительных доказательств улучшения прогноза заболевания при включении такой диагностики пока не получено.
При наличии плеврального выпота показана плевральная пункция с последующим цитологическим, биохимическим и микробиологическим исследованием плевральной жидкости.
Диагноз ВнП считают доказанным при наличии у больного рентгенологически подтвержденной очаговой инфильтрации легочной ткани и, по крайней мере, двух клинических признаков из числа следующих:
-
острая лихорадка в начале заболевания (температура тела >38 °С);
-
кашель с мокротой;
-
физикальные признаки инфильтрации легочной ткани (крепитации и/или мелкопузырчатые хрипы, жесткое бронхиальное дыхание, укорочение перкуторного звука над областью поражения);
-
лейкоцитоз >10х109/л и/или палочкоядерный сдвиг >10%.
Диагноз ВнП (табл. 4-6) считают неточным/неопределенным при отсутствии рентгенологического подтверждения очаговой инфильтрации в легких (рентгенография или крупнокадровая флюорография органов грудной клетки). При этом диагноз заболевания основывается на учете данных эпидемиологического анамнеза, жалоб и соответствующих локальных симптомов.
Диагноз ВнП маловероятен, если у пациента с лихорадкой, жалобами на кашель, одышку, отделение мокроты и/или боли в грудной клетке отсутствуют локальная симптоматика и данные рентгенологического исследования.
Дифференциальную диагностику ВнП проводят с инфекциями верхних дыхательных путей, туберкулезом легких, новообразованиями, ТЭЛА и инфарктом легкого, застойной сердечной недостаточностью, интерстициальными заболеваниями легких, аспирацией ИТ, поддиафрагмальным абсцессом.
Осложнения ВнП:
-
плевральный выпот;
-
эмпиема плевры;
-
деструкция/абсцедирование легочной ткани;
-
острый респираторный дистресс-синдром;
-
ОДН;
-
септический шок;
-
вторичная бактериемия, сепсис, гематогенные очаги инфекции;
-
перикардит, миокардит;
-
нефрит.
Антибактериальная терапия
В основе лечения ВнП лежит эмпирическая антибактериальная терапия, предусматривающая выбор антибиотика в зависимости от предполагаемого возбудителя заболевания у конкретного пациента. Необходимо также учитывать данные о резистентности микроорганизмов в эпидемиологическом регионе, комплайенс пациента, потенциальные побочные эффекты, стоимость лечения, сведения о недавно назначавшихся больному антибактериальных препаратах.
Таблица 4-6. Критерии диагностики внебольничной пневмонии
| Критерии диагноза | Рентгенографические признаки | Физикальные признаки | Острое начало, температура тела >38 °С | Кашель с мокротой | Лейкоцитоз >10х109/л и/или палочкоядерный сдвиг >10% |
|---|---|---|---|---|---|
|
Определенный |
+ |
Наличие любых двух критериев |
|||
|
Неточный или неопределенный |
— |
+ |
+ |
+ |
+/ — |
|
Маловероятный |
— |
— |
+ |
+ |
+/ — |
Никакие диагностические исследования не должны быть причиной задержки начала антибактериальной терапии. Больному ВнП необходимо назначить антибиотик как можно раньше в рекомендованных дозах — для предупреждения появления резистентных микроорганизмов.
Рекомендованным режимом антибиотикотерапии для больных ВнП, госпитализированных в ОСМПС, служит комбинация β-лактамных препаратов (предпочтительны амоксициллин+клавулановая кислота, цефтриаксон, цефотаксим) и макролидов. При непереносимости β-лактамов может быть использован респираторный фторхинолон (левофлоксацин, моксифлоксацин). Условие такого подхода — отсутствие на этапе госпитализации указаний на возможность туберкулезной инфекции. Всем пациентам, получающим респираторный фторхинолон вместо β-лактама, следует назначить анализ мокроты на кислотоустойчивые бактерии. Рекомендуемые дозы и названия антимикробных и противовирусных препаратов приведены в табл. 4-7-4-8. Антимикробную терапию корректируют по мере выявления возбудителя заболевания.
При диагностировании гриппа или вирусной пневмонии назначают противовирусные средства (табл. 4-9).
Если на догоспитальном этапе или сразу же после первичного обследования в ОСМПС принимается решение о ведении больного ВнП в амбулаторных условиях, то антибактериальная терапия должна быть направлена на подавление наиболее частого возбудителя — S. pneumoniae. Для пациентов без сопутствующих заболеваний препаратами выбора становятся пероральный β-лактам (амоксициллин) или макролид (уровень доказательности D), различий в эффективности которых не выявлено (уровень доказательности А). Пациентам с сопутствующими заболеваниями и/или принимавшим в последние 3 мес антибактериальные препараты следует назначить пероральный β-лактам с ингибитором β-лактамаз (амоксициллин+клавулановая кислота) в сочетании с макролидом. Назначение тетрациклинов недостаточно обосновано в связи с частой резистентностью S. pneumoniae к указанному антибиотику. Не следует использовать в качестве рутинного эмпирического лечения респираторные фторхинолоны; данные препараты могут быть альтернативой комбинации β-лактама и макролида при непереносимости одного из компонентов.
Амбулаторным пациентам антимикробные препараты назначают внутрь (уровень доказательности С). Парентеральные препараты назначают при предполагаемой низкой эффективности пероральных препаратов, отказе или невозможности своевременной госпитализации. Средняя продолжительность лечения составляет 5-7 сут.
Таблица 4-7. Режим дозирования антимикробных препаратов для эмпирической терапии внебольничной пневмонии в стационарном отделении скорой медицинской помощи
| Препараты | Внутрь | Парентерально | Примечание |
|---|---|---|---|
|
Аминопенициллины |
|||
|
Амоксициллин |
0,5-1 г x 3 раза в сутки |
— |
Независимо от приема пищи |
|
Ингибиторозащищенные пенициллины |
|||
|
Амоксициллин+клавулановая кислота |
0,625 г x 3 раза в сутки или 1-2 г 2 раза в сутки |
1,2 г 3-4 раза в сутки |
Во время еды |
|
Ампициллин+сульбактам |
— |
1,5 г x 3-4 раза в сутки |
— |
|
Амоксициллин+сульбактам |
1 г x 3 раза в сутки или 2 г 2 раза в сутки |
1,5 г x 3 раза в сутки |
Независимо от приема пищи |
|
Цефалоспорины III поколения |
|||
|
Цефотаксим |
— |
1-2 г x 2-3 раза в сутки |
— |
|
Цефтриаксон |
— |
1-2 г x 1 раз в сутки |
— |
|
Карбапенемы |
|||
|
Эртапенем |
— |
1 г x 1 раз в суткики |
— |
|
Макролиды |
|||
|
Азитромицин |
0,25 [18] -0,5 [19]г x 1 раз в сутки или 2 г однократно |
0,5 г x 1 раз в сутки |
За 1 ч до еды |
|
Кларитромицин |
0,5 г x 2 раза в сутки |
0,5 г x 2 раза в сутки |
Независимо от приема пищи |
|
Кларитромицин (кларитромицин СР*) |
1 г x 1 раз в сутки |
— |
Во время еды |
|
Джозамицин |
1 г x 2 раза в сутки или 0,5 г x 3 раза в сутки |
— |
Независимо от приема пищи |
|
Спирамицин |
3 млн МЕ x 2 раза в сутки |
1,5 млн МЕ x 3 раза в сутки |
Независимо от приема пищи |
|
Эритромицин |
Не рекомендуется |
0,5-1,0 г x 4 раза в сутки |
— |
|
Респираторные фторхинолоны |
|||
|
Левофлоксацин |
0,5 г x 1 раз в сутки |
0,5 г x 1 раз в сутки |
Независимо от приема пищи. |
|
Моксифлоксацин |
0,4 г x 1 раз в сутки |
0,4 г x 1 раз в сутки |
Одновременный прием препаратов магния, кальция, алюминия ухудшает всасывание |
|
Гемифлоксацин |
320 мг x 1 раз в сутки |
Таблица 4-8. Список торговых (патентованных) названий антибактериальных препаратов, применяющихся для лечения внебольнич-ной пневмонии (оригинальные препараты выделены жирным шрифтом)
| Международное непатентованное название | Торговое (патентованное) название |
|---|---|
|
Азитромицин |
Сумамед♠ , зетамакс ретард♠ , азитрокс♠ , зитролид форте♠ , хемомицин♠ |
|
Амоксициллин |
Флемоксин солютаб♠ , амосин♠ , хиконцил♠ |
|
Амоксициллин+клавулановая кислота |
Аугментин♠ , амоксиклав♠ , флемоклав солютаб♠ |
|
Ампициллин+сульбактам |
Уназин♠ , амписид♠ |
|
Гемифлоксацин |
Фактив♠ |
|
Джозамицин |
Вильпрафен солютаб♠ |
|
Кларитромицин |
Клацид♠ , клацид СР♠ , клабакс♠ , фромилид♠ , фромилид уно♠ |
|
Левофлоксацин |
Таваник♠ , флексид♠ , флорацид♠ |
|
Моксифлоксацин |
Авелокс♠ |
|
Спирамицин |
Ровамицин♠ |
|
Цефотаксим |
Клафоран♠ , цефабол♠ , цефантрал♠ |
|
Цефтриаксон |
Роцефин♠ , лендацин♠ , лонгацеф♠ |
|
Эртапенем |
Инванз♠ |
Таблица 4-9. Список торговых названий противовирусных препаратов, применяющихся для лечения гриппа и вирусной пневмонии, с режимом дозирования
| Международное непатентованное название | Торговое (патентованное) название | Режим дозирования |
|---|---|---|
|
Осельтамивир |
Тамифлю♠ |
75 мг 2 раза в сутки, продолжительность лечения — 5 сут |
|
Занамивир |
Реленза♠ |
10 мг 2 раза в сутки, продолжительность лечения — 5 сут |
|
Имидазолилэтанамид пентадиовой кислоты |
Ингавирин♠ |
90 мг 1 раз в сутки, продолжительность лечения — 7 сут |
|
Инозин пранобекс |
Изопринозин♠ , гроприносин♠ |
1000 мг 3 раза в сутки, продолжительность лечения — 7 сут |
В ходе госпитализации для оценки состояния пациента и эффективности терапии назначают следующие исследования:
-
повторный клинический анализ крови на второй день лечения;
-
повторный биохимический анализ крови при наличии изменений в исследовании или при клиническом ухудшении;
-
пульсоксиметрия ежедневно (исследование газового состава артериальной крови) до нормализации показателей;
-
повторная рентгенография органов грудной клетки при ухудшении состояния.
Критерии адекватности антибактериальной терапии ВнП:
-
температура тела <37,5 °С;
-
отсутствие интоксикации;
-
отсутствие дыхательной недостаточности (частота дыхания менее 20 в минуту);
-
отсутствие гнойной мокроты;
-
количество лейкоцитов в крови <10х109/л, нейтрофилов <80%, юных форм <6%;
-
отсутствие отрицательной динамики на рентгенограмме.
Для госпитализированных пациентов, при отсутствии заболеваний органов пищеварения, допустим прием внутрь антибактериального препарата, хотя предпочтительнее первоначальное парентеральное введение. Выбор между препаратами для приема внутрь и парентерального введения осуществляется с учетом состояния пациента, а также прогнозируемых лечащим врачом переносимости и эффективности выбранных антибиотиков.
По мере улучшения состояния и появления способности к пероральному питанию больных с нетяжелой ВнП можно перевести на прием лекарств внутрь (уровень доказательности В). Такая ступенчатая терапия существенно уменьшает длительность госпитализации, позволяя выписать пациента из стационара на амбулаторное лечение.
Неантибактериальное лечение внебольничной пневмонии
Неантибактериальное лечение ВнП назначается индивидуально и включает в себя дезинтоксикационные, жаропонижающие, обезболивающие, бронхолитические средства (наименования и дозы идентичны вышеуказанным препаратам).
Назначение оксигенотерапии и ГКК пациентам с нетяжелым течением ВнП не обосновано (ГКК показаны при развитии септического шока или острого респираторного дистресс-синдрома).
Лечение острого респираторного дистресс-синдрома, сепсиса, септического шока должно осуществляться в соответствии с общепринятыми рекомендациями для этих состояний.
нИВЛ показана больным ВнП с признаками ОДН:
-
частота дыхания более 25 в минуту;
-
участие в дыхании вспомогательной дыхательной мускулатуры;
-
гипоксемия с раО2 <60 мм рт.ст. или paO2/FIO2 <200 мм рт.ст.;
-
гиперкапния с paCO2 >45 мм рт.ст. и pH ≤7,35.
Противопоказания к нИВЛ — остановка дыхания, выраженная гипоксемия (paO2/FI02 <75 мм рт.ст.), артериальная гипотензия (САД <70 мм рт.ст.), неконтролируемые аритмии, обструкция верхних дыхательных путей, лицевая травма, невозможность обеспечить адекватный дренаж бронхиального дерева, неспособность пациента к сотрудничеству с медицинским персоналом.
Исходы лечения больных в стационарном отделении скорой медицинской помощи
В зависимости от результатов наблюдения в ОСМПС больные ВнП направляются (переводятся) на амбулаторное лечение, в отделения общего профиля или ОРИТ.
-
Амбулаторное лечение:
-
отсутствие сопутствующих заболеваний;
-
отчетливая положительная клинико-лабораторная динамика и стабильное состояние пациента в течение 24-48 ч;
-
возможность адекватного ухода и выполнения всех врачебных предписаний в домашних условиях.
-
-
Лечение в ОРИТ — при отрицательной клинической динамике с выявлением хотя бы одного большого или трех и более малых критериев IDSA/ATS.
-
Лечение в отделениях общего профиля — если по результатам динамического наблюдения в течение 24-48 ч пациенты не могут быть направлены на амбулаторное лечение и не нуждаются в переводе в ОРИТ.
-
Лечение в профильных специализированных учреждениях (отделениях) — при выявлении заболеваний, требующих специализированной медицинской помощи.
Наиболее часто встречающиеся ошибки при лечении больных ВнП
-
Ошибочный диагноз ВнП, гиперили гиподиагностика заболевания (особенно при отсутствии рентгенологического обследования).
-
Некорректная антибактериальная терапия (выбор препарата, суточной дозы, кратности назначения, способа введения), в том числе из-за отсутствия или неправильной оценки степени тяжести ВнП, возраста и сопутствующих заболеваний пациента, предшествующей антибактериальной терапии.
-
Упущение развивающихся осложнений ВнП и обострений сопутствующих заболеваний (плохо собранный анамнез, отсутствие динамического наблюдения).
ПРОГНОЗ
Прогноз ВнП зависит от тяжести течения заболевания. Смертность от ВнП, не превышающая в целом 1-2%, среди госпитализированных пациентов увеличивается до 10-12% случаев, а в ОРИТ достигает 30-50%.
СПИСОК ЛИТЕРАТУРЫ
-
Лещенко И.В., Бобылева З.Д., Трифанова Н.М. и др. Клинико-организационный алгоритм ведения больных с внебольничной пневмонией: Методические рекомендации. — Екатеринбург, 2012. — 71 с.
-
Руководство по скорой медицинской помощи / Под ред. С.Ф. Багненко, А.Л. Верткина, А.Г. Мирошниченко, М.Ш. Хубутия. — М.: ГЭОТАР-Медиа, 2007. — 816 с.
-
Чучалин А.Г., Синопальников А.И., Козлов Р.С. и др. Внебольничная пневмония у взрослых: практические рекомендации по диагностике, лечению и профилактике: Пособие для врачей. — М., 2010. — 106 с.
-
Gupta D., Agarwal R., Aggarwal A.N. et al. Guidelines for diagnosis and management of communityand hospital-acquired pneumonia in adults: Joint lCS/NCCP(I) recommendations // Lung India. — 2012. — Suppl. 2. — P. 27-62.
-
Levy M.L., Le Jeune I., Woodhead M.A. et al. Primary care summary of the British Thoracic Society Guidelines for the management of community acquired pneumonia in adults: 2009 update // Prim. Care Respir. J. -2010. -Vol. 19, N 1. — P. 21-7.
-
Mandell L.A., Wunderink R.G., Anzueto A. et al. Infectious diseases society of America. American Thoracic Society consensus guidelines on the management of community-acquired pneumonia in adults // Clin. Infect. Dis. — 2007. — Vol. 1, N 44. — Suppl. 2. -P. 27-72.
4.3. ОБОСТРЕНИЕ БРОНХИАЛЬНОЙ АСТМЫ (ОСТРАЯ ТЯЖЕЛАЯ АСТМА)
М.А. Петрова, О.Н. Титова
ОПРЕДЕЛЕНИЕ
Астматический статус (АС) — самое яркое и угрожающее жизни проявление бронхиальной астмы (БА). АС определяется как тяжелый, обычно затянувшийся (24 ч и более) приступ бронхиальной астмы, характеризующийся выраженной и быстро прогрессирующей дыхательной недостаточностью, которая обусловлена обструкцией дыхательных путей вследствие воспаления, диффузного отека слизистой оболочки бронхов и полного прекращения эвакуации мокроты при формировании резистентности больного к ранее проводимой бронхолитической терапии.
В настоящее время в литературе, особенно в зарубежной, эквивалентом термина «астматический статус» становится «тяжелое обострение бронхиальной астмы». Определения «тяжелое обострение бронхиальной астмы» и «АС» не противоречат друг другу, они оба включают понятие «угрожающая жизни астма» — состояние, сопряженное с угрозой остановки дыхания.
Различают два варианта развития тяжелого обострения БА:
-
вариант с медленным темпом развития;
-
вариант с внезапным началом, когда остановка дыхания может наступить через несколько часов от момента появления симптомов.
ЭПИДЕМИОЛОГИЯ
Тяжелые обострения возникают у 3-5% больных БА. Летальность при астматическом статусе составляет 1-10%. Согласно данным медицинского информационно-аналитический центра комитета по здравоохранению правительства Санкт-Петербурга, показатели смертности от БА, в том числе от АС, в 2009-2011 гг. снизились как среди лиц трудоспособного возраста, так и среди населения пожилого возраста. Так, число умерших от БА (на 100 тыс. населения) в Санкт-Петербурге в 2011 г. по отношению к 2009 г. уменьшилось на 37,5%, в РФ — на 21%, что свидетельствует о высокой эффективности современной терапии БА и в первую очередь ее обострений.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Основные причины развития АС:
-
неадекватное лечение БА;
-
контакт с аллергенами;
-
инфекции дыхательных путей;
-
воздействие поллютантов и других отрицательных внешних факторов;
-
нервно-психический стресс;
-
физическая нагрузка и гипервентиляция;
-
прием лекарственных препаратов — β-адреноблокаторов, ИАПФ, НПВС, антибиотиков и др.
В основе патогенеза АС и развития дыхательной недостаточности лежит стойкий бронхообструктивный синдром, обусловленный диффузным отеком и воспалением слизистой оболочки бронхиального дерева, скоплением и задержкой в бронхах вязкой мокроты. Резко выраженные нарушения бронхиальной проходимости способствуют развитию острого вздутия легких, смещению вниз и уплощению диафрагмы (отсутствие необходимого отрицательного давления для осуществления полноценного вдоха). Эти нарушения создают сопротивление потоку воздуха из окружающей среды.
Факторы высокого риска АС (скрининг):
-
наличие в анамнезе угрожающего жизни обострения БА;
-
длительное применение системных ГКК и их недавняя отмена;
-
наличие в анамнезе эпизодов ИВЛ по поводу обострений БА;
-
психические заболевания или психосоциальные проблемы (отрицание заболевания, невыполнение врачебных назначений, социально-экономические факторы);
-
невозможность оказания медицинской помощи в домашних условиях.
КЛИНИЧЕСКАЯ КАРТИНА
Симптоматика АС зависит от выраженности дыхательной недостаточности и варьирует от картины затянувшегося приступа удушья до коматозного состояния. Клинические параметры этих состояний представлены в табл. 4-10.
Осложнения АС:
-
гипоксемическая и гиперкапническая кома;
-
спонтанный пневмоторакс;
-
острое легочное сердце.
Советы позвонившему
До приезда бригады СМП следует предпринять следующие меры:
-
обеспечить больному возможность свободного дыхания (расстегнуть тесную одежду, придать сидячее положение с упором для рук);
-
успокоить больного;
Таблица 4-10. Степени тяжести обострения бронхиальной астмы
| Симптомы | Легкая | Средняя | Тяжелая | Угрожающее жизни обострение |
|---|---|---|---|---|
|
Физическая активность |
Сохранена |
Ограничена |
Резко снижена |
Отсутствует или резко снижена |
|
Сознание |
Может быть возбуждение |
Возбуждение, иногда агрессивность |
Возбуждение, испуг |
Спутанность сознания, вялость, заторможенность, кома |
|
Речь |
Предложения |
Отдельные фразы |
Отдельные слова |
Больной не разговаривает |
|
Затруднение дыхания |
При ходьбе; может лежать без одышки |
При разговоре |
В покое |
В покое |
|
Частота дыхания |
До 22 в минуту (экспираторная одышка) |
До 25 в минуту (выраженная экспираторная одышка) |
Более 25 в минуту (резко выраженная экспираторная одышка) |
Более 30 (резко выраженная экспираторная одышка) или менее 12 в мин |
|
Симптомы |
Легкие |
Средней тяжести |
Тяжелые |
Угрожающие жизни |
|
Участие вспомогательной дыхательной мускулатуры |
Обычно отсутствует |
Обычно выражено |
Резко выражено |
Парадоксальные торакоаб-доминальные движения |
|
Дыхание при аускультации |
Свистящее на выдохе |
Свистящее на вдохе и выдохе |
Громкое свистящее на вдохе и выдохе |
Отсутствие дыхания — «немое» легкое |
|
ЧСС |
<100 в минуту |
100-120 в минуту |
>120 в минуту |
<55 в минуту |
|
РаO2 |
>80 мм рт.ст. |
60-80 мм рт.ст. |
50-60 мм рт.ст. |
<50 мм рт.ст. |
|
SaO2 |
>95% |
91-95% |
<90% |
<88% |
|
Пиковая скорость выдоха (ПСВ) от нормального или лучшего значения |
>80% |
50-80% (>250 л/мин) |
<50% (<250 л/мин) |
<33% (<100 л/мин) |
Наличие нескольких признаков (необязательно всех) указывает на обострение БА. Легкое и среднетяжелое обострения БА могут быть предстадией АС.
-
помочь воспользоваться ингаляторами при их наличии [сальбутамол 100 мкг — 4-8 ингаляций или фенотерол (беротек♠) 100-200 мкг — 2-4 ингаляции];
-
обеспечить постоянное наблюдение за больным, не кормить и не поить его;
-
приготовить препараты, которые принимает больной, для предъявления врачу скорой помощи;
-
приготовить медицинскую документацию.
ЛЕЧЕНИЕ
Скорая медицинская помощь на догоспитальном этапе
Врач (фельдшер) скорой помощи по прибытии к больному может столкнуться с различной степенью выраженности бронхообструктивного синдрома.
Оценка состояния больного включает сбор краткого анамнеза и физикальное обследование, проводимое параллельно с началом лечения. Необходимо выяснить количество времени, прошедшего с момента начала приступа, и возможную причину обострения с учетом факторов риска, степень тяжести симптомов, включая ограничения физической нагрузки и нарушения сна, базисную терапию (если больной ее получал), а также препараты и их дозы, которые больной получал при ухудшении, и ответ на них.
При объективном обследовании следует оценить степень тяжести обострения по таким признакам (см. табл. 4-10), как положение больного в постели, способность произносить длинные фразы, частота дыхания, ЧСС, АД, участие вспомогательной мускулатуры в акте дыхания, наличие и характер хрипов (включая дистанционные) или признаки «немого» легкого. Для определения степени тяжести обострения и инструментального мониторинга следует использовать пикфлоуметрию (определение ПСВ) и пульсоксиметрию (определение SaO2) при дыхании воздухом.
Дифференциальный диагноз при АС следует проводить с другими заболеваниями, сопровождающимися развитием острой бронхиальной обструкции и дыхательной недостаточности (тяжелая ТЭЛА, астматический вариант ИМ, спонтанный пневмоторакс, тяжелая внебольничная пневмония, ИТ в бронхах и др.).
Любая степень обострения БА требует немедленного начала (усиления) лечения для максимально быстрого уменьшения обструкции и восстановления нормальной проходимости дыхательных путей.
Объем проводимых лечебных мероприятий определяется тяжестью обострения- оценивают при первичном осмотре по клинико-функциональным данным (см. табл. 4-10).
В качестве препаратов первого ряда используют β2-адреномиметики короткого действия. Дозы и режим введения используемых препаратов представлены в табл. 4-11. Ингаляцию β2-адреномиметиков осуществляют через небулайзер или дозированный ингалятор с большим спейсером. При отсутствии эффекта повторное введение этих средств возможно с интервалом 20 мин трижды в течение 1 ч. Окончательное суждение о тяжести обострения у больного можно сделать после оценки эффективности β2-адреномиметиков (процент прироста ПСВ после первой ингаляции).
При эффективности ингаляций β2-адреномиметиков (ПСВ >80% должного или лучшего индивидуального значения) рекомендуют продолжить их прием в течение 1-2 сут, а также назначить противовоспалительные препараты или увеличить вдвое объем получаемой ранее базисной терапии.
При обострении БА средней тяжести вводят β2-адреномиметики с помощью небулайзера (трижды в течение первого часа), назначают системные ГКК и оксигенотерапию.
Таблица 4-11. Дозы препаратов, используемых для лечения обострений бронхиальной астмы
| Препарат | Форма выпуска | Доза |
|---|---|---|
|
Сальбутамол (вентолин небулы♠ , сальгим♠ , стеринеб саламол♠ ) |
Раствор для небулайзеров, 2,5 или 5 мг/мл |
2,5 или 5 мг каждые 20 мин в течение 1 ч, затем через 1-4 ч в режиме «по требованию» |
|
Дозированный аэрозоль со спейсером (100 мкг в одной дозе) |
4-8 ингаляций каждые 20 мин в течение 1-4 ч, затем через 1-4 ч в режиме «по требованию» |
|
|
Фенотерол (беротек♠ ) |
Раствор для небулайзеров, 1 мг/мл |
1 мг каждые 20 мин в течение 1 ч, затем через 1-4 ч в режиме «по требованию» |
|
Дозированный ингалятор со спейсером (100 и 200 мкг в одной дозе) |
2-4 ингаляции каждые 20 мин в течение 1-4 ч, затем через 1-4 ч в режиме «по требованию» |
|
|
Ипратропия бромид (атровент♠ ) |
Раствор для небулайзеров (0,25 мг/мл) |
0,5 мг каждые 30 мин 3 раза, затем через 2-4 ч в режиме «по требованию» |
|
Ипратропия бромид+фенотерол (беродуал♠ ) |
Раствор для небулайзеров (в 1 мл 0,25 мг ипратропия бромида и 0,5 мг фенотерола) |
2 мл каждые 30 мин, затем через каждые 2-4 ч в режиме «по требованию» |
|
Аминофиллин (эуфиллин♠ ) |
Ампулы 2,4% раствора по 10 мл для внутривенного введения |
Разовая доза составляет 250 мг внутривенно капельно, суточная доза — 0,75-1,5 г. Не следует вводить больным, принимавшим препараты теофиллина |
|
Будесонид (пульмикорт♠ ) |
Небулы |
500-1000 мкг 2-4 раза в сутки |
|
Гидрокортизон |
Раствор для внутривенного ведения |
250-1000 мг 3-4 раза в день внутривенно |
|
Преднизолон, метилпреднизолон |
Таблетки, раствор для внутривенного введения |
30-60 мг внутрь, 120-180 мг и более 3-4 раза в день внутривенно |
|
Дексаметазон |
Раствор для внутривенного введения |
4-8 мг и более 3-4 раза в день внутривенно |
При наличии положительной динамики через 1 ч (ПСВ >70% должного, ответ на β2-адреномиметики сохранен) больного можно оставить дома. Ему показаны β2-адреномиметики (через небулайзер или дозированный ингалятор со спейсером) и системные ГКК в течение 7-14 сут. План дальнейшего лечения составляет врач поликлиники.
Если через 1 ч, на фоне проводимого лечения, эффект неполный или отсутствует (ПСВ = 50-70% должного значения), то добавляют ингаляции ипратропия бромида или ипратропия бромида+фенотерола (беродуал♠) через небулайзер. Если ранее пациент не использовал пролонгированные теофиллины, то при необходимости можно внутривенно капельно ввести аминофиллин (эуфиллин♠). В дальнейшем больному показана госпитализация в ОСМПС.
Представленную тактику лечения среднетяжелых обострений БА следует рассматривать как профилактику АС.
При тяжелом и угрожающем жизни обострении БА (АС) больному показана немедленная госпитализация. Транспортировку осуществляют на носилках в полусидячем или сидячем положении, одновременно проводят лечебные мероприятия.
-
Ингаляция увлажненного кислорода с скоростью 1-4 л/мин.
-
Ингаляция 2,5 мл (2,5 мг) сальбутамола или ингаляция 3-4 мл (60-80 капель) ипратропия бромида+фенотерола (беродуала♠) с внутривенным введением 90-120 мг преднизолона (или внутрь 20-30 мг). Вместо преднизолона можно использовать другой ГКК в эквивалентной дозе.
-
Ингаляция 3-4 мл ипратропия бромида + фенотерола (беродуала♠) в сочетании с 1-2 мг (2-4 мл) будесонида (пульмикорта♠) через небулайзер.
При невозможности такой терапии — введение одного из нижеперечисленных препаратов:
-
ингаляция через спейсер сальбутомола, фенотерола 400-800 мкг (4-8 доз) или ипратропия бромида+фенотерола (беродуала♠) через 20 мин в течение 1 ч;
-
ингаляция через спейсер сальбутамола или фенотерола каждые 60 с (до 20 доз);
-
ГКК в объеме, указанном выше.
Согласно международным рекомендациям, при тяжелом обострении БА внутривенное и пероральное назначение ГКК одинаково эффективно.
При отсутствии этих препаратов назначают внутривенно (последовательно) аминофиллин (эуфиллин♠) 240 мг и преднизолон 90-120 мг. При крайне тяжелом состоянии больного (сопорозное состояние, кома) — решение вопроса об ИВЛ и экстренной госпитализации. Состояние пациента оценивают каждые 15 мин (постоянный мониторинг ПСВ, SaO2, ЧСС), проводят поддержку витальных функций в соответствии с общими реанимационными принципами.
Скорая медицинская помощь на стационарном этапе
Дальнейшее лечение больных с АС осуществляют в ОСМПС с возможностями интенсивной терапии (GINA, 2011). План обследования больного включает следующие мероприятия:
-
оценка тяжести состояния пациента (см. табл. 4-10);
-
постоянное мониторирование ЧСС, ЭКГ (признаки ишемии миокарда);
-
регулярное измерение АД непрямым методом;
-
пульсоксиметрия;
-
регулярное определение ЧД;
-
мониторинг ПСВ;
-
общий анализ крови;
-
развернутый биохимический анализ крови (уровень калия);
-
определение газового состава крови и КОС у больных с ПСВ <50% должного значения.
При необходимости дифференциальной диагностики или подозрении на сопутствующее заболевание легких проводят рентгенологическое исследование органов грудной клетки.
Больных с обострениями БА, угрожающими жизни, а также при наличии тяжелой сопутствующей патологии (тяжелая ВнП и др.) необходимо госпитализировать в ОРИТ с возможностью длительной ИВЛ.
Обязательный объем терапии в ОСМПС включает следующее.
-
Постоянные ингаляции увлажненного кислорода со скоростью 1-4 л/мин. Предпочтительнее использовать назофарингеальный катетер, обеспечивающий достаточно высокую концентрацию кислорода во вдыхаемом газе. У наиболее тяжелых пациентов следует применять назальные или лицевые маски. Поток подаваемого больному кислорода необходимо титровать под контролем пульсоксиметрии, чтобы поддерживать удовлетворительное SaO2 (не ниже 92%).
-
Ингаляция 1 мг (20 капель) фенотерола или 2,5 мг сальбутамола, или 2,0 мл раствора ипратропия бромида+фенотерола (беродуала♠) с 0,9% раствором натрия хлорида через небулайзер вместе с кислородом в течение первого часа. Через 1 ч следует повторить процедуру (в течение 2-4 ч), вплоть до улучшения клинических симптомов. Затем (через 4-6 ч) назначают сальбутамол 5 мг (5 мл) или фенотерол 1 мг (20 капель) в сочетании с ипратропия бромидом 500 мкг (2 мл). Вместо указанных препаратов можно использовать 2 мл ипратропия бромида+фенотерола (беродуала♠) в сочетании с одним ГКК или будесонидом.
-
ГКК — 125-200 мг гидрокортизона, 40-125 мг метилпреднизолона или 90 мг преднизолона каждые 6 ч внутривенно (или внутрь 60-80 мг/сут преднизолона). При аспириновой БА препарат выбора — дексаметазон и триамцинолон (триамсинолон♠).
-
2-8 мг будесонида (пульмикорта♠) через небулайзер с кислородом 3 раза в сут. Дополнительная терапия:
-
-
при отсутствии эффекта от проводимой терапии в течение 4-6 ч возможно капельное внутривенное введение аминофиллина (эуфиллина♠) до 720 мг/сут, дальнейшее увеличение дозы требует контроля концентрации теофиллина в крови;
-
в случае доказанной бактериальной инфекции — антибиотики (предпочтительны макролиды, цефалоспорины III и IV поколения и респираторные фторхинолоны). Необходимо помнить следующее:
-
при тяжелом обострении БА внутривенное и пероральное назначение ГКК одинаково эффективно;
-
β2-адреномиметики короткого действия — препараты первой линии для лечения обострений БА в условиях СМП;
-
применение холинолитиков в сочетании с β2-адреномиметиками может быть эффективным при тяжелых обострениях БА;
-
применение теофиллина не показано в первые 4 ч пребывания больного в стационаре;
-
при лечении состояний с отсутствием ответа на ингаляционные β2-адреномиметики и угрожающих жизни обострениях (АС) в качестве альтернативы обычному лечению можно назначить эпинефрин (адреналин♠) подкожно или внутривенно, а также ингаляцию анестетиков.
Применение седативных препаратов и наркотических средств при обострении БА запрещено из-за риска угнетения дыхания. У больных АС не рекомендуют использовать антигистаминные, муколитические препараты, пролонгированные β2-адреномиметики и фитопрепараты. Следует избегать полипрагмазии и назначения других лекарств, не играющих решающей роли в купировании АС.
При отсутствии достаточного эффекта от проводимой терапии в течение 3 ч в сочетании с одним из нижеперечисленных параметров решают вопрос о переводе больного в ОРИТ и необходимости проведения ИВЛ.
-
ЧД ≥25/мин;
-
ЧСС ≥110/мин;
-
ПСВ ≤250 л/мин или ≤50% должного после применения β2-адреномиметиков короткого действия;
-
paO2 ≤60 мм рт.ст. или SaO2 ≤90%. Показания к ИВЛ:
-
нарушение сознания (сопор, кома);
-
остановка дыхания;
-
остановка сердца или фатальные аритмии;
-
нестабильные гемодинамические показатели (САД <70 мм рт. ст, ЧСС <50 или >160/мин);
-
рефрактерная гипоксемия;
-
выраженное утомление дыхательной мускулатуры.
Критерии выписки или перевода пациента из ОСМПС
-
Полное купирование АС.
-
Уменьшение тяжести обострения БА:
-
свободное отхождение мокроты;
-
ЧД <25/мин;
-
ЧСС <110/мин;
-
ПСВ >250 л/мин или >50% должной величины;
-
pаО2 >70 мм рт.ст. или SаО2 >92%.
-
Пациенты с показателями функции легких >60% должных значений могут быть выписаны, при показателях в интервале 40-60% — выписка возможна лишь при условии обеспечения адекватного медицинского наблюдения и лечения в амбулаторных условиях, при показателях <40 — следует продолжить лечение в условиях стационара (специализированное пульмонологическое отделение).
Наиболее часто встречающиеся ошибки:
-
применение препаратов психотропного действия;
-
использование аминофиллина (эуфиллина♠) как средства первого ряда для купирования приступа;
-
назначение β-адреноблокаторов при выраженной тахикардии и сопутствующей патологии сердечно-сосудистой системы.
ПРОФИЛАКТИКА
Основными мерами по профилактике обострений БА, и в частности АС, следует считать проведение адекватной базисной терапии БА вне обострений, раннее и эффективное купирование обострений, запрет курения, проведение противогриппозной вакцинации всем категориям больных, за исключением лиц с аллергией к белку куриного яйца, обучение больных навыкам самоконтроля и самонаблюдения.
СПИСОК ЛИТЕРАТУРЫ
-
Астма бронхиальная у взрослых. Справочник по пульмонологии / Под ред. А.Г. Чучалина, М.М. Ильковича. — М.: ГЭОТАР-Медиа, 2009. — С. 96-120.
-
Глобальная стратегия лечения и профилактики бронхиальной астмы. Пересмотр 2011 г. / Под ред. А.С. Белевского. — М.: Российское респираторное общество, 2012. — 107 с.
-
Клинические рекомендации Российского респираторного общества / Под ред. А.Г. Чучалина. — М.: ГЭОТАР-Медиа, 2007. — 225 с.
-
Федосеев Г.Б., Трофимов В.И. Бронхиальная астма. — СПб.: Нормедиздат, 2006. — 308 с.
4.4. ПНЕВМОТОРАКС
В.А. Волчков, И.В. Мосин
ОПРЕДЕЛЕНИЕ
Пневмоторакс (от греч. pneuma — дуновение, воздух и thorax — грудь) — наличие воздуха в плевральной полости. Спонтанный пневмоторакс — синдром, характеризующийся патологическим скоплением воздуха в плевральной полости, не связанным с травмой грудной клетки, врачебными манипуляциями, опухолевой или инфекционной деструкцией легочной ткани.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Чаще всего пневмоторакс — проявление других, в силу различных причин не диагностированных и значительно более сложных патологических процессов в легочной ткани, в первую очередь эмфиземы легких (табл. 4-12). Буллезная эмфизема легких — причина возникновения спонтанного пневмоторакса в 71-95% случаев. У 76-100% таких больных во время видеоторакоскопии обнаруживают субплевральные буллы (локально перераздутые участки эмфиземы диаметром более 1 см), а при открытой торакотомии — в 100% случаев. В контралатеральном легком буллы определяют у 79-96% больных. Рентгеновская КТ грудной клетки позволяет выявить буллы у 89% больных первичным спонтанным пневмотораксом, по сравнению с 20% у здоровых людей тех же возрастных групп со сходным анамнезом курения. Частота обнаружения булл у некурящих пациентов с пневмотораксом достигает 81%.
Таблица 4-12. Наиболее распространенные причины вторичного спонтанного пневмоторакса
|
Заболевания дыхательных путей |
ХОБЛ |
|
БА |
|
|
Муковисцидоз |
|
|
Интерстициальные заболевания легких |
Саркоидоз |
|
Идиопатический легочный фиброз |
|
|
Гистиоцитоз X |
|
|
Лимфангиолейомиоматоз |
|
|
Инфекционные заболевания легких |
Пневмоцистная пневмония у пациентов со злокачественными опухолями, ВИЧ/синдром приобретенного иммунного дефицита на фоне приема иммунодепрессантов, туберкулез легких, абсцедирующая пневмония |
|
Системные заболевания соединительной ткани |
Ревматоидный артрит |
|
Анкилозирующий спондилит |
|
|
Полимиозит/дерматомиозит |
|
|
Системная склеродермия |
|
|
Синдром Марфана |
|
|
Синдром Элерса-Данло |
|
|
Злокачественные новообразования |
Саркома, рак легкого |
|
Другие причины |
Легочный эндометриоз |
Механизм формирования булл на данном этапе еще до конца не изучен. Возможно, они возникают вследствие деградации эластических волокон легких при активации нейтрофилов и макрофагов табачным дымом или другими поллютантами. Это приводит к нарушению баланса между протеазами и антипротеазами, развитию окислительного стресса и подавлению протективных эффектов внутри- и внеклеточных антиоксидантных защитных систем. Раннему началу тяжелой эмфиземы нижних отделов легких способствует также дефицит а1-антитрипсина, ингибирующего нейтрофильную эластазу. Формирование буллы приводит к воспалительной обструкции мелких дыхательных путей, в результате чего увеличивается внутриальвеолярное давление и воздух начинает проникать в легочный интерстиций. Затем воздух продвигается по направлению к корню легкого, вызывая эмфизему средостения. Рост давления в средостении может стать причиной разрыва висцеральной плевры и развития пневмоторакса. Большой первичный спонтанный пневмоторакс приводит к резкому уменьшению жизненной емкости легких, увеличению альвеоло-артериального градиента по кислороду и гипоксемии различной степени тяжести. Гипоксемия — результат нарушения вентиляционно-перфузионных отношений и появления шунта справа налево. Тяжесть этих расстройств зависит от величины пневмоторакса. Поскольку газообмен в легких обычно не нарушается, то гиперкапния длительно не развивается.
Спонтанный пневмоторакс может быть вызван не только разрывом стенки буллы. H. Suzuki (1976) доказал наличие в стенках булл микропор диаметром 10 мкм, которые могут стать причиной спонтанного пневмоторакса. Реже спонтанный пневмоторакс возникает при разрыве паренхимы легкого спайками (у 3-5% больных) и перфорации врожденных кист легкого (у 1-3%).
Частота рецидивов в течение 1-10 лет после перенесенного спонтанного пневмоторакса составляет 16-52% (в среднем 30%). Основная часть рецидивов приходится на первые 2 года. После рецидива пневмоторакса вероятность последующих приступов прогрессивно увеличивается: 62% после 2-го эпизода и 83% — после 3-го пневмоторакса.
Патогенез пневмоторакса включает несколько последовательных стадий.
-
Возникновение сообщения плевральной полости с окружающей средой (через просвет бронха или при нарушении целостности грудной клетки). В нормальных условиях воздух в плевральной полости отсутствует. Воздух (газ) может попасть в плевральную полость в следующих случаях:
-
при сообщении альвеол с плевральной полостью;
-
при сообщении атмосферы и плевральной полости;
-
при наличии в плевральной полости газообразующих микроорганизмов.
-
-
Поступление воздуха в плевральную полость и повышение внутриплеврального давления (в норме — ниже атмосферного). Проникновение воздуха между плевральными листками через дефект в висцеральной плевре происходит в момент вдоха. Ритмичное расширение грудной клетки в эту фазу дыхания сопровождается повышением отрицательного давления в плевральной полости. При каждом вдохе струя воздуха, проходящая через дефект в висцеральной плевре, как бы «всасывается» в плевральную щель, превращая отрицательное давление в положительное и способствуя спаданию легочной ткани. Период свободного проникновения воздуха в плевральную полость называется фазой открытого пневмоторакса.
Когда дефект в висцеральной плевре в результате спадания легочной ткани уменьшается и всасывание воздуха в плевральную полость на высоте вдоха практически прекращается, фаза открытого пневмоторакса сменяется фазой закрытого пневмоторакса. При наличии в области дефекта вентильного (клапанного) механизма воздушная струя проходит только в направлении плевральной полости, что приводит к быстрому нарастанию внутриплеврального давления и прогрессирующему спаданию легочной ткани (если этому не препятствуют плевральные сращения).
-
Сдавление и спадание легочной ткани (коллапс легкого) создает неэффективную вентиляцию, приводящую к гипоксемии. При значительном дефекте в легком действие нагнетающего механизма может сохраняться в условиях полного коллапса легочной ткани и высоком внутриплевральном давлении. Несмотря на то что внутриплевральное давление достигает высоких значений, а легкое спадается, давление в крупных бронхах на высоте выдоха превосходит внутриплевральное. Именно поэтому воздух продолжает поступать в плевральную полость и на выдохе. В дальнейшем поступление воздуха приводит к смещению органов средостения, обусловливая нарастание явлений дыхательной и сердечной недостаточности.
-
Смещение средостения в противоположную сторону, сдавление и перегиб крупных кровеносных сосудов (верхней полой вены) обусловливает уменьшение венозного возврата и снижение разовых и минутных параметров кровообращения, что приводит к усугублению гипоксемии.
-
Развитие воспалительного процесса в плевре начинается через 4-6 ч с момента возникновения пневмоторакса, через 2-5 сут плевра утолщается за счет отека и слоя выпавшего фибрина.
-
Формирование плевральных сращений, затрудняющих расправление легкого.
КЛАССИФИКАЦИЯ
Разновидности пневмотораксов
-
По происхождению (табл. 4-13):
-
спонтанный (самопроизвольный, не связанный с травмой);
-
травматический;
-
ятрогенный.
-
-
В зависимости от поражения одного или обоих легких:
-
односторонний;
-
двусторонний.
-
-
По сообщению с внешней средой:
-
открытый;
-
закрытый;
-
клапанный.
-
-
По распространенности:
-
ограниченный;
-
субтотальный;
-
тотальный.
-
-
По степени спадания легкого:
-
полный;
-
частичный.
-
-
По объему (в зависимости от расстояния между легким и грудной стенкой):
-
малый (менее 2 см);
-
большой (более 2 см).
-
-
По отсутствию/наличию осложнений:
-
неосложненный;
-
осложненный (кровотечение, плеврит, эмфизема средостения и пр.).
-
Таблица 4-13. Этиологическая классификация пневмоторакса
|
Спонтанный (самопроизвольный) |
|
Первичный: отсутствуют данные о заболеваниях легких. Вторичный: осложнение диагностированной легочной патологии (туберкулез, буллезная эмфизема легких, ХОБЛ и др.) |
|
Травматический |
|
Проникающая травма грудной клетки. |
|
Тупая травма грудной клетки |
|
Ятрогенный |
|
После пункции плевральной полости. |
|
После катетеризации центральных вен. |
|
После торакоцентеза и биопсии плевры. |
|
После чрезбронхиальной эндоскопической биопсии легкого. |
|
Осложнения ИВЛ (травма давлением и/или объемом) |
Первичный спонтанный пневмоторакс возникает при отсутствии клинически значимой легочной патологии, чаще всего у молодых высоких и худощавых мужчин. Вторичный спонтанный пневмоторакс — осложнение существующей легочной патологии.
Классификация пневмоторакса по МКБ-10
-
J93.0 — спонтанный пневмоторакс напряжения.
-
J93.1 — другой спонтанный пневмоторакс.
-
J93.8 — другой пневмоторакс.
-
J93.9 — пневмоторакс неуточненный.
КЛИНИЧЕСКАЯ КАРТИНА
Острое начало заболевания, как правило, не связано с физической нагрузкой!
Основные жалобы больных с пневмотораксом:
-
резкая боль («острая», «пронзающая», «кинжальная») в соответствующей половине грудной клетки с иррадиацией в шею, руку, усиливающаяся при глубоком дыхании, кашле и движении;
-
внезапная одышка;
-
тахикардия;
-
постоянный сухой кашель, выраженная потливость, общая слабость, тревожность.
Через несколько часов (реже минут), даже при отсутствии лечения и сохранении прежнего объема пневмоторакса, боль и одышка уменьшаются.
Вторичный спонтанный пневмоторакс может возникать без боли и проявляться усилением дыхательной недостаточности.
Диагностика пневмоторакса в случае типичной клинической картины не представляет трудностей, однако следует помнить, что скрытая и стертая клиническая картина встречается более чем в 20% случаев. У таких пациентов отмечают умеренные боли радикулоневритического или стенокардитического характера без легочной симптоматики и зачастую они безуспешно «лечатся» от ишемической болезни, межреберной невралгии, остеохондроза и подобных заболеваний. Это подчеркивает обязательность рентгеновского исследования при любых жалобах на боли в груди.
Напряженный пневмоторакс характеризуется нарастающей одышкой (ЧД >24 в минуту, учащенное дыхание затрудняет речь больного), цианозом, тахикардией (ЧСС >135 в минуту), парадоксальным пульсом, артериальной гипотензией (вплоть до шока), смещением средостения в здоровую сторону, набуханием шейных вен, угрозой остановки дыхания и кровообращения.
Дифференциальную диагностику проводят с заболеваниями, сопровождающимися одышкой и болью в грудной клетке: пневмонией, ТЭЛА, БА, плевритом, переломом ребер, инфарктом миокарда, аритмиями, сердечной недостаточностью и др.
Советы позвонившему
-
Создайте условия для свободного дыхания больного (расстегните одежду, обеспечьте приток свежего воздуха).
-
Обеспечьте удобное положение — сидя (ноги опущены вниз) или лежа с приподнятым головным концом.
-
Постарайтесь успокоить больного.
-
Не давайте больному есть и пить.
-
Не оставляйте больного без присмотра.
ЛЕЧЕНИЕ
Скорая медицинская помощь на догоспитальном этапе
Обязательные вопросы
-
Когда началась боль? Усиливается ли боль при глубоком вдохе, кашле, движении?
-
Имеется ли чувство нехватки воздуха?
-
Какая причина способствовала появлению боли (травма, медицинская манипуляция, интенсивная физическая нагрузка, перепад давления и др.)?
-
Имелись ли ранее эпизоды перенесенного пневмоторакса? Уточните стаж курения.
-
Какие сопутствующие заболевания у больного (ХОБЛ, БА, пневмония, туберкулез, бронхоэктазии, ВИЧ, болезнь Марфана и др.)?
Осмотр и физикальное обследование
-
Оценка общего состояния и жизненно важных функций: сознания, дыхания (учащенное, поверхностное), кровообращения.
-
Визуальная оценка: конституция (астеническая), вынужденное положение (сидячее или полусидячее), кожные покровы (бледные, покрыты холодным потом и/или цианотичные).
-
Исследование пульса, ЧСС, АД (тахикардия, артериальная гипотензия).
-
Осмотр грудной клетки: расширение межреберных промежутков, отставание при дыхании пораженной половины грудной клетки, набухание и пульсация шейных вен, подкожная эмфизема.
-
Пальпация и перкуссия грудной клетки: ослабление или отсутствие голосового дрожания на пораженной стороне, тимпанический звук (при накоплении жидкости в плевральной полости определяют притупление перкуторного звука), смещение области верхушечного толчка и границ сердечной тупости в здоровую сторону.
-
Аускультация: ослабление или отсутствие дыхания на пораженной стороне.
Следует помнить, что при небольшом пневмотораксе (коллапс менее 15%) физикальное обследование может не выявить никаких изменений. Отчетливо симптомы определяются при коллапсе легкого 30-40% и более.
Из инструментальных исследований на догоспитальном этапе проводят пульсоксиметрию (SpO2<92%) и ЭКГ.
В процессе диагностики и выбора лечебной тактики особого подхода требуют осложненные формы спонтанного пневмоторакса: напряженный пневмоторакс, продолжающееся внутриплевральное кровотечение (гемопневмоторакс), двусторонний пневмоторакс и пневмомедиастинум.
Внезапное появление болей в грудной клетке требует целенаправленного исключения спонтанного пневмоторакса.
Лечебные мероприятия на догоспитальном этапе
-
СЛР при потере сознания, остановке кровообращения и/или дыхания.
-
Коррекция гипоксемии — кислородотерапия (подача кислорода через носовые канюли или лицевую маску со скоростью до 5 л/мин в зависимости от степени гипоксемии при потоке) (уровень доказательности А).
-
Катетеризация кубитальной или другой периферической вены.
-
Введение растворов электролитов: 400 мл 0,9% раствора натрия хлорида или 5% раствора декстрозы (глюкозы♠).
-
Купирование болевого синдрома — ненаркотические и наркотические (при выраженном болевом синдроме) анальгетики:
-
метамизол натрия внутримышечно или внутривенно по 250-500 мг 3 раза в сутки; максимальная разовая доза — 1 г, суточная — 2 г;
-
кеторолак внутривенно 10-30 мг (1 мл), дозу необходимо вводить не менее чем за 15 с, возможно внутримышечное введение 10-60 мг (1-2 мл) препарата (аналгетический эффект развивается через 30 мин);
-
трамадол (при сильных болях) внутривенно медленно (не более 1 мл в минуту, что соответствует 50 мг), возможно разведение 0,9% раствором натрия хлорида или 5% раствором декстрозы (глюкозы♠) до 20 мл (1 мл полученного раствора содержит 5 мг активного вещества); внутримышечно или подкожно 50-100 мг (уровень доказательности В).
-
-
Проведение торакоцентеза при напряженном пневмотораксе (показан по жизненным показаниям). Для этого вводят иглу самого большого размера (не короче 4,5 см) в плевральную полость во втором межреберье по среднеключичной линии на стороне, где дыхание полностью отсутствует или ослаблено (уровень доказательности А). Как только через иглу начинает выходить воздух, ее фиксируют в таком положении.
-
Ингаляции бронхолитиков при развитии бронхоспазма (одного из перечисленных).
-
4-8 ингаляций сальбутамола (дозированный аэрозоль со спейсером, 100 мкг/доза) каждые 20 мин в течение 1-4 ч, затем (через 1-4 ч) ингаляция в режиме «по требованию». При наличии возможности проводят ингаляцию сальбутамола через небулайзер — 2,5-5,0 мг/мл каждые 20 мин в течение 1 ч, затем — в режиме «по требованию».
-
2-4 ингаляции фенотерола (дозированный аэрозоль через спейсер, 100-200 мкг/доза) каждые 20 мин в течение 1-4 ч, затем — в режиме «по требованию». Можно вводить фенотерол через небулайзер — 1 мг/мл каждые 20 мин в течение 1 ч, через 1-4 ч — в режиме «по требованию».
-
4 ингаляции ипратропия бромида+фенотерола (беродуала♠) через спейсер каждые 20 мин в течение 1 ч. Одна доза содержит 0,021 мг ипратропия бромида и 0,05 мг фенотерола. Можно использовать небулайзер — по 2 мл (в 1 мл содержится 0,25 мг ипратропия бромида и 0,5 мг фенотерола) каждые 30 мин, затем — через каждые 2-4 ч в режиме «по требованию» (уровень доказательности В).
-
-
Поддержание витальных функций (в соответствии с общими реанимационными принципами), контроль показателей гемодинамики и насыщения крови кислородом.
Все больные с пневмотораксом подлежат немедленной госпитализации в отделение торакальной хирургии или ОРИТ. Если диагноз требует уточнения и нет необходимости в реанимационных мероприятиях, больной может быть доставлен в ОСМПС. Транспортировку пациента проводят в положении сидя или с приподнятым головным концом. В случае отказа больного от госпитализации он сам и его родственники должны быть предупреждены о возможных последствиях с соответствующей записью в медицинской карте.
Скорая медицинская помощь на стационарном этапе
Задача диагностического этапа в ОСМПС — уточнение диагноза и определение дальнейшей лечебной тактики. Особое внимание необходимо уделить больным с осложненными формами спонтанного пневмоторакса.
Обследование в ОСМПС включает следующие пункты.
-
Лабораторные исследования (общий анализ крови, группа крови и резус-фактор).
-
Пульсоксиметрия.
-
Определение газового состава и КОС крови.
-
ЭКГ (признаки перегрузки правых отделов сердца).
-
Рентгенография грудной клетки. Необходимо выполнить рентгенографию в прямой и боковых проекциях, а в сомнительных случаях — дополнительный снимок на выдохе в прямой проекции. Основные рентгеновские симптомы — визуализация очерченного края коллабированного легкого, смещение средостения, изменение положения диафрагмы, подчеркивание структуры ребер и хрящей на фоне воздуха в плевральной полости. При оценке рентгенограмм необходимо помнить о возможности ограниченного пневмоторакса, имеющего, как правило, верхушечную, парамедиастинальную или наддиафрагмальную локализацию. В этих случаях необходимо выполнить рентгенограммы на вдохе и выдохе, сравнение которых дает полную информацию о наличии ограниченного пневмоторакса. Важной задачей рентгенологического исследования служит оценка состояния паренхимы как пораженного, так и противоположного легкого (уровень доказательности А).
-
КТ грудной клетки для уточнения локализации и объема пневмоторакса, наличия плевральных спаек, состояния легочной паренхимы, диагностики заболеваний, приведших к пневмотораксу, определения дальнейшей тактики лечения (уровень доказательности А).
Лечебные мероприятия на стационарном этапе предусматривают коррекцию гипоксемии, купирование болевого синдрома, контроль показателей гемодинамики и поддержание витальных функций.
После физикального и инструментального обследования, позволяющего оценить степень коллапса легкого, смещения средостения, наличия сращений и жидкости, необходимо определить тактику дальнейшего лечения:
-
динамическое наблюдение;
-
пункция плевральной полости;
-
дренирование плевральной полости.
Динамическим наблюдением (без эвакуации воздуха) можно ограничиться при спонтанном пневмотораксе небольшого объема (менее 15%) или при изолированном верхушечном пневмотораксе у больных без выраженного диспноэ, когда край легкого пациента находится выше ключицы. Скорость рассасывания воздуха составляет 1,25% объема гемоторакса в течение 24 ч. Таким образом, для полного разрешения пневмоторакса объемом 15% потребуется приблизительно 8-12 сут.
Пункция плевральной полости показана пациентам моложе 50 лет при первом эпизоде спонтанного пневмоторакса объемом 15-30% без выраженного диспноэ. Процедуру проводят при помощи иглы или тонкого стилета-катетера. Типичным местом для пункции служит второе межреберье по средне-ключичной линии. Однако точку пункции следует определять только после рентгеновского исследования, позволяющего уточнить локализацию спаек и наибольшего скопления воздуха. Аспирацию проводят с помощью шприца; после завершения эвакуации воздуха иглу или катетер удаляют.
Дренирование плевральной полости показано в следующих ситуациях:
-
при объеме пневмоторакса более 30%;
-
при рецидиве пневмоторакса;
-
при неэффективности плевральной пункции;
-
у больных с диспноэ;
-
у пациентов старше 50 лет.
Дренирование плевральной полости приводит к расправлению легкого в 84-97% случаев (уровень доказательности А). Ключевые моменты правильной постановки дренажа — обязательное полипозиционное рентгеновское исследование до дренирования и контроль положения дренажа с его коррекцией по мере необходимости после манипуляции.
Дренирование целесообразно выполнять с помощью стилета-катетера, который вводят в точке, намеченной при рентгеноскопии (при отсутствии спаечного процесса — во втором межреберье по среднеключичной линии), дренажем диаметром не менее 12 Fr с подключением его к активной аспирации (давление в пределах 20-40 см вод. ст.). В случае невозможности активной аспирации или длительности пневмоторакса более 2 сут (возможность реперфузионного легких отека при быстром расправлении) необходимо дренирование плевральной полости по Бюлау.
Критерии для удаления плеврального дренажа:
-
полное расправление легкого по данным рентгенологического исследования;
-
отсутствие поступления воздуха по дренажу в течение 24 ч;
-
количество отделяемого по дренажу менее 50 мл/сут.
Осложненный спонтанный пневмоторакс (с признаками продолжающегося внутриплеврального кровотечения, напряженный пневмоторакс на фоне дренированной плевральной полости) — показание к экстренной/срочной операции. После ликвидации осложнений обязательна индукция плевродеза.
Невозможность выполнения диагностической торакоскопии, рецидивирующий пневмоторакс, выявление изменений в легочной ткани (во время диагностической торакоскопии), продолжающийся сброс воздуха или нерасправление легкого в течение 3-4 сут, а также наличие поздних осложнений (эмпиема плевры, стойкий коллапс легкого) — показания для консультации торакального хирурга и/или перевода больного в специализированный стационар.
Выполнение противорецидивного оперативного вмешательства больным с неосложненным течением спонтанного пневмоторакса в условиях неспециализированного хирургического стационара не рекомендуется (уровень доказательности С).
Наиболее часто встречающиеся ошибки
-
Отказ от немедленного торакоцентеза при подозрении на напряженный пневмоторакс.
-
Применение никетамида (кордиамина♠). Использование препарата патогенетически не обосновано, так как никетамид не оказывает непосредственного влияния на сердечнососудистую систему, но возбуждает сосудо-двигательный центр продолговатого мозга и хеморецепторы каротидного синуса, вызывая увеличение частоты и глубины дыхательных движений (усугубление болевого синдрома). Необходимо помнить, что препарат малоизучен и имеет серьезные побочные эффекты: тонико-клонические судороги (начинающиеся с круговых мышц рта), аритмии, рвота, гиперемия и зуд кожного покрова, тревожность, болезненность в месте введения, аллергические реакции.
-
Использование прокаина+сульфокамфорной кислоты (сульфокамфокаина♠). Препарат противопоказан в связи с опасностью развития артериальной гипотензии и тяжелых острых аллергических реакций. Инъекционные формы прокаина+сульфокамфорной кислоты (сульфокамфокаина♠) оказывают прямое кардио-токсическое действие, повышают тонус периферических кровеносных сосудов, увеличивают секрецию бронхиальных желез.
СПИСОК ЛИТЕРАТУРЫ
-
Вирус иммунодефицита человека. — 2-е изд. / Под ред. Н.А. Белякова, А.Г. Рахмановой. — СПб.: Балтийский медицинский образовательный центр, 2011. — С. 126160.
-
Интенсивная терапия: Национальное руководство: В 2 т. / Под ред. Б.Р. Гельфанда, А.И. Салтанова. — М.: ГЭОТАР-Медиа, 2013. — С. 522-526.
-
Марино П.Л. Интенсивная терапия: Пер. с англ. / Под ред. А.П. Зильбера. — М.: ГЭОТАР-Медиа, 2013. — С. 371-379.
-
Неотложные состояния в хирургической практике: Методические рекомендации / Под ред. А.Г Соколовича. — Красноярск: Версо, 2006. — 43 с.
-
Омэн К.С., Козиол-МакЛэйн Д. Секреты неотложной медицины: Пер. с англ. — М.: БИНОМ, 2011. — С. 362-367.
-
Павлов Ю.В., Крылов Н.Н., Павлов А.Ю. Редкое осложнение первичного спонтанного пневмоторакса // Хирургия. Журнал им. Н.И. Пирогова. -2011. — № 10. — С. 85-86.
-
Пульмонология: Национальное руководство. Краткое руководство / Под ред. А.Г. Чучалина. — М.: ГЭОТАР-Медиа, 2013. — С. 645-665.
-
Российская Федерация. Министерство здравоохранения и социального развития РФ. Стандарт скорой медицинской помощи при спонтанном пневмотораксе напряжения. 24 декабря 2012 г. Приказ МЗ РФ №1407н.
-
Руководство по скорой медицинской помощи / Под ред. С.Ф. Багненко, А.Л. Верткина, А.Г. Мирошниченко, М.Ш. Хубутия. — М.: ГЭОТАР-Медиа, 2007. — С. 155159.
-
Спригингс Д., Чамберс Д. Экстренная медицина: Пер. с англ. — М.: Медлит, 2008. — С. 230-233.
-
Сумин С.А. Неотложные состояния. — 7-е изд. — М.: МИА, 2012. — С. 125-127.
-
Татур А.А., Пландовский А.В., Кардис В.И. Современные технологии лечения пациентов со спонтанным пневмотораксом // Хирургия. Восточная Европа. -2012. — № 4. — С. 12-15.
-
Яблонский П.К., Корымасов Е.А., Паршин В.Д. и др. Национальные клинические рекомендации по диагностике и лечению спонтанного пневмоторакса. // Российское общество хирургов. — 2013. — http:// общество-хирургов.рф/stranica-pravlenija/klinicheskie-rekomendaci/torakalnaja-hirurgija/nacionalnye-klinicheskie-rekomendaci-po-diagnostike-i-lecheniyu-spontanogo-pnevmotoraksa.html
-
Baumann M.N., Strange C., Heffner J.E. et al. Management of spontaneous pneumothorax // Am. Coll. Chest Physician. — 2001. — Vol. 119, N 2. — P. 590-602.
-
Brown S.G., Ball E.L., Macdonald S.P., et al. Spontaneous pneumothorax; a multicentre retrospective analysis of emergency treatment, complications and outcomes // Intern. Med. — 2014. — Vol. 44, N 5. — P. 450-457.
-
Mac Duff A., Arnold A., Harvey J. Management of spontaneous pneumothorax: British Thoracic Society pleural disease // Thorax. — 2010. — Vol. 65. Suppl. 2. — P. ii18-ii31.
-
Sahn S.A., Heffner J.E. Spontaneous pneumothorax // N. Engl. J. Med. — 2000. — Vol. 342, N 8. — P. 68-74.
4.5. ЛЕГОЧНОЕ КРОВОТЕЧЕНИЕ
И.В. Мосин, В.А. Волчков, О.Н. Титова
ОПРЕДЕЛЕНИЕ
Легочное кровотечение — выделение с кашлем мокроты, окрашенной кровью, или чистой крови, исходящей из трахеи и бронхов вследствие нарушения целостности сосудов.
В практическом отношении важно разграничить легочное кровотечение и менее опасное, но более распространенное кровохарканье.
Кровохарканьем называют выделение с кашлем крови в виде прожилок в объеме, не превышающем 50 мл в сутки. Увеличение этого объема расценивают как легочное кровотечение. Кровохарканье, в отличие от кровотечения, не вызывает в организме больного изменений, характерных для любой значимой кровопотери (анемии, тахикардии, артериальной гипотензии и др.).
ЭТОЛОГИЯ И ПАТОГЕНЕЗ
Летальность при массивных кровотечениях составляет 39-80%, при этом 76% больных умирают в течение первого часа.
Трудности лечения больных с легочным кровотечением обусловлены не кровопотерей, а аспирацией крови в интактные отделы легких.
Основные причины легочных кровотечений представлены в табл. 4-14.
Наиболее распространенные причины летального исхода при легочных кровотечениях — асфиксия, двусторонняя аспирационная пневмония.
Выделяют три основных механизма развития легочного кровотечения:
-
механическая травма или ранение сосудов (ятрогенный, травматический типы кровотечения);
-
патологический процесс с образованием дефекта сосудистой стенки (при опухолях, инфекционных деструкциях легких, бронхоэктазах);
-
нарушение проницаемости сосудистой стенки (при васкулитах, коагулопатиях, острых инфекционных заболеваниях).
Таблица 4-14. Основные причины поступления крови из дыхательных путей
| Тип | Причина |
|---|---|
|
Инфекционные |
Пневмония. Туберкулез. Инфекционная деструкция легких (абсцесс, гангрена). Грибковое поражение. Паразитарные инфекции. Бронхит (атрофический). Нагноившаяся булла легкого. Бронхолитиаз. Бронхоэктазы |
|
Ятрогенные |
Бронхоскопия. Чрезбронхиальная (чрестрахеальная) бронхоскопия. Пункция (дренирование) плевральной полости. Катетеризация подключичной вены. Катетеризация легочной артерии |
|
Травматические |
Ранение легкого. Ушиб легкого. Разрыв бронха. Респираторно-артериальная (венозная) фистула. Аспирация ИТ |
|
Опухолевые |
Первичный рак легкого. Доброкачественные опухоли бронхов. Метастазы в легкие. Саркома легкого |
|
Сосудистые |
ТЭЛА. Инфаркт легкого. Артериовенозная мальформация. Левожелудочковая недостаточность. Аневризма легочной артерии (вены). Аневризма аорты. Секвестрация легкого. Врожденная патология сосудов легкого. Первичная легочная гипертензия. Гипертоническая болезнь |
|
Коагулопатии |
Болезнь Виллебранда. Гемофилия. Тромбоцитопения. Дисфункция тромбоцитов. Синдром диссеминированного внутрисосудистого свертывания (ДВС) |
|
Васкулиты |
Гранулематоз Вегенера. Болезнь Бехчета |
|
Другие |
Лейомиоматоз Эндометриоз Пневмокониоз, бронхиолит Идиопатическое кровохарканье |
У больных молодого возраста причиной кровохарканья, как правило, бывает инфекция. У больных пожилого возраста — бронхит, опухоли, туберкулез, застойная сердечная недостаточность.
Частота возникновения легочных кровотечений, обусловленных туберкулезом легких, доходит до 40% случаев, нагноительными заболеваниями легких — 30-33%, раком легкого — 15%. Примерно у 20% больных с нормальной рентгенограммой этиология кровотечений остается неизвестной.
Источник легочного кровотечения — система большого круга кровообращения (бронхиальные артерии, расширенные и истонченные в зоне патологического процесса) и система малого круга (легочные артерии и вены, часто повреждаемые при ранениях и острых деструкциях). Кровотечения из большого круга кровообращения составляют 80-90% всех легочных кровотечений. Описаны клинические наблюдения легочных кровотечений из межреберных, внутренних грудных артерий, ветвей подключичной артерии и аорты при ее аневризме.
КЛАССИФИКАЦИЯ
В отечественной и зарубежной литературе существует множество различных классификаций легочных кровотечений, но ни одна из них не претендует на абсолютную точность.
Классификация легочных кровотечений по степени кровопотери
-
Легкая степень (благоприятный прогноз) — прожилки крови или равномерная примесь крови ярко-красного цвета в мокроте.
-
Тяжелая степень (массивное кровотечение) — отхаркивание большого количества крови в каждом плевке мокроты или более 1000 мл за 24 ч.
Классификация в зависимости от интенсивности кровопотери (Григорьев Е.Г., 1981)
-
I степень — кровохарканье:
-
Iа — до 50 мл/сут;
-
Iб — 50-200 мл/сут;
-
Iв — 200-500 мл/сут.
-
-
II степень — массивное легочное кровотечение:
-
Iа — 30-200 мл/ч;
-
Iб — 200-500 мл/ч.
-
-
III степень — профузное легочное кровотечение:
-
IIIа — 100 мл одномоментно;
-
IIIб — более 100 мл одномоментно в сочетании с обструкцией ТБД и асфиксией.
-
Количественная оценка кровопотери носит приблизительный характер, так как, с одной стороны, больные и окружающие их склонны преувеличивать количество выделенной крови, а с другой стороны — часть крови из дыхательных путей может аспирироваться или заглатываться больным. Кроме того, больные с исходно сниженной функцией внешнего дыхания могут тяжело переносить и относительно небольшую кровопотерю, а наличие ряда сопутствующих заболеваний — приводить к раннему развитию системных осложнений кровопотери.
Классификация легочных кровотечений, учитывающая количественные критерии кровопотери и реакцию организма на нее (Стручкова В.И. , Недведцкая Л.М., Долина О.А., Бирюкова Ю.Б., 1985)
-
I степень — кровопотеря до 300 мл/сут:
-
однократное (скрытое, явное);
-
многократное (скрытое, явное).
-
-
II степень — кровопотеря до 700 мл/сут.
-
Однократное кровотечение:
-
с падением АД
-
-
на 20-30 мм рт.ст. и снижением гемоглобина на 40-45 г/л;
-
без падения АД и снижения гемоглобина.
-
-
Многократное кровотечение:
-
с падением АД на 20-30 мм рт.ст. и снижением гемоглобина на 40-45 г/л;
-
без падения АД и снижения гемоглобина.
-
-
-
III степень — кровопотеря свыше 700 мл/сут:
-
массивное легочное кровотечение — учитывают однократность и многократность повторения эпизодов кровотечения, изменение АД, лейкоцитарной формулы крови;
-
молниеносное легочное кровотечение — обильное (более 500 мл), возникающее одномоментно или в течение короткого промежутка времени.
-
Основные клинические варианты развития и течения легочных кровотечений (Иванов А.В., 1997)
-
Первый вариант — кровотечение с асфиксией дыхательных путей. Характеризуется быстрым развитием гипоксии, гиперкапнии в результате тотальной гемообструкции и гемоаспирации в ТБД. Смерть больных наступает в течение нескольких минут, реанимационные мероприятия неэффективны более чем в 90% случаев.
-
Второй вариант — непрерывно, волнообразно продолжающееся кровотечение. Характеризуется значительными колебаниями интенсивности поступления крови в ТБД и легочную ткань. Кровотечение трудно диагностировать. Часто сопровождается развитием аспирационной пневмонии.
-
Третий вариант — кровотечение начинается с кровохарканья и медленно нарастает в течение одних или нескольких суток. При неэффективной консервативной терапии третий вариант часто переходит во второй и первый.
-
Четвертый вариант — состоявшееся (закончившееся) легочное кровотечение. Характеризуется снижением и прекращением кровохарканья.
-
Пятый вариант — рецидивирующее кровотечение.
Первые три варианта — угрожающие жизни состояния, требующие постоянного мониторирования показателей гемодинамики, многокомпонентной терапии, бронхоскопии, эндоваскулярных или хирургических операций с целью остановки кровотечения и ликвидации его последствий.
КЛИНИЧЕСКАЯ КАРТИНА
Легочное кровотечение характеризуется наличием примеси крови в отделяемом из носоили ротоглотки. Кровотечение может быть представлено как в виде прожилок крови в мокроте, так и выделения алой пенистой крови и/или ее сгустков через носо- и ротоглотку с кашлевыми толчками.
Первые клинические признаки легочного кровотечения имеют ряд своеобразных черт. Отделению крови часто предшествует приступообразный или длительно непрекращающийся кашель, вначале — сухой, но спустя непродолжительное время он становится влажным, с отделением возрастающего количества мокроты слизистого или гнойного характера. В мокроте появляются прожилки крови, а вскоре она приобретает вид жидкой алой крови и ее сгустков.
В зависимости от причин возникновения кровохарканье имеет ряд особенностей (табл. 4-15).
В ряде случаев возникновению легочного кровотечения может предшествовать тяжелая физическая нагрузка, форсированное дыхание. Некоторые больные отмечают чувство неприятного «жжения», «истечения крови из легкого» или боли в грудной полости. Их локализация иногда совпадает с местоположением выявленных ранее патологических изменений. Нередки различные проявления дыхательного дискомфорта, появление ощущения «нехватки воздуха».
Как правило, легочное кровотечение вызывает у больных чувство тревоги, страха, беспокойство. Отмечают слабость, головокружение, бледность кожного покрова. Уже при первом осмотре врач скорой помощи может составить представление об объеме кровопотери, что необходимо для принятия решения о дальнейшей тактике ведения пациента.
Появление ортостатической тахикардии (увеличение ЧСС при переходе из горизонтального положения в вертикальное на 20/мин и более) обычно соответствует потере 15% ОЦК. Снижение АД при переходе из горизонтального положения в вертикальное на 15 мм рт.ст. при сохраненном диурезе соответствует потере 20-25% ОЦК. Наличие артериальной гипотензии в положении лежа на спине и олигурии (мочи менее 400 мл/сут) предполагает потерю ОЦК от 30 до 40%. Коллапс (крайне низкое АД), нарушение сознания соответствуют потере более 40% ОЦК.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
При кровохарканье и легочном кровотечении легкой степени необходимо дифференцировать кровь из дыхательных путей от крови из носа или полости рта. Необходимо осмотреть полость рта, чтобы не пропустить участки десен, которые могут быть скрыты под зубными протезами.
Таблица 4-15. Особенности кровохарканья при разных причинах возникновения
| Причина | Основные клинические симптомы и некоторые диагностические критерии |
|---|---|
|
Бронхит острый и хронический |
Кровохарканье минимальное (прожилки крови в слизистой, гнойной мокроте). Причина — разрыв сосудов слизистой оболочки трахеи при сильном кашле |
|
Бронхоэктазы |
Хронический кашель с обильной гнойной мокротой. У 75% пациентов симптомы бронхоэктати-ческой болезни возникают в первые годы жизни после перенесенной пневмонии, кори, коклюша, гриппа с развитием обтурационного ателектаза сегмента или доли легкого. Повторные эпизоды кровохарканья в течение месяцев или лет могут быть единственным симптомом «сухих бронхоэктазов». Диагностика: КТ |
|
Туберкулез |
Постоянное «подкашливание», прожилки крови в гнойной мокроте, слабость, похудение, лихорадка, повышенная потливость ночью. Чаще кровохарканье встречается при фибринозно-кавернозном туберкулезе. Диагностика: проба Манту, выявление микобактерий туберкулеза в мазке мокроты и при посеве, рентгенография и КТ грудной клетки |
|
Пневмония |
Мокрота «ржавой» окраски у 75% пациентов с пневмонией, вызванной пневмококком. Кровохарканье часто сопровождает деструктивные пневмонии, вызванные бактериями рода Staphylococcus, Klebsiella (мокрота типа «смородинового желе»), Legionella или Pseudomonas. Диагностика: наличие очагово-инфильтративных изменений при рентгенографии грудной клетки в сочетании с клинической картиной инфекции нижних дыхательных путей (лихорадка, выраженный интоксикационный синдром, характерные физикальные признаки) |
|
Абсцесс легкого острый и хронический |
Гнойная мокрота (может быть темно-коричневого цвета) с прожилками крови, лихорадкой, болью в грудной клетке плеврального характера. Кровохарканье наблюдают у 11% больных с абсцессом легкого. Массивное кровотечение возникает у 5% больных |
|
Мицетома (аспергиллома) |
Любая грибковая инфекция легкого может вызвать кровохарканье. Наиболее частая причина — мицетома. В основе заболевания рост колоний Aspergillus fumigatus в старой туберкулезной каверне. Основной симптом — кровохарканье. Рентгенологически выявляют полость с шаровидным затемнением внутри и прослойкой воздуха в виде полумесяца |
|
Рак легкого (бронхогенный рак) |
Длительное выделение слизистой мокроты с прожилками крови, снижение массы тела. Кровохарканье чаще наблюдают при центральном раке, чем при периферическом. Диагностика: рентгенография и КТ легких, цитологическое исследование мокроты, бронхоскопия |
|
Аденома бронха |
Кашель и рецидивирующее кровохарканье у практически здоровых людей (преимущественно женщин 35-45 лет) |
|
Легочная гипертензия (митральный стеноз, первичная легочная гипертензия, синдром Эйзенменгера) |
Жалобы на одышку, кашель и кровохарканье после физической нагрузки. Причина кровохарканья — разрыв легочных вен или капилляров за счет повышенного давления в системе легочной артерии |
|
Отек легкого |
Пенистая, окрашенная кровью мокрота; выраженная одышка, сопутствующая сердечная патология |
|
Инфаркт легкого при эмболии легочной артерии |
Сгустки крови, не смешанные с мокротой, плевральные боли, одышка, повышение температуры. Факторы риска — тромбоз глубоких вен нижних конечностей и малого таза. Инфаркт легкого при ТЭЛА наблюдают в 19% случаев |
У больных с хроническими заболеваниями носоглотки возможен утренний кашель с выделением небольшого количества слизисто-гнойной мокроты с примесью крови. Кровохарканье может быть вызвано патологией гортани, например ее опухолью. Поэтому больным с кровохарканьем показана консультация отоларинголога. Изредка больные откашливают мокроту, которую по цвету можно принять за кровь. Например, при прорыве абсцесса легкого в бронх может выделяться мокрота темно-коричневого цвета.
При интенсивном легочном кровотечении кровь может быть проглочена, а затем выделиться при рвоте. В этих случаях отделяемое темное, почти черное. Для определения правильной тактики лечения следует дифференцировать легочное кровотечение с отделением крови из желудочно-кишечного тракта (табл. 4-16).
Советы позвонившему
Еще до прибытия скорой помощи позвонившему необходимо дать рекомендации, направленные на профилактику аспирации крови в интактные отделы легкого, усиления кровотечения, стабилизацию жизненно важных функций организма больного.
Действия до прибытия бригады СМП
-
Создайте условия для свободного дыхания больного (расстегните одежду, удалите зубные протезы).
-
Уложите больного на спину, приподнимите головной конец.
-
Обеспечьте устойчивое положение на боку при массивном кровотечении или потере сознания.
-
Постарайтесь успокоить больного, не разрешайте больному вставать.
-
Не давайте больному есть и пить.
-
Найдите ЛС, которые больной принимает, и покажите их врачу СМП.
-
Не оставляйте больного без присмотра.
ЛЕЧЕНИЕ
Скорая медицинская помощь на догоспитальном этапе
Действия на вызове направлены на то, чтобы выполнить первичную диагностику легочного кровотечения, оценить общее состояние больного и степень кровотечения. В зависимости от полученных данных принимают решение о дальнейшей тактике ведения пациента — лечебных мероприятиях и госпитализации.
При опросе больного необходимо выяснить следующее.
-
Длительность кровохарканья, его кратность, объем отделяемого, характер мокроты (прожилки, сгустки, алая кровь).
-
Условия возникновения кровохарканья (в покое, при физической нагрузке, во время кашля, после травмы грудной клетки и т.д.).
-
Предшествовал ли кровохарканью кашель (или сопровождается кашлем).
-
Наличие болевых или иных ощущений в грудной клетке, их локализация и характер (по типу стенокардии за грудиной или усиливаются при дыхании и кашле).
-
Наличие общих симптомов заболевания (лихорадка, потливость, тахикардия, слабость, одышка и др.).
-
Были ли ранее эпизоды кровохарканья, как давно и как часто они возникали. Чем они были вызваны и чем их купировали.
-
Наличие сопутствующих заболеваний (сердечнососудистых, болезней органов дыхания, туберкулеза, опухолей и др.).
Осмотр и физикальное обследование
-
Оценка общего состояния и жизненно важных функций больного (сознания, дыхания и кровообращения).
-
Оценка степени кровопотери (табл. 4-17).
-
Визуальный осмотр кожного покрова и видимых слизистых, включая полость рта и носоглотку.
-
Выполнение теста наполняемости капилляров или теста «белого пятна» для оценки капиллярной перфузии (нажать на ноготь пальца, кожу лба, мочку уха). В норме наполняемость капилляров (цвет кожи) восстанавливается через 2 с, при положительной пробе — через 3 с и более.
-
Оценка характера мокроты.
-
Исследование пульса, измерение ЧСС, АД, SaO2 методом пульсоксиметрии.
-
Аускультация сердца и легких.
Физикальное обследование выявляет возможную причину кровохарканья/легочного кровотечения, но может и не найти существенных отклонений от нормы.
Таблица 4-16. Дифференциальная диагностика легочного и желудочно-кишечного кровотечения
| Признак | Легочное кровотечение | Желудочно-кишечное кровотечение |
|---|---|---|
|
Выделение крови |
Кровь откашливается |
Кровь выделяется во время рвоты |
|
Цвет |
Алая, ярко-красная |
Темно-красная («кофейная гуща») за счет действия соляной кислоты |
|
рН выделений |
Щелочная реакция |
Кислая реакция |
|
Консистенция |
Пенистая, так как обычно смешивается с воздухом |
Крайне редко носит пенистый характер |
|
Мелена |
Не бывает даже при заглатывании части откашливаемой крови |
Как правило, бывает |
|
Анамнез |
Заболевания органов дыхания |
Язвенная болезнь, заболевания печени, предшествующие желудочно-кишечные кровотечения |
|
Длительность |
Кровохарканье обычно продолжается несколько часов или суток |
Рвота обычно кратковременная и обильная |
Таблица 4-17. Клинические симптомы при различной степени кровопотери
| Степень кровопотери | Клинические признаки | Объем кровопотери |
|---|---|---|
|
Легкая |
Легкая бледность |
До 10% ОЦК |
|
Средняя |
Минимальная тахикардия, снижение АД, признаки периферической вазоконстрикции (бледные, холодные конечности) |
11-20% ОЦК |
|
Тяжелая |
Тахикардия до 120 в минуту, АД ниже 90 мм рт.ст., беспокойство, холодный пот, бледность, одышка, олигурия |
21-30% ОЦК |
|
Массивная |
Тахикардия более 120 в минуту, АД — 60 мм рт.ст. и ниже (часто не определяется), ступор, резкая бледность, олигурия |
Более 30% ОЦК |
Лечение направлено на обеспечение проходимости дыхательных путей, поддержание витальных функций, проведение симптоматической терапии, замещение кровопотери (при необходимости). В дальнейшем принимают решение о характере госпитализации и транспортировки.
Лечебная тактика предусматривает следующие мероприятия.
-
Симптоматическая терапия при легком кровотечении.
-
Контроль показателей гемодинамики и сатурации крови, поддержание витальных функций.
-
Обеспечение адекватного положения пациента. При сохраненном сознании больному придают сидячее или полусидячее положение с наклоном в сторону пораженного легкого. При потере сознания, остановке кровообращения и/или дыхания проводят СЛР и транспортировку больного с опущенным головным концом.
-
Санация дыхательных путей.
-
Подача кислорода с большой скоростью (6-10 л/мин) через носовые канюли или лицевую маску.
-
Установка катетера в периферическую или центральную вену (при массивной кровопотере) и переливание кристаллоидных и коллоидных растворов (1000-3000 мл в зависимости от объема кровопотери): 0,9% раствор натрия хлорида, натрия хлорида раствор сложный [калия хлорид+кальция хлорид+натрия хлорид] (раствор Рингера♠), калия хлорид+магния хлорид+натрия ацетат+натрия глюконат+натрия хлорид (плазмалит 148♠), желатин (гелофузин♠), декстран [ср. мол. масса 50 000-70 000] (полиглюкин♠) и пр. Возможно внутривенное введение 100 мл (5 г) 5% раствора аминокапроновой кислоты, однако ее эффективность при профузном кровотечении невысока.
-
Устранение упорного и мучительного кашля — кодеин 0,015-0,02 г, гидрокодон фосфат♠ по 0,005 г, этилморфина гидрохлорид♠ или дионин♠ (внутрь по 0,01 г).
-
Применение транквилизаторов при эмоциональном возбуждении: фенобарбитал, мепротан♠ , триоксазин♠ , хлордиазепоксид, бромдигидрохлорфенилбензодиазепин (феназепам♠), диазепам, зуклопентиксол (клопиксол♠) и пр.
При любой степени легочного кровотечения пациентам показана госпитализация в ОСМПС для установления причины заболевания, назначения лечения и определения дальнейшей тактики ведения. Экстренная госпитализация не показана больным в стабильном состоянии с остановленным кровотечением.
Легочное кровотечение II степени — показание к срочной госпитализации в стационар с отделением торакальной хирургии и ОРИТ. Больные с кровотечение III степени подлежат немедленной госпитализации в отделение реанимации с экстренной интубацией и переводом на ИВЛ. Транспортировку пациентов проводят лежа на носилках с приподнятым ножным концом.
Скорая медицинская помощь на стационарном этапе
После госпитализации больных с кровохарканьем и легочным кровотечением в ОСМПС решают следующие задачи:
-
выяснение локализации и источника кровопотери;
-
обеспечение проходимости дыхательных путей;
-
проведение кровезаместительной и гемостатической терапии, борьба с анемией, профилактика развития осложнений, связанных с кровопотерей;
-
решение вопроса о дальнейшей тактике ведения пациента.
Диагностика легочного кровотечения на стационарном этапе
-
Опрос и физикальное обследование больного.
-
Клинико-лабораторные исследования: общий анализ крови (гематокрит, уровень гемоглобина, относительная плотность или вязкость крови, тромбоциты, эритроциты), электролиты, мочевина, креатинин, общий белок, АЛТ, АСТ, билирубин и его фракции, группа крови, резус-фактор, коагулограмма, КОС.
-
Определение степени кровопотери лабораторными расчетными и/или аппаратными электрофизиологическими импедансометрическими и/или индикаторными методами.
-
ЭКГ.
-
Рентгенографическое исследование органов грудной клетки, КТ (в положении лежа или сидя).
-
Осмотр оториноларинголога.
-
Сцинтиграфия легких (при подозрении на ТЭЛА).
-
Постоянный мониторинг ЧСС, АД, SaO2 (пульсоксиметрия).
-
Диагностическая бронхоскопия.
Лечебные мероприятия
-
Незамедлительная аспирация крови из верхних дыхательных путей через катетер.
-
Инфузионно-трансфузионная терапия (табл. 4-18-4-19) через периферическую или центральную вену.
Темп восполнения определяется величиной кровопотери: в начале лечения — струйно со скоростью до 250 мл/мин; после стабилизации АД на безопасном уровне — капельная инфузия. Клинические признаки уменьшения гиповолемии:
-
нормальный тургор кожи, глазных яблок;
-
отсутствие жажды (если больной в сознании);
-
влажный язык;
-
повышение АД;
-
уменьшение ЧСС;
-
потепление и «покраснение» кожного покрова;
-
увеличение пульсового давления;
-
ЦВД в пределах 4-7 см вод. ст.;
-
восстановление диуреза свыше 0,5 мл/кг в час.
Гемостатическую терапию назначают с учетом фазовых изменений в системе гемостаза, многокомпонентного характера коагулопатического синдрома и корригируют на основании мониторинга системы гемостаза, начиная с первых суток постгеморрагического периода.
Кровотечение само по себе приводит в активное состояние систему гемостаза, повышая свертываемость крови на начальных этапах. Именно поэтому при продолжающемся кровотечении (обычно начиная с легочного кровотечения IIб степени) или при нестабильном локальном гемостазе с высокой угрозой рецидива кровотечения показана комбинация факторов свертывания и антифибринолитиков.
На первом этапе характер нарушений свертывания помогают уточнить скрининговые тесты, отражающие состояние основных звеньев системы гемостаза: АЧТВ, протромбиновое время, фибриноген, плазминоген и D-димер. При диагностике нарушений в системе гемостаза следует проводить дифференцированное назначение гемостатических препаратов. Свежезамороженную плазму, содержащую все плазменные факторы, назначают, когда нет времени для проведения обследования пациента и выяснения причин, вызвавших кровотечение.
При всех степенях легочного кровотечения (включая легкую и средней тяжести) эффективно раннее введение рекомбинантного активированного фактора VII (эптаког альфа). Режим дозирования: от 1 до 3 инъекций в дозе 90 мкг/кг в течение 3 ч. Для поддержания эффекта может быть назначена еще 1 инъекция препарата в дозе 90 мкг/кг (либо однократная инъекция в дозе 270 мкг/кг).
Препараты выбора при легочных кровотечениях: десмопрессин (аналог антидиуретического гормона, стимулирующего высвобождение предшественника фактора Виллебранда и фактора VIII), фактора свертывания VIII (криопреципитат♠), препарат PPSB, содержащий четыре фактора (IX, X, VII, II), фактор свертывания крови IX, тромбоцитарная масса (переливают при тромбоцитопении менее 50х109/л).
При нарушениях в системе гемостаза: рекомендуют введение свежезамороженной плазмы (см. табл. 4-19). Для коррекции повышенного фибринолиза используют внутривенно капельно 5% раствор аминокапроновой кислоты в 0,9% растворе натрия хлорида (до 100 мл) или транексамовую кислоту в дозе 15 мг/кг каждые 6-8 ч (скорость введения 1 мл/мин). При фибринолитических кровотечениях также показан апротинин (гордокс♠, трасилол♠, контрикал♠) 100 000-200 000 КИЕ (калликреин-инактивирующая единица).
Таблица 4-18. Схема замещения кровопотери по П.Г. Брюсову (1998)
| Уровни кровезамещения | Величина кровопотери, % ОЦК | Общий объем трансфузий, % к величине кровопотери | Компоненты кровезамещения и их соотношение в общем объеме |
|---|---|---|---|
|
I |
До 10 |
200-300 |
Кристаллоиды (монотерапия или в сочетании с коллоидами в соотношении 0,7+0,3) |
|
II |
До 20 |
200 |
Коллоиды и кристаллоиды (0,5+0,5) |
|
III |
21-40 |
180 |
Эритроцитарная масса, альбумин, коллоиды и кристаллоиды (0,3+0,1+0,3+0,3) |
|
IV |
41-70 |
170 |
Эритроцитарная масса, плазма, коллоиды и кристаллоиды (0,4+0,1+0,25+0,25) |
|
V |
71-100 |
150 |
Эритроцитарная масса, альбумин (плазма), коллоиды и кристаллоиды (0,5+0,1+0,2+0,2) |
Кристаллоиды: 0,9% раствор натрия хлорида, натрия хлорида раствор сложный [калия хлорид+кальция хлорид+натрия хлорид] (раствор Рингера♠), нормосоль, натрия ацетат+натрия хлорид (дисоль♠) и др. Коллоидные растворы противошокового действия — природные (альбумин, плазма) и искусственные (растворы желатины, декстрана, гидроксиэтилкрахмала).
Таблица 4-19. Программа инфузионно-трансфузионной терапии с использованием гидроксиэтилкрахмалов (Fresenius AG D-16346 Bad Homburg v. d. H)
| Класс I (кровопотеря менее 750 мл) | Класс II (кровопотеря 750-1500 мл) | Класс III (кровопотеря 1500-2000 мл) | Класс IV (кровопотеря более 2000 мл) |
|---|---|---|---|
|
Инфузия 750 мл 6% или 500 мл 10% раствора гидроксиэтилкрахмала и 500 мл раствора Рингера♠ |
Инфузия 750-1000 мл 6% или 500 мл 10% раствора гидроксиэтилкрахмала и 500-1000 мл раствора Рингера♠ |
Инфузия 1500 мл 6% или 1000 мл 10% раствора гидроксиэтилкрахмала, 1000 мл раствора Рингера♠ и эритроцитарная масса |
Инфузия 1500 мл 6% или 1500 мл 10% раствора гидроксиэтилкрахмала, 1500 мл раствора Рингера♠ , эритроцитарная масса, свежезамороженная плазма и тромбоцитарная масса |
Примечание авт. Использование гидроксиэтилкрахмалов при острой кровопотере возможно при отсутствии у больных исходного нарушения или повышенного риска повреждения функции почек, коагулопатий, ожогов, септического шока.
Препарат блокирует калликреин-кининовую систему и подавляет как суммарную протеолитическую активность, так и активность отдельных протеолитических ферментов.
С целью стабилизации обменных процессов в клетке при значительном ухудшении гемодинамики показаны ГКК (преднизолон до 2-3 мг/кг или дексаметазон 0,15-0, 3 мг/кг).
Для уменьшения легочной гипертензии (в случае кровотечения из легочной артерии) используют 5-10 мл 2,4% раствора аминофиллина (эуфиллина♠) в 10-20 мл 40% декстрозы (глюкозы♠). Препарат вводят в вену в течение 4-6 мин.
Фармакологические средства позволяют остановить кровотечение у 80-90% больных.
Важным диагностическим и лечебным методом у больных с легочным кровотечением служит бронхоскопия. При проведении бронхоскопии возможны следующие вмешательства:
-
санационная бронхоскопия;
-
гемостатический бронхиальный лаваж;
-
окклюзия бронхов;
-
терапия лазерным излучением;
-
NO-терапия;
-
электрокоагуляция;
-
радиочастотная абляция.
Санационная бронхоскопия и гемостатический лаваж могут быть выполнены в условиях ОСМПС. Показания к бронхоскопии:
-
продолжающееся кровотечение при отсутствии эффекта от консервативной терапии;
-
рецидивирующее или осложненное легочное кровотечение (асфиксия, ателектаз) с нарастанием симптомов дыхательной недостаточности;
Через катетер, проведенный по биопсийному каналу бронхоскопа, вводят гемостатические растворы с одновременной аспирацией. Вначале отмывают бронхи, из которых поступала кровь, холодным изотоническим раствором натрия хлорида. Если в крупных бронхах источник кровотечения не определяется, проводят местный гемостаз 0,025% раствором адроксонаΨ или этамзилата (дицинона♠). Для снятия воспаления слизистой бронхов к препаратам добавляют 125 мг гидрокортизона. Смесь вводят в те сегментарные мелкие бронхи, из которых продолжается кровотечение.
Гемостаз может быть достигнут также введением в бронх катетера Фогэрти с раздувающим баллончиком на конце или тампонадой бронха поролоновой или гемостатической губкой. Обычно тампонирующий материал оставляют в бронхе на 24 ч; в дальнейшем удаляют под контролем фибробронхоскопа. Окклюзия бронха иногда окончательно останавливает кровотечение, а в случае показаний к операции дает возможность увеличить время подготовки к оперативному вмешательству.
При небольшом кровотечении санационную бронхоскопию выполняют через фибробронхоскоп (проводится под местной анестезией 10% раствором лидокаина), при массивном — жестким бронхоскопом (внутривенная анестезия с применением пропофола, барбитуратов, кетамина).
Во время санационной бронхоскопии контролируют оксигенацию крови, проводят ингаляцию кислорода.
После остановки кровотечения и стабилизации состояния пациента направляют в профильное стационарное отделение для лечения основного заболевания, приведшего к возникновению легочного кровотечения.
В случае нестабильности состояния пациента, продолжающемся легочном кровотечении или его рецидива больного госпитализируют в ОРИТ или хирургическое торакальное отделение, где проводится весь комплекс диагностических и лечебных мероприятий: искусственная управляемая артериальная гипотензия; коррекция факторов свертываемости крови и фибринолиза; эндобронхиальные и эндоваскулярные методы гемостаза; решается вопрос экстренного оперативного вмешательства.
Тампонада бронха обеспечивает возможность успешной транспортировки больного. При массивном кровотечении, локализация которого диагностирована, транспортировку осуществляют после экстренной эндобронхиальной интубации двухили однопросветной трубкой, вводимой в интактное легкое. При невозможности транспортировки пациента вызывают бригаду торакальных хирургов.
Часто встречающиеся ошибки
-
Применение кровоостанавливающих средств при легком кровохарканье.
-
Трансфузия растворов в одну периферическую вену вместо двух или центральной.
-
Длительные попытки пунктировать периферическую или центральную вену.
-
Недостаточные объем и скорость инфузии.
-
Отсутствие контроля за изменением концентрационных показателей крови и ЦВД в процессе лечения.
-
Ожидание результатов совместимости крови вместо восполнения дефицита ОЦК.
СПИСОК ЛИТЕРАТУРЫ
-
Гостищев В.К. Инфекции в торакальной хирургии: Руководство для врачей. — М.: Медицина, 2004. — 583 с.
-
Добровольский С.Р., Фишкова З.П., Шереметьева Г.Ф., Перельман М.И. Кровотечение как причина летальности в торакальной хирургии // Хирургия. — 1994. — № 3. — С. 40-43.
-
Овчинников А.А. Кровохарканье и легочное кровотечение // Мед. помощь. — 2005. — № 5. — С. 3-9.
-
Репин Ю.М. О методе остановки легочных кровотечений // Клин. мед. — 1991. — № 9. — С. 86-90.
-
Руководство скорой медицинской помощи / Под ред. С.Ф. Багненко, А.Л. Верткин, А.Г. Мирошниченко, М.Ш. Хубутия. — М.: ГЭОТАР-Медиа, 2007. — С. 816.
-
Слепушкин В.Д. Патофизиологические и фармакологические подходы к инфузионно-трансфузионной терапии острых кровотечений. — Ростов н/Д: ГОУ ВПО РостГМУ, 2008. — 160 с.
-
Уткин М.М., Киргинцев А.Г., Свиридов С.В., Сергеев И.Э. Тактика анестезиолога-реаниматолога при легочных кровотечениях // Вестн. интенсивной терапии. — 2004. — № 2. — С. 71-75.
-
Цеймах Е.А., Левин А.В., Зимонин П.Е. Легочные кровотечения. Этиология. Патогенез. Консервативная терапия. Эндоскопические методы // Пробл. Туберкулеза и болезней легких. — 2008. — № 7-8. — С. 3-9.
-
Черняховская Н.Е, Коржева И.Ю, Андреев В.Г. и др. Легочные кровотечения. — М.: МЕДпресс-информ, 2011. — 128 с.
-
Яковлев В.Н., Алексеев В.Г. Легочные кровотечения. — М.: МЕДпресс-информ, 2013. — 136 с.

Содержание
- Из чего состоит прибор
- Источник питания
- Подготовка к работе
- Режимы работы и параметры
- Режимы принудительной респираторной поддержки
- Режимы вспомогательно-принудительной поддержки
- Режимы вспомогательной вентиляции
- Подготовка пациента
- Уход и техническое обслуживание
Аппарат искусственной вентиляции легких протезирует функцию дыхания для людей, которые не могут дышать самостоятельно. Приборы ИВЛ устанавливаются в стационарах, машинах скорой помощи, а также дома.
Устройство подбирается на основании параметров респираторной поддержки, назначенной врачом. Основные параметры искусственной вентиляции легких – это скорость потока, концентрация кислорода, объем подаваемой воздушной смеси в минуту, давление воздушного потока.
Из чего состоит прибор
Сам прибор состоит из корпуса и системы шлангов, по которым подается воздушная смесь. Он бывает достаточно большим на колесиках, или компактным, пригодным для переноски. Некоторые портативные модели весят всего 1,5 кг.
Аппараты ИВЛ высокотехнологичны и пригодны для непрерывной эксплуатации. В некоторых случаях пациенты отделений реанимации находятся месяцами на непрерывной респираторной поддержке.
Любое устройство искусственной вентиляции легких состоит из блока управления и исполнительного блока.
-
Блоком управления называют переднюю часть устройства, где находится экран с кнопками управления. На экране отображаются параметры терапии, а также данные о состоянии человека. Это компьютерный модуль, который отвечает за управление устройством, мониторинг его работы, оповещения о неполадках и контроль состояния пациента
Система мониторинга работает благодаря датчикам, которые измеряют содержание кислорода и углекислого воздуха во вдыхаемом-выдыхаемом воздухе. Они контролируют объем подаваемой смеси, скорость потока, возможные утечки и многое другое.
Приборы, произведенные в недавнее время, оснащены большим информативным цветным дисплеем. Вид, а также количеством отображаемых параметров настраивается врачом или обслуживающим медицинским персоналом для каждого пациента индивидуально.
-
Исполнительный блок отвечает за выполнение команд, направленных блоком управления. Он состоит из разных модулей, в зависимости от модели или назначения аппарата. Возможный состав исполнительного блока:
-
Клапан вдоха-выдоха. Это электромеханическое устройство, которое управляет потоками воздуха в дыхательном контуре.
-
Газовая камера, где происходит смешивание и согревание воздуха для дыхания.
-
Устройство, регулирующее скорость подачи потока воздушной смеси.
-
Дыхательный контур с системой подогрева и увлажнения воздуха. Он состоит из двух соединенных между собой шлангов. С одной стороны дыхательный контур крепится к прибору, а с другой — к дыхательной гарнитуре человека.
-
Электромагнитный клапан выдоха, который выводит отработанные газы наружу или в специальное хранилище.
В случае необходимости ИВЛ-прибор подключается к источнику кислорода — газовому баллону, кислородному концентратору или центральной системе газоснабжения медицинского учреждения.
Источник питания
Устройства ИВЛ работают от постоянного или переменного тока. Включаются в розетку или прикуриватель автомобиля. Наличие аккумуляторной батареи обеспечивает бесперебойную работу в случае отключения электричества.
Подготовка к работе
Подключение и режимы работы рассмотрим на примере аппарата для неинвазивной вентиляции легких Hoffrichter CARAT II Pro, адаптированного для использования дома.
НВЛ аппарат Hoffrichter CARAT II Pro
Для включения прибора и старта вентиляции достаточно подключить аппарат Hoffrichter CARAT II Pro к электросети и присоединить дыхательный контур. Аппарат Hoffrichter CARAT II Pro работает с одно- и двухпатрубочными контурами с линией давления и без. В любой схеме может использоваться увлажнитель. Инструкция Hoffrichter CARAT II Pro дает подробные сведения о том, как присоединить дыхательный контур. Для целей терапии может потребоваться подключение источника кислорода через коннектор входящий в комплектацию устройства, и некоторых датчиков согласно назначения врача и руководства по эксплуатации ИВЛ. Перед первым использованием нужно настроить параметры работы.
Режимы работы и параметры
Все режимы работы делят на 3 большие группы – режимы принудительной вентиляции (T), режимы вспомогательной вентиляции (S) и гибридные режимы (S/T). Во всех группах возможны подрежимы настроек параметров терапии по объему и давлению. Рассмотрим подробнее.
Режимы принудительной респираторной поддержки
Такие режимы используют для пациентов, которые не могут дышать самостоятельно. Даже если человек совершает попытки дыхания, прибор никак на них не реагирует, продолжая выполнять заданную программу.
Группа режимов принудительной вентиляции делится на две подгруппы:
-
с контролем по объему,
-
с контролем по давлению.
Суть режимов с контролем по объему – это подача заданного объема в легкие на вдохе. Далее прибор переключается на выдох. Здесь еще может учитываться параметр времени. Тогда переключение происходит по истечении заданного времени инспирации.
В режимах контроля по давлению врач также задает объем вдоха в миллилитрах, количество вдохов в течение одной минуты, соотношение продолжительности вдоха к выдоху.
Такие режимы обозначаются латинской буквой V (volume – объем).
НИВЛ Hoffrichter CARAT II Pro имеет режимы с контролем по объему – VCV и aVCV.
У всех режимов множество особенностей, которые учитывает врач, назначая респираторную терапию.
Положительная сторона режимов с заданным объемом – это гарантированное поступление нужного объема в легкие человека. Однако есть опасность получения баротравмы при неверной настройке объема, неэффективная работа в случае блокировки бронхов, неравномерность вентиляции разных отделов легких.
Вторя группа режимов принудительной вентиляции – это режимы с контролем по давлению. Такие режимы имею латинскую букву P (pressure – давление) в названии. В аппарате НИВЛ Hoffrichter CARAT II Pro есть режим с контролем по давлению – PCV, а также автоматический режим — aPCV.
Как следует из названия, основной задаваемый параметр – это давление на вдохе. Также выставляется количество вдохов в единицу времени, соотношение вдоха к выдоху. Выдох происходит самопроизвольно.
Плюс этой группы режимов – это пониженная опасность травмы системы дыхания, более равномерная вентиляция, возможность использования при негерметичности дыхательных путей. Такой тип вентиляции не гарантирует поступление постоянного объема воздушной смеси в легкие. Он требует мониторинга нескольких дополнительных параметров, таких как: сатурация, количество углекислоты, объем дыхания.
Узнайте, есть ли сертификат и гарантии от производителя или продавца.
Режимы вспомогательно-принудительной поддержки
Это SIMV – синхронизированная принудительная перемежающаяся вентиляция. Она также бывает с контролем по объему и по давлению – V-SIMV или P-SIMV.
Смысл этой группы в том, что вентилятор работает в заданных параметрах до того момента, как человек пытается дышать самостоятельно. Благодаря различным триггерам, прибор понимает эти попытки, позволяя человеку самому сделать вдох. При отсутствии таких попыток или их нерегулярности, прибор возвращается в принудительный режим.
Эта группа режимов используется в период отлучения человека от устройства. Аппарат НИВЛ Hoffrichter CARAT II Pro имеет оба режима этой группы.
Режимы вспомогательной вентиляции
Вспомогательная вентиляция поддерживает естественное дыхание человека. Режимов вспомогательной респираторной поддержки очень много. У разных производителей они называются по-разному. В НИВЛ Hoffrichter CARAT II Pro – это PSV, PSV-S и CPAP.
Все режимы можно разделить на три группы:
-
с поддержкой по объему,
-
с поддержкой по давлению,
-
с постоянным положительным давлением.
Режимы с поддержкой по объему обозначаются как VSV. Они поставляют заданный объем кислорода в легкие, а потом переключаются на выдох.
Режимы с поддержкой по давлению – PSV подают воздушный поток с заданным значением давления. PSV используют при отлучении от аппарата, постепенно снижая показатель давления, стимулируя человека дышать самостоятельно.
Режим с постоянным положительным давлением бывает однофазным – CPAP и двухфазным – BiPAP. Он подает поток под постоянным положительным давлением одного или двух уровней в систему дыхания.
Подготовка пациента
Приборы ИВЛ доставляют кислород пациенту инвазивным или неинвазивным способом. Первый предполагает применение интубационной или трахеостомической трубки, второй – носовую канюлю или маску.
Выбор способа зависит от тяжести состояния пациента, длительности респираторной поддержки, особенностей строения лица, а также других параметров.
Как в экстренных, так и в плановых ситуациях врач принимает решение о необходимой гарнитуре. Если речь идет о маске, то ее выбор, особенно для длительного использования остается за пациентом. Как правило в комплекте с устройством поставляется носовая канюля – тонкая трубка, которая вставляется в носовые проходы. Носовую, ротоносовую или полнолицевую маску пациенты покупают отдельно.
Хорошо, если есть возможность примерить маску перед покупкой, чтобы выбрать самый удобный вариант. Человеку, использующему дыхательное оборудование, и его близким стоит помнить о том, что существует период привыкания к любой самой комфортной гарнитуре. Нужно искать другое решение, если от маски возникают синяки или пролежни, если дискомфорт не уходит после двух недель регулярного использования.
Инвазивная гарнитура устанавливается и заменяется только медицинским персоналом. Медики также обучают близких пациента, как пользоваться аппаратом ИВЛ.
Уход и техническое обслуживание
Начнем с правильной установки самого прибора. Важно сохранить для прибора возможность свободно забирать и выпускать воздух. Это значит, что отверстия, предназначенные для этого, должны быть свободны. Оптимальное место установки устройства дома – на тумбочке, столике или специальной стойке рядом с местом расположения человека. Прибор должен быть размещен вдали от штор, отопительных приборов, источников открытого огня.
При использовании аппарата ИВЛ вместе с концентратором кислорода или баллоном, нужно помнить о том, что кислород – это взрывоопасный газ. Важно избегать перегревания прибора или скопления статического электричества. Для этого поддерживать рекомендованный инструкцией уровень влажности в помещении.
Все приборы имеют систему сигнализаций, которая предупредит, если условия эксплуатации отличаются от допустимых. При этом стоит следить за тем, чтобы аппарат использовался и был установлен строго по инструкции.
Техническим обслуживанием устройства занимается дилер. «Медика Трейд» – официальный представитель многих торговых марок, обслуживает в течение года по гарантии все приобретенное оборудование. Гарантийный срок эксплуатации ИВЛ в часах указан в инструкции по эксплуатации ИВЛ-прибора.
Владелец самостоятельно следит за чистотой аппарата, своевременно меняет фильтры.
В инструкции содержатся правила эксплуатации ИВЛ, а также информация о рекомендуемом сроке замены расходных материалов. Подлежат регулярной замене и промывке фильтры грубой очистки, бактериальный фильтр, а также дыхательный контур и индивидуальная дыхательная гарнитура. Если прибор используют несколько пациентов, производители рекомендуют иметь отдельный контур для каждого человека.
Соблюдение инструкций по эксплуатации и обслуживанию устройств искусственной вентиляции легких — это ключевой аспект безопасности и эффективности использования данных устройств. Неправильная эксплуатация аппаратов ИВЛ создает риск для пациента и медицинского персонала. Важно следовать инструкциям по эксплуатации аппаратов ИВЛ от производителя, проводить регулярное техническое обслуживание и обучать персонал правильному использованию и уходу за оборудованием. Только при строгом соблюдении всех рекомендаций можно обеспечить безопасное и эффективное функционирование ИВЛ аппаратов.
Информация из статьи не предназначена для самолечения и самодиагностики. Обратитесь к врачу за медицинской помощью.
Чурсин В.В. Искусственная вентиляция легких (учебно-методическое пособие)
Категория:
КазМУНО (АГИУВ). Кафедра анестезиологии и реаниматологии
Информация
Искусственная вентиляция легких
(учебно-методическое пособие)
Чурсин В.В.
УДК 616.24:615.816
ББК 54.5 я73
Ч-93
Жакупов Р.К. – заведующий кафедрой анестезиологии-реаниматологии и скорой неотложной помощи АО КазМА, доктор медицинских наук, профессор.
Абдукаримов Х. Х. – заведующий отделением анестезиологии и реанимации Научного Центра проблем туберкулёза МЗ РК, доктор медицинских наук.
Джолдыбеков Т.С. –доцент кафедры общей хирургии, анестезиологии и реаниматологии КазНМУ им.Асфендиярова, кандидат медицинских наук, доцент.
Чурсин В.В.
Искусственная вентиляция лёгких: Учебно-методическое пособие.- Алматы.- 2008.-55 с.
ISBN 9965-874-64-6
Учебно-методическое пособие содержит информацию о физиологии системы дыхания и патфизиологии острой дыхательной недостаточности (ОДН) с позиции врача анестезиолога-реаниматолога. Представлены теоретические материалы об устройстве и принципе работы аппаратов для искусственной вентиляции лёгких (ИВЛ), методическом подходе к определению оптимальных режимов при респираторной поддержке у пациентов с ОДН.
Предназначается для студентов медвузов, врачей-курсантов ФПК и врачей анестезиологов-реаниматологов.
Утверждено и разрешено к печати решением рабочей комиссии учебно-методического объединения медвузов РК.
Протокол № 19 от 6 ноября 2008 г.
Физиология дыхания
Обмен газами между окружающей средой и клетками органов и тканей называется дыханием.
Дыхательные газы переносятся в организме посредством конвекционного и диффузионного транспорта. Для переноса веществ на сравнительно большие расстояния служат процессы конвекционного транспорта — легочная вентиляция и транспорт газов кровью.
Диффузионный транспорт служит для переноса газов лишь на короткие расстояния (менее 0,1 мм). При этом он играет важнейшую роль в переносе О2 и СО2 через альвеолярно-капиллярную мембрану в лёгких и через капиллярную стенку в тканях.
Перенос кислорода из окружающей среды в те части организма, где он поглощается клетками, происходит через ряд этапов в следующей последовательности:
1) конвекционный транспорт в альвеолы (вентиляция);
2) диффузия из альвеол в кровь легочных капилляров;
3) перенос кровью к капиллярам тканей;
4) диффузия из капилляров в окружающие ткани.
Первая и вторая стадии вместе называются легочным (внешним) дыханием. Третья стадия носит название транспорта газов кровью, а четвертая — тканевого (внутреннего) дыхания. Прежде чем поток вдыхаемого воздуха достигает альвеолярной мембраны, он проходит через воздухоносные пути, куда входят: нос, рот, глотка, трахея и бронхи (до уровня терминальных бронхиол), которые не участвуют в обмене О2 и СО2. Они доставляют вдыхаемый воздух к газообменивающим зонам (респираторные бронхиолы, альвеолярные ходы, альвеолярные мешочки и альвеолы).
Анатомия
Проводящие пути
Нос — первые изменения поступающего воздуха происходят в носу, где он очищается, согревается и увлажняется. Этому способствует волосяной фильтр, преддверие и раковины носа. Интенсивное кровоснабжение слизистой оболочки и пещеристых сплетений раковин обеспечивает быстрое согревание или охлаждение воздуха до температуры тела. Испаряющаяся со слизистой оболочки вода увлажняет воздух на 75-80%. Длительное вдыхание воздуха пониженной влажности приводит к высыханию слизистой оболочки, попаданию сухого воздуха в легкие, развитию ателектазов, пневмонии и повышению сопротивления в воздухоносных путях.
Глотка отделяет пищу от воздуха, регулирует давление в области среднего уха.
Гортань обеспечивает голосовую функцию, с помощью надгортанника предотвращая аспирацию, а смыкание голосовых связок является одним из основных компонентов кашля.
Трахея — основной воздуховод, в ней согревается и увлажняется воздух. Клетки слизистой оболочки захватывают инородные вещества, а реснички продвигают слизь вверх по трахее.
Бронхи (долевые и сегментарные) заканчиваются концевыми бронхиолами.
Гортань, трахея и бронхи также участвуют в очищении, согревании и увлажнении воздуха.
Строение стенки проводящих воздухоносных путей (ВП) отличается от структуры дыхательных путей газообменной зоны. Стенка проводящих воздухоносных путей состоит из слизистой оболочки, слоя гладких мышц, подслизистой соединительной и хрящевой оболочек. Эпителиальные клетки воздухоносных путей снабжены ресничками, которые, ритмично колеблясь, продвигают защитный слой слизи в направлении носоглотки. Слизистая оболочка ВП и легочная ткань содержат макрофаги, фагоцитирующие и переваривающие минеральные и бактериальные частицы. В норме слизь из дыхательных путей и альвеол постоянно удаляется. Слизистая оболочка ВП представлена реснитчатым псевдомногослойным эпителием, а также секреторными клетками, выделяющими слизь, иммуноглобулины, комплемент, лизоцим, ингибиторы, интерферон и другие вещества. В ресничках содержится много митохондрий, обеспечивающих энергией их высокую двигательную активность (около 1000 движений в 1 мин.), что позволяет транспортировать мокроту со скоростью до 1 см/мин в бронхах и до 3 см/мин в трахее. За сутки из трахеи и бронхов в норме эвакуируется около 100 мл мокроты, а при патологических состояниях до 100 мл/час.
Реснички функционируют в двойном слое слизи. В нижнем находятся биологически активные вещества, ферменты, иммуноглобулины, концентрация которых в 10 раз больше, чем в крови. Это обуславливает биологическую защитную функцию слизи. Верхний слой ее механически защищает реснички от повреждений. Утолщение или уменьшение верхнего слоя слизи при воспалении или токсическом воздействии неизбежно нарушает дренажную функцию реснитчатого эпителия, раздражает дыхательные пути и рефлекторно вызывает кашель. Чихание и кашель защищают легкие от проникновения минеральных и бактериальных частиц.
Альвеолы
В альвеолах происходит газообмен между кровью легочных капилляров и воздухом. Общее число альвеол равно примерно 300 млн., а суммарная площадь их поверхности — примерно 80 м2. Диаметр альвеол составляет 0,2-0,3 мм. Газообмен между альвеолярным воздухом и кровью осуществляется путем диффузии. Кровь легочных капилляров отделена от альвеолярного пространства лишь тонким слоем ткани — так называемой альвеолярно-капиллярной мембраной, образованной альвеолярным эпителием, узким интерстициальным пространством и эндотелием капилляра. Общая толщина этой мембраны не превышает 1 мкм. Вся альвеолярная поверхность легких покрыта тонкой пленкой, называемой сурфактантом.
Сурфактант уменьшает поверхностное натяжение на границе между жидкостью и воздухом в конце выдоха, когда объем легкого минимален, увеличивает эластичность легких и играет роль противоотечного фактора (не пропускает пары воды из альвеолярного воздуха), в результате чего альвеолы остаются сухими. Он снижает поверхностное натяжение при уменьшении объема альвеолы во время выдоха и предупреждает её спадение; уменьшает шунтирование, что улучшает оксигенацию артериальной крови при более низком давлении и минимальном содержании О2 во вдыхаемой смеси.
Сурфактантный слой состоит из:
1) собственно сурфактанта (микропленки из фосфолипидных или полипротеидных молекулярных комплексов на границе с воздушной средой);
2) гипофазы (глубжележащего гидрофильного слоя из белков, электролитов, связанной воды, фосфолипидов и полисахаридов);
3) клеточного компонента, представленного альвеолоцитами и альвеолярными макрофагами.
Основными химическими составляющими сурфактанта является липиды, белки и углеводы. Фосфолипиды (лецитин, пальмитиновая кислота, гепарин) составляют 80-90% его массы. Сурфактант покрывает непрерывным слоем и бронхиолы, понижает сопротивление при дыхании, поддерживает наполнение
при низком давлении растяжения, уменьшает действие сил, вызывающих накопление жидкости в тканях. Кроме того, сурфактант очищает вдыхаемые газы, отфильтровывает и улавливает вдыхаемые частицы, регулирует обмен воды между кровью и воздушной средой альвеолы, ускоряет диффузию СО2, обладает выраженным антиокислительным действием. Сурфактант очень чувствителен к различным эндо- и экзогенным факторам: нарушениям кровообращения, вентиляции и метаболизма, изменению РО2 во вдыхаемом воздухе, загрязнению его. При дефиците сурфактанта возникают ателектазы и РДС новорожденных. Примерно 90-95% альвеолярного сурфактанта повторно перерабатывается, очищается, накапливается и ресекретируется. Период полувыведения компонентов сурфактанта из просвета альвеол здоровых легких составляет около 20 ч.
Легочные объёмы
Вентиляция легких зависит от глубины дыхания и частоты дыхательных движений. Оба этих параметра могут варьировать в зависимости от потребностей организма. Есть ряд объемных показателей, характеризующих состояние легких. Нормальные средние значения для взрослого человека следующие:
1. Дыхательный объем (ДО- VT – Tidal Volume) — объем вдыхаемого и выдыхаемого воздуха при спокойном дыхании. Нормальные значения – 7-9мл/кг.
2. Резервный объем вдоха (РОвд – IRV – Inspiratory Reserve Volume) — объем, который может дополнительно поступить после спокойного вдоха, т.е. разница между нормальной и максимальной вентиляцией. Нормальное значение: 2-2,5 л (около 2/3 ЖЕЛ).
3. Резервный объем выдоха (РОвыд — ERV – Expiratory Reserve Volume) — объем, который можно дополнительно выдохнуть после спокойного выдоха, т.е. разница между нормальным и максимальным выдохом. Нормальное значение: 1,0-1,5 л (около 1/3 ЖЕЛ).
4.Остаточный объем (ОО – RV – Residal Volume) — объем, остающийся в легких после максимального выдоха. Около 1,5-2,0 л.
5. Жизненная емкость легких (ЖЕЛ – VT – Vital Capacity) — количество воздуха, которое может быть максимально выдохнуто после максимального вдоха. ЖЕЛ является показателем подвижности легких и грудной клетки. ЖЕЛ зависит от возраста, пола, размеров и положения тела, степени тренированности. Нормальные значения ЖЕЛ – 60-70 мл/кг — 3,5-5,5 л.
6. Резерв вдоха (РВ)—Ёмкость вдоха (Евд – IC – Inspiritory Capacity) — максимальное количество воздуха, которое может поступить в легкие после спокойного выдоха. Равен сумме ДО и РОвд.
7. Общая емкость легких (ОЕЛ – TLC – Total lung capacity) или максимальная емкость легких — количество воздуха, содержащееся в легких на высоте максимального вдоха. Состоит из ЖЕЛ и ОО и рассчитывается как сумма ЖЕЛ и ОО. Нормальное значение около 6,0 л.
Исследование структуры ОЕЛ является решающим в выяснении путей увеличения или снижения ЖЕЛ, что может иметь существенное практическое значение. Увеличение ЖЕЛ может быть расценено положительно только в том случаи, если ОЕЛ не меняется или увеличивается, но меньше, чем ЖЕЛ, что происходит при увеличении ЖЕЛ за счет уменьшения ОО. Если одновременно с увеличением ЖЕЛ происходит еще большее увеличение ОЕЛ, то это нельзя считать положительным фактором. При ЖЕЛ ниже 70% ОЕЛ функция внешнего дыхания глубоко нарушена. Обычно при патологических состояниях ОЕЛ и ЖЕЛ изменяются одинаково, за исключением обструктивной эмфиземы легких, когда ЖЕЛ, как правило, уменьшается, ОО увеличивается, а ОЕЛ может оставаться нормальной или быть выше нормы.
8. Функциональная остаточная емкость (ФОЕ – FRC – Functional residual volume) — количество воздуха, которое остается в легких после спокойного выдоха. Нормальные значения у взрослых — от 3 до 3,5 л. ФОЕ = ОО + РОвыд. По определению ФОЕ — объем газа, который остается в легких при спокойном выдохе и может быть мерой области газообмена. Она образуется в результате баланса между противоположно направленными эластическими силами легких и грудной клетки. Физиологическое значение ФОЕ состоит в частичном обновлении альвеолярного объема воздуха во время вдоха (вентилируемый объем) и указывает на объем альвеолярного воздуха, постоянно находящегося в легких. Со снижением ФОЕ связаны развитие ателектазов, закрытие мелких дыхательных путей, уменьшение податливости легких, увеличение альвеолярно-артериального различия по О2 в результате перфузии в ателектазированных участках легких, снижение вентиляционно-перфузионного соотношения. Обструктивные вентиляционные нарушения ведут к повышению ФОЕ, рестриктивные нарушения — к снижению ФОЕ.
Анатомическое и функциональное мертвое пространство
Анатомическим мертвым пространством называют объем воздухоносных путей, в котором не происходит газообмен. Это пространство включает носовую и ротовую полости, глотку, гортань, трахею, бронхи и бронхиолы. Объем мертвого пространства зависит от роста и положения тела. Приближенно можно считать, что у сидящего человека объем мертвого пространства (в миллилитрах) равен удвоенной массе тела (в килограммах). Таким образом, у взрослых он равен около 150-200 мл (2 мл/кг массы тела).
Под функциональным (физиологическим) мертвым пространством понимают все те участки дыхательной системы, в которых не происходит газообмена по причине сниженного или отсутствующего кровотока. К функциональному мертвому пространству в отличие от анатомического относятся не только воздухоносные пути, но также и те альвеолы, которые вентилируются, но не перфузируются кровью.
Альвеолярная вентиляция и вентиляция мертвого пространства
Часть минутного объема дыхания, достигающая альвеол, называется альвеолярной вентиляцией, остальная его часть составляет вентиляцию мертвого пространства. Альвеолярная вентиляция служит показателем эффективности дыхания в целом. Именно от этой величины зависит газовый состав, поддерживаемый в альвеолярном пространстве. Что касается минутного объема, то он лишь в незначительной степени отражает эффективность вентиляции легких. Так, если минутный объем дыхания нормальный (7л/мин), но дыхание частое и поверхностное (ДО-0,2 л, ЧД-35/мин), то вентилироваться
будет главным образом мертвое пространство, в которое воздух поступает раньше, чем в альвеолярное; в этом случае вдыхаемый воздух почти не будет достигать альвеол. Поскольку объем мертвого пространства постоянен, альвеолярная вентиляция тем больше, чем глубже дыхание и меньше частота.
Растяжимость (податливость) легочной ткани
Растяжимость легких является мерой эластической тяги, а также эластического сопротивления легочной ткани, которое преодолевается в процессе вдоха. Иначе говоря, растяжимость — это мера упругости легочной ткани, т. е. её податливость. Математически растяжимость выражается в виде частного от изменения объема легких и соответствующего изменения внутрилегочного давления.
Растяжимость может быть измерена отдельно для легких и для грудной клетки. С клинической точки зрения (особенно во время ИВЛ) наибольший интерес представляет именно податливость самой легочной ткани, отражающая степень рестриктивной легочной патологии. В современной литературе растяжимость легких принято обозначать термином «комплайнс» (от английского слова «compliance», сокращенно — С).
Податливость легких снижается:
• с возрастом (у пациентов старше 50 лет);
• в положении лежа (из-за давления органов брюшной полости на диафрагму);
• во время лапароскопических хирургических вмешательств в связи с карбоксиперитонеумом;
• при острой рестриктивной патологии (острые полисегментарные пневмонии, РДС, отёк легких, ателектазирование, аспирация и т. д.);
• при хронической рестриктивной патологии (хроническая пневмония, фиброз легких, коллагенозы, силикозы и т. д.);
• при патологии органов, которые окружают легкие (пневмо- или гидроторакс, высокое стояние купола диафрагмы при парезе кишечника и т.д.).
Чем хуже податливость лёгких, тем большее эластическое сопротивление легочной ткани надо преодолеть, чтобы достигнуть того дыхательного объема, что и при нормальной податливости. Следовательно, в случае ухудшающейся растяжимости лёгких при достижении того же дыхательного объема давление в дыхательных путях существенно возрастает.
Данное положение очень важно для понимания: при объемной ИВЛ, когда принудительный дыхательный объём подается больному с плохой податливостью легких (без высокого сопротивления дыхательных путей), существенный рост пикового давления в дыхательных путях и внутрилегочного давления значительно увеличивает риск баротравмы.
Сопротивление дыхательных путей
Поток дыхательной смеси в легких должен преодолеть не только эластическое сопротивление самой ткани, но и резистивное сопротивление дыхательных путей Raw (аббревиатура от английского слова «resistance»). Поскольку трахеобронхиальное дерево представляет собой систему трубок различной длины и ширины, то сопротивление газотоку в легких можно определить по известным физическим законам. В целом, сопротивление потоку зависит от градиента давлений в начале и в конце трубки, а также от величины самого потока.
Поток газа в легких может быть ламинарным, турбулентным и переходным. Для ламинарного потока характерно послойное поступательное движение газа с
различной скоростью: скорость потока наиболее высока в центре и постепенно снижается к стенкам. Ламинарный поток газа преобладает при относительно низких скоростях и описывается законом Пуазейля, в соответствии с которым сопротивление газотоку в наибольшей степени зависит от радиуса трубки (бронхов). Уменьшение радиуса в 2 раза приводит к возрастанию сопротивления в 16 раз. В связи с этим понятна важность выбора по возможности наиболее широкой эндотрахеальной (трахеостомической) трубки и поддержания проходимости трахеобронхиального дерева во время ИВЛ.
Сопротивление дыхательных путей газотоку значительно увеличивается при бронхиолоспазме, отеке слизистой оболочки бронхов, скоплении слизи и воспалительного секрета по причине сужения просвета бронхиального дерева. На сопротивление влияют также скорость потока и длина трубки (бронхов). С
увеличением скорости потока (форсирование вдоха или выдоха) сопротивление дыхательных путей увеличивается.
Основные причины увеличения сопротивления дыхательных путей:
• бронхиолоспазм;
• отек слизистой оболочки бронхов, (обострение бронхиальной астмы, бронхит, подсвязочный ларингит);
• инородное тело, аспирация, новообразования;
• скопление мокроты и воспалительного секрета;
• эмфизема (динамическая компрессия воздухоносных путей).
Турбулентный поток характеризуется хаотичным движением молекул газа вдоль трубки (бронхов). Он преобладает при высоких объемных скоростях потока. В случае турбулентного потока сопротивление дыхательных путей возрастает, так как при этом оно в еще большей степени зависит от скорости потока и радиуса бронхов. Турбулентное движение возникает при высоких потоках, резких изменениях скорости потока, в местах изгибов и разветвлений бронхов, при резком изменении диаметра бронхов. Вот почему турбулентный поток характерен для больных ХОЗЛ, когда даже в стадии ремиссии имеет место повышенное сопротивление дыхательных путей. Это же касается больных бронхиальной астмой.
Сопротивление воздухоносных путей распределено в легких неравномерно. Наибольшее сопротивление создают бронхи среднего калибра (до 5-7-й генерации), так как сопротивление крупных бронхов невелико из-за их большого диаметра, а мелких бронхов — вследствие значительной суммарной площади поперечного сечения.
Сопротивление дыхательных путей зависит также от объема легких. При большом объёме паренхима оказывает большее «растягивающее» действие на дыхательные пути, и их сопротивление уменьшается. Применение ПДКВ (PEEP) способствует увеличению объема легких и, следовательно, снижению сопротивления дыхательных путей.
Сопротивление дыхательных путей в норме составляет:
• у взрослых — 3-10 мм вод.ст./л/с;
• у детей — 15-20 мм вод.ст./л/с;
• у младенцев до 1 года — 20-30 мм вод.ст./л/с;
• у новорожденных — 30-50 мм вод.ст./л/с.
На выдохе сопротивление дыхательных путей на 2-4 мм вод.ст./л/с больше, чем на вдохе. Это связано с пассивным характером выдоха, когда состояние стенки воздухоносных путей в большей мере влияет на газоток, чем при активном вдохе. Поэтому для полноценного выдоха требуется в 2-3 раза больше времени, чем для вдоха. В норме соотношение времени вдох/выдох (I:E) составляет для взрослых около 1 : 1,5-2. Полноценность выдоха у больного во время ИВЛ можно оценить при помощи мониторинга экспираторной временной константы.
Работа дыхания совершается преимущественно инспираторными мышцами во время вдоха; выдох почти всегда пассивен. В то же время в случае, например, острого бронхоспазма или отека слизистой оболочки дыхательных путей выдох также становится активным, что значительно увеличивает общую работу внешней вентиляции.
Во время вдоха работа дыхания, в основном, тратится на преодоление эластического сопротивления легочной ткани и резистивного сопротивления дыхательных путей, при этом около 50 % затраченной энергии накапливается в упругих структурах легких. Во время выдоха эта накопленная потенциальная энергия высвобождается, что позволяет преодолевать экспираторное сопротивление дыхательных путей.
Увеличение сопротивления вдоху или выдоху компенсируется дополнительной работой дыхательных мышц. Работа дыхания возрастает при снижении растяжимости легких (рестриктивная патология), росте сопротивления дыхательных путей (обструктивная патология), тахипноэ (за счет вентиляции мертвого пространства).
На работу дыхательной мускулатуры в норме тратится только 2-3% от всего потребляемого организмом кислорода. Это, так называемая, «стоимость дыхания». При физической работе стоимость дыхания может достигать 10-15%. А при патологии (особенно рестриктивной) на работу дыхательных мышц может расходоваться более 30-40% от всего поглощаемого организмом кислорода. При тяжёлой диффузионной дыхательной недостаточности стоимость дыхания возрастает до 90%. С какого-то момента весь дополнительный кислород, получаемый за счет увеличения вентиляции, идет на покрытие соответствующего прироста работы дыхательных мышц. Вот почему на определенном этапе существенное увеличение работы дыхания является прямым показанием к началу ИВЛ, при которой стоимость дыхания уменьшается практически до 0.
Работа дыхания, которая требуется для преодоления эластического сопротивления (податливости легких), возрастает по мере увеличения дыхательного объема. Работа, необходимая для преодоления резистивного сопротивления дыхательных путей, возрастает при увеличении частоты дыхания. Пациент стремится уменьшить работу дыхания, меняя частоту дыхания и дыхательный объем в зависимости от преобладающей патологии. Для каждой ситуации существуют оптимальные частота дыхания и дыхательный объем, при которых работа дыхания минимальна. Так, для больных со сниженной растяжимостью, с точки зрения минимизации работы дыхания, подходит более частое и поверхностное дыхание (малоподатливые легкие трудно поддаются расправлению). С другой стороны, при увеличенном сопротивлении дыхательных путей оптимально глубокое и медленное дыхание. Это понятно: увеличение дыхательного объема позволяет «растянуть», расширить бронхи, уменьшить их сопротивление газотоку; с этой же целью больные с обструктивной патологией во время выдоха сжимают губы, создавая собственное «ПДКВ» (PEEP). Медленное и редкое дыхание способствует удлинению выдоха, что важно для более полного удаления выдыхаемой газовой смеси в условиях повышенного экспираторного сопротивления дыхательных путей.
Регуляция дыхания
Процесс дыхания регулируется центральной и периферической нервной системой. В ретикулярной формации головного мозга находится дыхательный центр, состоящий из центров вдоха, выдоха и пневмотаксиса.
Центральные хеморецепторы расположены в продолговатом мозге и возбуждаются при повышении концентрации Н+ и РСО2 в спинномозговой жидкости. В норме рН последней составляет 7,32, РСО2 — 50 мм.рт.ст., а содержание НСО3 — 24,5 ммоль/л. Даже небольшое снижение рН и рост РСО2 увеличивают вентиляцию легких. Эти рецепторы реагируют на гиперкапнию и ацидоз медленнее, чем периферические, так как требуется дополнительное время на измерение величины СО2, Н+ и НСО3 из-за преодоления гематоэнцефалического барьера. Сокращения дыхательных мышц контролирует центральный дыхательный механизм, состоящий из группы клеток продолговатого мозга, моста, а также пневмотаксических центров. Они тонизируют дыхательный центр и по импульсации из механорецепторов определяют порог возбуждения, при котором прекращается вдох. Пневмотаксические клетки также переключают вдох на выдох.
Периферические хеморецепторы, расположенные на внутренних оболочках сонного синуса, дуги аорты, левого предсердия, контролируют гуморальные параметры (РО2, РСО2 в артериальной крови и спинномозговой жидкости) и немедленно реагируют на изменения внутренней среды организма, меняя режим самостоятельного дыхания и, таким образом, корригируя рН, РО2 и РСО2 в артериальной крови и спинномозговой жидкости. Импульсы из хеморецепторов регулируют объем вентиляции, необходимый для поддержания определенного уровня метаболизма. В оптимизации режима вентиляции, т.е. установлении частоты и глубины дыхания, длительности вдоха и выдоха, силы сокращения дыхательных мышц при данном уровне вентиляции, участвуют и механорецепторы. Вентиляция легких определяется уровнем метаболизма, воздействием продуктов обмена веществ и О2 на хеморецепторы, которые трансформируют их в афферентную импульсацию нервных структур центрального дыхательного механизма. Основная функция артериальных хеморецепторов — немедленная коррекция дыхания в ответ на изменения газового состава крови.
Периферические механорецепторы, локализующиеся в стенках альвеол, межреберных мышцах и диафрагме, реагируют на растяжение структур, в которых они находятся, на информацию о механических явлениях. Главную роль играют механорецепторы легких. Вдыхаемый воздух поступает по ВП к альвеолам и участвует в газообмене на уровне альвеолярно-капиллярной мембраны. По мере растяжения стенок альвеол во время вдоха механорецепторы возбуждаются и посылают афферентный сигнал в дыхательный центр, который тормозит вдох (рефлекс Геринга-Брейера).
При обычном дыхании межреберно-диафрагмальные механорецепторы не возбуждаются и имеют вспомогательное значение.
Система регуляции завершается нейронами, интегрирующими импульсы, которые поступают к ним от хеморецепторов, и посылающими импульсы возбуждения к дыхательным мотонейронам. Клетки бульбарного дыхательного центра посылают как возбуждающие, так и тормозящие импульсы к дыхательным мышцам. Координированное возбуждение респираторных мотонейронов приводит к синхронному сокращению дыхательных мышц.
Дыхательные движения, создающие воздушный поток, происходят благодаря согласованной работе всех дыхательных мышц. Нервные клетки двигательных
нейронов дыхательных мышц расположены в передних рогах серого вещества спинного мозга (шейные и грудные сегменты).
У человека в регуляции дыхания принимает участие и кора большого мозга в пределах, допускаемых хеморецепторной регуляцией дыхания. Так, например, волевая задержка дыхания ограничена временем, в течение которого РаО2 в спинномозговой жидкости повышается до уровней, возбуждающих артериальные и медуллярные рецепторы.
Вентиляция легких происходит за счет периодических изменений работыдыхательных мышц, объема грудной полости и легких. Основными мышцами вдоха являются диафрагма и наружные межреберные мышцы. Во время их сокращения происходят уплощение купола диафрагмы и приподнятие ребер кверху, в результате объем грудной клетки увеличивается, растет отрицательное внутриплевральное давление (Ppl). Перед началом вдоха (в конце выдоха) Ppl приблизительно составляет минус 3-5 см вод.ст. Альвеолярное давление (Palv) принимается за 0 (т. е. равно атмосферному), оно же отражает давление в дыхательных путях и коррелирует с внутригрудным давлением.
Градиент между альвеолярным и внутриплевральным давлением называется транспульмонарным давлением (Ptp). В конце выдоха оно составляет 3-5 см вод.ст. Во время спонтанного вдоха рост отрицательного Ppl (до минус 6-10 см вод.ст.) вызывает снижение давления в альвеолах и дыхательных путях ниже атмосферного. В альвеолах давление снижается до минус 3-5 см вод.ст. За счёт разницы давлений воздух поступает (засасывается) из внешней среды в легкие. Грудная клетка и диафрагма действуют как поршневой насос, втягивающий воздух в легкие. Такое «присасывающее» действие грудной клетки важно не только для вентиляции, но и для кровообращения. Во время спонтанного вдоха происходят дополнительное «присасывание» крови к сердцу (поддержание преднагрузки) и активизация легочного кровотока из правого желудочка по системе легочной артерии. В конце вдоха, когда движение газа прекращается, альвеолярное давление возвращается к нулю, но внутриплевральное давление остается сниженным до минус 6-10 см вод.ст.
Выдох в норме является процессом пассивным. После расслабления дыхательных мышц силы эластической тяги грудной клетки и легких вызывают удаление (выдавливание) газа из легких и восстановление первоначального объема легких. В случае нарушения проходимости трахеобронхиального дерева (воспалительный секрет, отек слизистой оболочки, бронхоспазм) процесс выдоха затруднен, и в акте дыхания начинают принимать участие также мышцы выдоха (внутренние межреберные мышцы, грудные мышцы, мышцы брюшного пресса и т. д.). При истощении экспираторных мышц процесс выдоха еще более затрудняется, происходит задержка выдыхаемой смеси и динамическое перераздувание легких.
Таким образом, при спонтанном дыхании первична экскурсия грудной клетки, а газообмен в альвеолах – вторичен и является результатом этой экскурсии.
Недыхательные функции легких
Функции легких не ограничиваются диффузией газов. В них содержится 50% всех эндотелиальных клеток организма, которые выстилают капиллярную поверхность мембраны и участвуют в метаболизме и инактивации биологически активных веществ, проходящих через легкие.
1. Легкие контролируют общую гемодинамику путем различного заполнения собственного сосудистого русла и влияния на биологически активные вещества, регулирующие сосудистый тонус (серотонин, гистамин, брадикинин, катехоламины), превращением ангиотензина I в ангиотензин II, участием в метаболизме простагландинов.
2. Легкие регулируют свертывание крови, секретируя простациклин — ингибитор агрегации тромбоцитов, и удаляя из кровотока тромбопластин, фибрин и продукты его деградации. В результате этого оттекающая от легких кровь имеет более высокую фибринолитическую активность.
3. Легкие участвуют в белковом, углеводном и жировом обмене, синтезируя фосфолипиды (фосфатидилхолин и фосфатидилглицерол — основные компоненты сурфактанта).
4. Легкие продуцируют и элиминируют тепло, поддерживая энергетический баланс организма.
5. Легкие очищают кровь от механических примесей. Агрегаты клеток, микротромбы, бактерии, пузырьки воздуха, капли жира задерживаются легкими и подвергаются деструкции и метаболизму.
Типы вентиляции и виды нарушений вентиляции
Разработана физиологически четкая классификация типов вентиляции, в основу которой положены парциальные давления газов в альвеолах. В соответствии с этой классификацией выделяются следующие типы вентиляции:
1.Нормовентиляция — нормальная вентиляция, при которой парциальное давление СО2 в альвеолах поддерживается на уровне около 40 мм.рт.ст.
2.Гипервентиляция — усиленная вентиляция, превышающаяметаболические потребности организма (РаСО2<40 мм.рт.ст.).
3.Гиповентиляция — сниженная вентиляция по сравнению с метаболическими потребностями организма (РаСО2>40 мм.рт.ст.).
4. Повышенная вентиляция — любое увеличение альвеолярной вентиляции по сравнению с уровнем покоя, независимо от парциального давления газов в альвеолах (например, при мышечной работе).
5.Эупноэ — нормальная вентиляция в покое, сопровождающаяся субъективным чувством комфорта.
6.Гиперпноэ — увеличение глубины дыхания независимо от того, повышена ли при этом частота дыхательных движений или нет.
7.Тахипноэ — увеличение частоты дыхания.
8.Брадипноэ — снижение частоты дыхания.
9.Апноэ — остановка дыхания, обусловленная, главным образом, отсутствием физиологической стимуляции дыхательного центра (уменьшение напряжения СО2, в артериальной крови).
10.Диспноэ (одышка) — неприятное субъективное ощущение недостаточности дыхания или затрудненного дыхания.
11.Ортопноэ — выраженная одышка, связанная с застоем крови в легочных капиллярах в результате недостаточности левого сердца. В горизонтальном положении это состояние усугубляется, и поэтому лежать таким больным тяжело.
12.Асфиксия — остановка или угнетение дыхания, связанные, главным образом, с параличом дыхательных центров или закрытием дыхательных путей. Газообмен при этом резко нарушен (наблюдается гипоксия и гиперкапния).
В целях диагностики целесообразно различать два типа нарушений вентиляции — рестриктивный и обструктивный.
К рестриктивному типу нарушений вентиляции относятся все патологические состояния, при которых снижаются дыхательная экскурсия и способность легких расправляться, т.е. уменьшается их растяжимость. Такие нарушения наблюдаются, например, при поражениях легочной паренхимы (пневмонии, отёк лёгких, фиброз лёгких) или при плевральных спайках.
Обструктивный тип нарушений вентиляции обусловлен сужением воздухоносных путей, т.е. повышением их аэродинамического сопротивления. Подобные состояния встречаются, например, при накоплении в дыхательных путях слизи, набухании их слизистой оболочки или спазме бронхиальных мышц (аллергический бронхиолоспазм, бронхиальная астма, астмоидный бронхит и т.д.). У таких больных сопротивление вдоху и выдоху повышено, и поэтому со временем воздушность легких и ФОЕ у них увеличиваются. Патологическое состояние, характеризующееся чрезмерным уменьшением числа эластических волокон(исчезновением альвеолярных перегородок, объединением капиллярной сети), называется эмфиземой легких.
Острая дыхательная недостаточность
Общепринятого определения понятия «острая дыхательная недостаточность» (ОДН) до сих пор не существует, хотя и серьезных разногласий между специалистами в понимании самой сути этого синдрома также не наблюдается. В основе ОДН лежит остро развивающееся несоответствие уровня газообмена (внешнего дыхания) метаболическим потребностям организма.
Следует чётко определить что:
— ОДН — это синдром, являющийся следствием различных заболеваний, клинических (например, во время наркоза или эпидуральной анестезии) и неклинических (например — высокогорье) ситуаций.
— Следствием развития и прогрессирования ОДН является гипоксия — гипоксемия. В соответствии с классификацией гипоксий (таблица 1), ОДН является причиной гипоксической гипоксии.
Таблица 1 – Виды гипоксий
| Вид гипоксии | Причины |
| Гипоксическая гипоксия |
Развивается вследствие низкой концентрации кислорода во вдыхаемой смеси, обструкции дыхательных путей, нарушения биомеханики дыхания, диффузионной блокады. |
| Гемическая гипоксия |
Следствие снижения кислородной ёмкости крови при анемии, блокаде гемоглобина при отравлениях. |
| Циркуляторная гипоксия |
Следствие тяжёлых нарушений кровообращения. |
|
Гистотоксическая гипоксия |
Развивается при нарушениях утилизации кислорода при блокаде дыхательных ферментов. |
ОДН не обязательно проявляется серьезными изменениями газового состава крови (гипоксемией и/или гиперкапнией), как отмечается в ряде определений. Некоторое время относительно «нормальный» газовый состав поддерживается за счет напряженной работы системы внешнего дыхания, в частности дыхательных мышц. Понимание данного факта очень важно, так как позволяет своевременно начать интенсивную респираторную терапию (например — ИВЛ), не дожидаясь истощения компенсаторных механизмов внешней вентиляции, истощения дыхательных мышц.
Классификация ОДН
В соответствии с вышеизложенным (с позиции оказания экстренной помощи), в первую очередь нужно классифицировать ОДН по тяжести.
Наиболее удобно в реаниматологии классифицировать все синдромы, связанные с органной недостаточностью (точнее – с функциональной недостаточностью того или иного органа) по степени компенсации – способности выполнять свои функции. Любую недостаточность можно разделить на компенсированную, субкомпенсированную и некомпенсированную.
Взяв для аналогии классификации Дембо А.Г. (1957), Rossier (1956), Малышева В.Д. (1989) можно разделить ОДН на:
— Компенсированную, когда при умеренном напряжении функции дыхания поддерживается нормальный газовый состав крови и удовлетворяются метаболические потребности организма. Клинически в состоянии покоя ЧДД до 30 в мин, газы крови и КЩС в норме, ЖЕЛ снижено до 30-60 мл/кг. По Дембо — 1 вид, по Rossier – латентная, по Малышеву — I стадия. Сюда же можно отнести и состояния, при которых повышается потребность организма в кислороде в покое, хотя правильнее это состояние называть «компенсаторная ОДН».
— Субкомпенсированную, когда при выраженном напряжении функции дыхания поддерживается нормальный газовый состав крови и уже не полностью удовлетворяются метаболические потребности организма. Клинически в состоянии покоя ЧДД более 30 в мин, газы крови – РаО2 в норме или несколько снижено, РаСО2 может быть снижено, КЩС – метаболический ацидоз, ЖЕЛ менее 30 мл/кг. По Дембо — 2 вид, по Rossier – парциальная, по Малышеву — II стадия.
— Некомпенсированную, когда при выраженных нарушениях механики дыхания не поддерживается нормальный газовый состав крови и уже абсолютно не удовлетворяются метаболические потребности организма. Клинически в состоянии покоя ЧДД более 35 в мин или брадипноэ (< 10 в минуту), или патологическое дыхание, газы крови – РаО2 снижено, РаСО2 повышено, но может быть и снижено, КЩС – выраженный метаболический ацидоз (может быть в сочетании с дыхательным), ЖЕЛ менее 30 мл/кг. По Дембо — 3 вид, по Rossier – глобальная, по Малышеву — III-IV стадия.
Принципиальный вопрос, касающийся данной классификации – когда нужно переводить больных на ИВЛ? Если врач встретился с больным в период декомпенсации – перевод на ИВЛ однозначно показан, и сделать это нужно как можно быстрее.
Если имеет место субкомпенсация, то принимать решение о переводе на ИВЛ врачу сложнее – газы крови ещё в норме. Однако отсрочить интубацию можно только в том случае, если врач точно знает причину ОДН и уверен, что сможет быстро с ней справиться. Клинические примеры – аллергический бронхиолоспазм, нетяжёлый статус при бронхиальной астме, стенокардия и т.д.
В период компенсации больного нужно переводить на ИВЛ, если врач знает причину ОДН, предполагающую длительное лечение, например при ЧМТ или инсульте. Другой вариант – врач не знает основное заболевание и причину развития ОДН, и имеют место признаки другой органной недостаточности (сердечно-сосудистой, почечно-печёночной и т.д.). В этом случае перевод на ИВЛ даёт врачу время для диагностики с уверенностью, что возможное нарастание степени ОДН не усугубит состояние больного.
Безусловно, есть необходимость в классификации ОДН и по причине её развития. Это помогает понять суть различных видов ОДН, их патофизиологическую основу. Из понимания этиопатогенеза логически вытекают основные принципы патогенетической интенсивной терапии того или иного вида ОДН. В связи с этим, нам представляется целесообразным разделить виды ОДН именно по этиопатогенетическому принципу и привести классификацию, модифицированную Сатишур О.Е. (2006) на основании данных различных литературных источников.
Связана с угнетением, возбуждением либо дискоординацией работы дыхательного центра:
• Угнетение дыхательного центра в результате действия лекарственных препаратов (опиоиды, снотворные, седативные и т. д.); нарушения мозгового кровообращения, тяжелой черепно-мозговой травмы, острых нейроинфекций, опухоли головного мозга, повреждения ствола головного мозга. Для тяжелой центральной ОДН, связанной с угнетением дыхательного центра, характерна клиническая триада: нарушение сознания, брадипноэ, тенденция к поверхностному дыханию и апноэ.
• Перевозбуждение дыхательного центра (энцефалопатическая гипервентиляция) может развиться в результате черепно-мозговой травмы, отека мозга, повреждения гипоталамуса, хронической нейроинфекции и т. д. Энцефалопатическая гипервентиляция приводит к чрезмерной работе дыхательных мышц, вызывая их истощение, дыхательный алкалоз, гипокапнию и т. д.
• Дискоординация дыхательного центра вызывает патологические ритмы дыхания и чаще всего является следствием вторичного метаболического поражения головного мозга. В качестве примеров можно назвать диабетические комы, энцефалопатию при эндогенной интоксикации (почечной или печеночной недостаточности) и т.д.
С точки зрения клинической значимости именно угнетение системы центральной регуляции дыхания является классическим примером центральной ОДН. Быстро развивающаяся альвеолярная гиповентиляция приводит к выраженной гипоксемии и реально угрожает жизни, если не предпринять срочных мер интенсивной терапии (ИВЛ). Поэтому, говоря о центральном характере ОДН, в основном понимают именно угнетение дыхательного центра. Расстройства центральной регуляции дыхания в клинической практике почти никогда не бывают изолированными. К ним, как правило, присоединяются нарушения проходимости верхних дыхательных путей (западение корня языка, скопление мокроты из-за угнетения кашлевого рефлекса), аспирация и т. д.
Связана с нарушением передачи нервного импульса от дыхательного центра к респираторным мышцам либо с собственно патологией дыхательных мышц:
• Патология проведения импульса по нейропроводящей системе.
Возникает при травмах и заболеваниях спинного мозга (особенно шейного отдела) иотводящих нервов: травматическом пересечении, опухолях, ишемизации, воспалении бактериально-вирусной природы, боковом амиотрофическом склерозе. То же относится к периферическим отводящим нервам, связанным с дыхательными мышцами — травмы, демиелинизация, полиомиелит, полинейропатия (синдром Гийена-Барре). Особое место занимает повреждение п. phrenicus, иннервирующего диафрагму: развивающаяся вторичная слабость диафрагмы, как основной дыхательной мышцы, вызывает прогрессирующую нейромы-мышечную ОДН.
• Патология проведения импульса в нейромышечном соединении (синапсе). Развивается при аутоиммунном повреждении синаптического медиаторного проведения (миастения), интоксикационно-токсическом поражении синапса и медиаторов (ботулизм, столбняк, отравление ФОС) илиего медикаментозном угнетении (миорелаксанты).
• Патология сократимости дыхательных мышц. Самые различные причины способны привести к слабости собственно дыхательных мышц. К ним относятся различные неспецифические миопатии, миодистрофия, коллагенозы, общее истощение (кахексия). Тяжелые водно-электролитные нарушения(особенно гипокалиемия и гипомагниемия) также способствуют развитию слабости дыхательных мышц. Отдельно стоит отметить атрофию дыхательных мышц, развивающуюся при длительной ИВЛ в случае применения глубокой седации и/или миорелаксантов, что значительно затрудняет последующее «отучение» от ИВЛ. Истощение дыхательных мышц вследствие большой работы дыхания также, на определенном этапе, усугубляет течение ОДН.
Центральную и нейромышечную ОДН еще принято относить к так называемой вентиляционной, или гипоксически-гиперкапнической дыхательной недостаточности. Этим самым подчеркивается нарушение самого механического процесса внешней вентиляции. При этих формах быстро развивается выраженная альвеолярная гиповентиляция, резко снижается минутный объем дыхания, поэтому гипоксемия и гиперкапния прогрессируют одновременно, что характерно именно для вентиляционной ОДН. Выраженная вентиляционная ОДН является прямым показанием к экстренной ИВЛ (!) еще до выяснения причин ОДН и начала специфической терапии (если исключен напряженный пневмоторакс).
Связана с нарушением целостности каркаса грудной клетки, повреждением диафрагмы, острым нарушением распределения дыхательной смеси при сдавлении или коллабировании легкого, а также с болевым синдромом и высоким стоянием купола диафрагмы:
• Нарушение целостности и подвижности грудного каркаса. Возникает при множественных переломах ребер, грудины, травматическом разрыве диафрагмы. Механизм развития ОДН при этом связан с несколькими факторами. Во-первых, значительно затруднено создание необходимого отрицательного давления в плевральной полости. Данное обстоятельство обусловлено излишней парадоксальной подвижностью поврежденных ребер и/или грудины, недостаточной жесткостью грудной стенки как опоры париетальной плевры. Во-вторых, мощный болевой фактор искусственно ограничивает необходимое расправление грудной клетки. В-третьих, травматическое повреждение диафрагмы переносит основную работу по внешней вентиляции на межреберные мышцы, которые не всегда справляются с повышенной нагрузкой.
• Сдавление и/или коллабирование легочной ткани. Развивается при открытом или напряженном (клапанном) пневмотораксе, прогрессирующем гидротораксе и гемотораксе. С точки зрения выраженности ОДН наиболее опасен напряженный (клапанный) пневмоторакс, при котором с каждым вдохом в плевральной полости накапливается все больше воздуха, растет внутриплевральное положительное давление, полностью коллабируется легкое на стороне поражения, средостение смещается в здоровую сторону, затем наступает сдавление сердца и крупных сосудов и развивается гемодинамическая несостоятельность вплоть до остановки сердечной деятельности. Даже подозрение на развитие клапанного пневмоторакса является показанием к немедленному дренированию плевральной полости. До дренирования ИВЛ начинать нельзя, так как она может усугубить сдавление органов средостения вследствие принудительного поступления дыхательной смеси в плевральную полость на стороне поражения и еще большему сдавлению легких и сердца.
• Высокое стояние купола диафрагмы. Имеет место при ожирении, парезе кишечника, асците. Экскурсии диафрагмы значительно ограничиваются, происходят нарушение расправления легочной ткани, уменьшение газообменной зоны легких, ателектазирование, развивается гипоксемия.
Особой разновидностью торакодиафрагмальной ОДН является ограничение подвижности грудной клетки, связанное с мощным болевым фактором (ранний послеоперационный период после вмешательства на органах грудной или брюшной полости, перелом ребер и т. д). В случае некупированного болевого синдрома резко сокращается амплитуда экскурсий грудной клетки, что способствует развитию недостаточной альвеолярной вентиляции, ателектазированию, гипоксемии, нарушению элиминации СО2 и т.д. Торакодиафрагмальная ОДН может сразу сопровождаться выраженными нарушениями самой механики внешней вентиляции (как, например, при множественном переломе ребер, грудины, полном разрыве диафрагмы). В этом случае ОДН изначально носит вентиляционный характер, сразу сопровождается гиперкапнией и гипоксемией. В другой ситуации (гидро-, гемо-, пневмоторакс, метеоризм) элиминация С02 поддерживается компенсаторными механизмами, сохраняется нормокарбия, что, однако, не должно вводить в заблуждение при оценке тяжести торакодиафрагмальной ОДН.
Обструктивная ОДН
Как следует из названия, обструктивная ОДН связана с острым нарушением проходимости дыхательных путей на том или ином уровне. Это один из наиболее часто встречающихся и в то же время самых опасных видов ОДН. Самые различные причины могут привести к обструкции верхних или нижних дыхательных путей:
• западение корня языка, блокада гортани желудочным содержимым, наличие инородного тела в области гортани (трахеи), главных бронхов, гематома, опухоль и т. д.;
• травматическая обструкция верхних дыхательных путей;
• воспалительный отек голосовых связок, подсвязочный ларингит, скопление мокроты, воспалительного секрета при нарушении дренажной функции бронхов (блокада кашлевого рефлекса, повреждение системы мукоцилиарного очищения);
• острый бронхоспазм и бронхорея, отек слизистой оболочки крупных бронхов при бронхиальной астме или обострении ХОЗЛ;
• раннее экспираторное закрытие мелких дыхательных путей.
Вне зависимости от причины, обструктивная патология вызывает резкое увеличение сопротивления дыхательных путей. Нарастающее бронхиальное сопротивление приводит к усилению регионарной неравномерности вентиляции легких и увеличению шунтирования неоксигенированной крови. Кроме того, высокое сопротивление дыхательных путей увеличивает работу дыхания, его энергетическую и кислородную цену, что приводит к истощению компенсаторных механизмов — возникает опасная гипоксемия, к которой затем присоединяется гиперкапния.
Связана с тяжелым и острым нарушением растяжимости (податливости) легочной ткани, ателектазированием, блокадой альвеолокапиллярной мембраны. К основным этиологическим причинам рестриктивной ОДН можно отнести:
• полисегментарная пневмония; фиброзные процессы в результате хронического неспецифического воспалительного процесса в легких; необтурационные ателектазы;
• респираторный дистресс-синдром взрослых ОРДС (РДСВ), синдром Мендельсона;
• кардиогенный и некардиогенный отек легких;
• тяжелые гестозы (эклампсия, HELLP—синдром и т. д.).
В основе выраженного ухудшения растяжимости легких лежит целый комплекс причин: воспалительный процесс легочной ткани, альвеолярный коллапс вследствие недостаточности сурфактанта, интерстициальный отек. Коллапс альвеол приводит к развитию множественных ателектазов, при этом вследствие преимущественного нарушения вентиляции снижается вентиляционно-перфузионный коэффициент. Развивается выраженное шунтирование неоксигенированной крови справа налево — наиболее характерный синдром, свойственный рестриктивной ОДН. Это вызывает стойкую прогрессирующую гипоксемию, устойчивую к кислородотерапии.
Наиболее тяжело рестриктивная ОДН протекает при РДСВ (ОРДС).
Еще одной важной особенностью рестриктивной ОДН является выраженное увеличение работы дыхания по преодолению высокого эластического сопротивления «жестких» легких. На определенном этапе патологического процесса аппарат внешней вентиляции не справляется с высокой нагрузкой и наступает декомпенсация с опасной для жизни гипоксической гипоксией.
Связана с ограничением кровотока по ветвям легочной артерии и увеличением физиологического мертвого пространства. Основными причинами являются:
• тромбоэмболия ветвей легочной артерии (ТЭЛА);
• выраженная гиповолемия (кровопотеря, дегидратация).
При перфузионной ОДН происходит резкое снижение перфузируемых зон легких по отношению к вентилируемым (вентиляционно-перфузионный коэффициент >1, увеличивается физиологическое мертвое пространство, сокращается площадь реального газообмена. Как итог, прогрессирует гипоксемия и гипоксия, которые невозможно компенсировать развивающимся тахипноэ. Для ТЭЛА, кроме того, характерны выраженные гемодинамические нарушения и явления правожелудочковой недостаточности, что усугубляет ситуацию.
Торакодиафрагмальную, обструктивную, рестриктивную и перфузионную ОДН в литературе часто объединяют в паренхиматозную, или газообменную (гипоксемическую) ОДН. При паренхиматозной ОДН на первый план выходит прогрессирующая гипоксемия, которая нередко устойчива к кислородотерапии. Уровень РаС02 может длительное время сохраняться в пределах нормы за счет компенсаторных механизмов внешней вентиляции, гиперкарбия развивается уже на поздних стадиях заболевания при развитии декомпенсации.
Искусственная вентиляция легких
Искусственная вентиляция легких (ИВЛ) – метод протезирования внешнего дыхания – доставки свежей газовой смеси в альвеолы и удаление использованной из лёгких.
В настоящее время единственным эффективным способом ИВЛ является «ИВЛ методом вдувания». Разновидностью этого метода является осцилляторная вентиляция, используемая при высокочастотной ИВЛ (ВЧ ИВЛ). «ИВЛ методом вдувания» является нефизиологичной, так как при её проведении извращается биомеханика дыхания – экскурсия грудной клетки и диафрагмы вторична и является следствием раздувания лёгких, значительного повышения давления в них и плевральных полостях. Следствием нефизиологичности являются отрицательные эффекты ИВЛ на функционирование других органов и систем.
Исторически первые попытки протезирования дыхания являлись физиологичными и реализовывались методами воздействия на грудную клетку или диафрагму. Аппараты для ИВЛ «железные лёгкие», кирасы, «качающаяся кровать» механически или с помощью гравитации изменяли объём грудной полости, обеспечивая вдох и выдох. Тот же эффект получали, стимулируя работу дыхательных мышц электроимпульсами. Однако все эти методы оказались малоэффективными и непригодными в клинических условиях.
Влияние ИВЛ на состояние легких
Первичное влияние ИВЛ на функцию газообмена и саму легочную ткань зависит, прежде всего, от изначального состояния легких. Положительное влияние ИВЛ на функцию легких проявляется только при патологии легких, ведущей к серьезному нарушению вентиляционно-перфузионного соотношения (< 0,7). В таких случаях ИВЛ увеличивает количество функционирующих альвеол, частичному расправлению ателектазов, увеличению площади газообмена и улучшению оксигенации.
При относительно «здоровых» легких ИВЛ выполняет, в основном, заместительную, «протезную» функцию, механически поддерживая сам процесс внешней вентиляции: доставляет кислород и удаляет углекислоту.
В процессе длительной вентиляции независимо от изначального состояния легочной ткани постепенно проявляется отрицательное влияние ИВЛ на состояние легких. При ИВЛ (особенно высокими потоками) появляется турбулентность газового потока в дыхательных путях. Это определяет более высокое резистивное сопротивление бронхиального дерева и неравномерность распределения дыхательной смеси по легочным полям.
Существенно изменяя региональные взаимоотношения между альвеолярным, артериокапиллярным и венозным давлением, ИВЛ может нарушать процесс обмена воды в легких, увеличивая содержание внесосудистой воды в интерстиции легочной ткани и затрудняя отток лимфы из легких. При высоком альвеолярном давлении во время принудительного аппаратного вдоха может наступить сдавление легочных капилляров. Это усиливает процесс проникновения воды из капилляров в интерстиций легких. Задержка воды в легких особенно выражена при гиперкапнии.
Вентиляция слишком большими объемами приводит к «вымыванию» легочного сурфактанта, что постепенно ведет к коллапсу альвеол, ателектазированию и гипоксемии. С другой стороны, слишком малые дыхательные объемы вызывают гиповентиляцию значительной части легочной ткани с прогрессирующим ателектазированием, гипоксемией и нарушением элиминации СО2.
Наибольшее негативное влияние ИВЛ на легкие обусловлено высоким пиковым давлением на вдохе. Чрезмерно высокое пиковое инспираторное давление развивается при вентиляции большими дыхательными объемами (> 9—10 мл/кг) при сниженной податливости легких и при неравномерной вентиляции на фоне «мозаичной» рестриктивной патологии легочной ткани. Во время объемной ИВЛ подаваемый дыхательный объем поступает по пути наименьшего сопротивления — в более податливые (менее пораженные) зоны легких, перераздувая их и создавая высокое пиковое давление. Опасное увеличение пикового давления (>40—45 мм вод.ст.) приводит к баротравме более «здоровых» участков легких, что чревато разрушением структуры альвеол, высвобождением медиаторов воспаления, пневмотораксом, увеличением проницаемости легочных капилляров, микрокровоизлияниями в интерстиций легких и т. д. Все это усугубляет оксигенационные нарушения, а выделение из легочной ткани в кровь большого количества биологически активных веществ (медиаторов, протеолитических ферментов) не только поддерживает воспалительный процесс самих легких, но также может вызвать повреждение других органов.
Принципиально важно также избегать опасно высоких концентраций кислорода (FiО2 > 55-60 %). Высокая концентрация кислорода сама по себе способствует разрушению сурфактанта и образованию ателектазов.
Влияние ИВЛ на гемодинамику
Легкие и грудная клетка активно влияют на работу сердца и центральный кровоток за счет изменения внутриплеврального и, соответственно, внутригрудного давления.
В процессе спонтанного вдоха давление в грудной полости снижается, оказывая «присасывающее» действие на кровь в полых венах. В результате во время самостоятельного вдоха ударный и сердечный выброс увеличиваются, а давление в системе легочной артерии уменьшается.
Во время ИВЛ ситуация кардинально меняется. В течение принудительного аппаратного вдоха давление в дыхательных путях и плевральной полости сразу повышается. Увеличение внутригрудного давления затрудняет венозный приток к сердцу и приводит к снижению сердечного выброса за счет уменьшения преднагрузки, а увеличенное внутриальвеолярное давление (особенно при Ppeak > 40-45 мм вод.ст.) приводит к сдавлению легочных капилляров, при этом повышается легочное сосудистое сопротивление, затрудняется деятельность правого желудочка и снижается сердечный выброс.
В целом во время аппаратного вдоха ИВЛ оказывает разнообразное влияние в отношении различных структур сердца и крупных сосудов. Вследствие снижения преднагрузки выброс из правого желудочка уменьшается, одновременно растет давление в малом круге кровообращения и повышенное внутригрудное давление «выдавливает» кровь из сосудов легочной артерии в сторону левого предсердия. Это вызывает увеличение преднагрузки левого желудочка, увеличивая ударный выброс (если к левому желудочку поступило достаточное количество крови). Повышенное внутриплевральное и внутригрудное давление передается левому желудочку и аорте, облегчая движение крови к периферическим тканям. Таким образом, выброс из правого желудочка уменьшается, а из левого увеличивается — возникает несоответствие, которое неблагоприятно влияет на центральную гемодинамику.
Во время выдоха внутригрудное давление снижается, венозный приток усиливается и увеличивается выброс из правого желудочка. За счет снижения давления в системе легочной артерии уменьшается преднагрузка левого желудочка (часть крови задерживается в легочных капиллярах) и снижается выброс из левого желудочка.
Таким образом, основное неблагоприятное влияние ИВЛ на гемодинамику проявляется во время аппаратного вдоха, когда в наибольшей степени выражено снижение преднагрузки правых отделов сердца, увеличение легочного сосудистого сопротивления и снижение сердечного выброса. Несоответствие между наполнением правого и левого желудочка может оказывать непосредственное отрицательное инотропное действие на миокард. Общее снижение сердечного выброса на определенном этапе вызывает значимое уменьшение доставки кислорода к тканям.
Снижение сердечного выброса, особенно на фоне нарушения газообмена и снижения СаО2, может привести к недостаточному снабжению периферических тканей кислородом и циркуляторной гипоксии.
На выраженность гемодинамических нарушений во время ИВЛ оказывают влияние несколько основных факторов:
1. Уровень волемии. Гиповолемия способствует более выраженным нарушениям гемодинамики, связанным с ИВЛ. Гиповолемия сама по себе вызывает снижение преднагрузки, на фоне ИВЛ этот эффект проявляется в еще большей степени, что может привести к опасному снижению сердечного выброса, централизации кровообращения, нарушению периферической перфузии и тканевой гипоксии. С другой стороны, поддержание нормоволемии и активная инфузионная терапия способны нивелировать отрицательные гемодинамические эффекты ИВЛ за счет увеличения преднагрузки. При отсутствии эффекта от активной инфузионной терапии (или противопоказаниях к ней) необходимо применение инотропных препаратов (например, дофамина в кардиотонической дозе).
2. Среднее внутригрудное давление (с этим показателем коррелирует среднее давление в дыхательных путях Pmean) — один из самых мощных факторов, влияющих на сердечный выброс в условиях ИВЛ. Среднее давление Pmean зависит от пикового инспираторного давления, давления плато, скорости пикового инспираторного потока, ПДКВ (PEEP) и времени аппаратного вдоха. Увеличение любого или нескольких из этих показателей (особенно PEEP) вызывает рост Pmean. Опасность значимых гемодинамических нарушений реально проявляется при увеличении Pmean более 18—19 см вод.ст. Причем высокое Pmean вызывает не только снижение сердечного выброса, но и затрудняет отток венозной крови из головного мозга по внутренним яремным венам. Вот почему увеличение PEEP > 5—6 см вод.ст. опасно у больных с повышенным внутричерепным давлением (при отеке мозга). С точки зрения профилактики гемодинамических нарушений во время ИВЛ, кроме обеспечения нормоволемии рекомендуют поддерживать Pmean в пределах не более 15-16 см вод.ст. Если же необходима вентиляция с повышенным Pmean (высокое PEEP, длинное время вдоха), требуется тщательное мониторирование центральной гемодинамики (желательно инвазивное), инфузионная терапия и медикаментозная инотропная поддержка. Применение режима с управляемым давлением позволяет лучше регулировать Pmean в относительно безопасных пределах посредством изменения контролируемого инспираторного давления в дыхательных путях.
3.Существенное влияние на среднее внутригрудное давление и, следовательно, гемодинамику оказывает аутоПДКВ (autoPEEP). AutoPEEP возникает при неполноценном выдохе, раннем экспираторном закрытии дыхательных путей, при увеличении экспираторного сопротивления дыхательных путей, тахипноэ и т. д. При этом возникает дополнительный постоянный градиент давлений между альвеолами и трахеей, который передается на легочные капилляры, увеличивая Pmean и внутригрудное давление. Поэтому аутоПДКВ способствует дополнительному уменьшению преднагрузки, перераздуванию альвеол и росту легочного сосудистого сопротивления. Поддержание проходимости дыхательных путей и создание адекватного времени выдоха минимизирует риск развития аутоПДКВ и снижает, таким образом, отрицательное влияние ИВЛ на гемодинамику. Исключение составляют случаи, когда преднамеренно специальными режимами и параметрами ИВЛ добиваются создания аутоПДКВ с лечебной целью.
4. Состояние сократительной функции миокарда. Исходное нарушение сократимости миокарда, безусловно, способствует гемодинамическим нарушениям во время проведения ИВЛ. Больные с перенесенным инфарктом миокарда, предшествующими эпизодами левожелудочковой недостаточности, хроническим «легочным сердцем», пороками сердца и т. д. составляют группу повышенного риска с точки зрения расстройства гемодинамики при проведении ИВЛ. Ситуация усугубляется еще и тем, что такого рода пациентам противопоказана активная инфузионная терапия.
При исходной или развившейся сократительной недостаточности для профилактики грубых гемодинамических расстройств во время ИВЛ требуется:
• особенно тщательный контроль безопасного уровня внутригрудного давления (Pmean не более 16—17 мм вод.ст.);
• постоянный контроль гемодинамики (по возможности, инвазивный);
• применение инотропных медикаментозных препаратов (дофамина, ингибиторов фосфодиэстеразы) в индивидуальной дозировке;
• сбалансированное применение инфузионной терапии и периферических вазодилататоров.
Важным условием, уменьшающим негативное влияние ИВЛ на гемодинамику, является сохранение попыток спонтанного дыхания больного. Самостоятельные инспираторные усилия в некоторой степени сохраняют «присасывающее» действие грудной клетки, увеличивают преднагрузку и снижают сопротивление в системе легочной артерии.
Несмотря на опасность угнетения гемодинамики, начало ИВЛ зачастую оказывает положительное действие на состояние сердечно-сосудистой системы. Особенно это заметно у больных с тяжелой ОДН, у которых вследствие грубых нарушений газообмена и тяжелой гипоксемии имеет место компенсаторная гиподинамическая реакция кровообращения с тахикардией, спазмом периферических сосудов и т. д. Адекватная ИВЛ приводит к нормализации давления, купированию опасной тахикардии, улучшению периферической перфузии органов и тканей за счет улучшения газообмена и оксигенации артериальной крови.
Влияние ИВЛ на функцию внутренних органов
Механическая вентиляция легких в той или иной степени влияет также на функцию почек, печени и желудочно-кишечного тракта (ЖКТ). Вероятное отрицательное влияние ИВЛ на функцию почек является опосредованным и обусловлено несколькими факторами:
1. В случае выраженного снижения общего сердечного выброса происходит одновременное уменьшение артериального почечного кровотока, что приводит к снижению скорости клубочковой фильтрации и диуреза. К тому же в условиях нарушенного периферического кровообращения происходит активизация юкстагломерулярного аппарата с повышенной выработкой ангиотензина, также способствуя снижению диуреза.
2. Вследствие роста внутригрудного давления повышается давление в нижней полой вене, соответственно, повышается давление в почечных венах и снижается почечное перфузионное давление. Реально данный фактор влияет на функцию почек только при значительном повышении внутригрудного давления (Pmean > 18—19 мм вод.ст.).
3. При ИВЛ происходит увеличение продукции антидиуретического гормона и предсердного натрийуретического гормона. Это приводит к увеличению реабсорбции воды в почечных канальцах, задержке ионов натрия и снижению диуреза.
Однако на практике существенное отрицательное влияние ИВЛ на функцию почек наблюдается достаточно редко. Вероятно, положительное влияние на оксигенацию адекватно проводимой ИВЛ все-таки превалирует над отрицательным антидиуретическим эффектом. И в практике автора, и по данным литературы нередки случаи, когда при развивающейся олигурии на фоне гипоксии различного генеза (ОРДС, артериальная гипотен-зия, гестозы) перевод больных на ИВЛ (в комплексе с другой терапией) сопровождался увеличением диуреза вплоть до полиурии. Надо думать, это связано с устранением гипоксии, снижением уровня катехоламинов, купированием спазма артериол и т. д. Прогрессирование олигурии чаще всего обусловлено другой причиной (например, органическими изменениями почек, нескоррегированной гиповолемией, эндогенной или экзогенной интоксикацией).
Возможное отрицательное действие ИВЛ на функцию печени и ЖКТ связано со следующими механизмами:
• снижением сердечного выброса и ухудшением микроциркуляции во внутренних органах;
• повышением внутригрудного и венозного давления;
• увеличением внутрибрюшного давления;
• повышением давления в желчных протоках.
В действительности сама по себе ИВЛ не оказывает негативного влияния на печень и ЖКТ. Напротив, применение ИВЛ на фоне ОДН зачастую улучшает функцию внутренних органов. Если же осложнения со стороны печени и ЖКТ возникают, они, как правило, связаны с основным заболеванием и/или с длительной гипоксией, некоррегированной гиповолемией и т. д.
Помимо ИВЛ, следует проводить комплексную интенсивную терапию для устранения и/или профилактики функциональных нарушений почек, печени и ЖКТ.
Не каждый больной с острой дыхательной недостаточностью нуждается в немедленном переводе на ИВЛ. Это обстоятельство определяет порой трудности в принятии решения о применении аппаратной вентиляции. С одной стороны, в ряде ситуаций экстренная ИВЛ является бесспорной (мероприятия по сердечно-легочной реанимации, брадипноэ, апноэ, поверхностное дыхание), с другой, с точки зрения компенсаторных механизмов внешнего дыхания в большинстве случаев ОДН носит пограничный характер. В таких случаях решение о начале МВЛ должно приниматься врачом на основании детального анализа динамики заболевания пациента, клинической картины, динамики данных лабораторного и инструментального обследования. Именно динамическое наблюдение и мониторинг состояния больного играет решающее значение в оценке необходимости начала ИВЛ. Однократно полученные данные зачастую противоречивы и не дают целостного представления о тяжести патологии. Если же еще остаются сомнения (вентилировать или не вентилировать?), необходимо придерживаться принципа: начинать ИВЛ лучше немного раньше, чем немного позже.
В соответствии с классификацией по степени тяжести, перевод на ИВЛ должен осуществляться в период субкомпенсации. Такой принцип соответствует интересам больного, позволяет предотвратить срыв компенсаторных механизмов спонтанного дыхания, обеспечивает лучшую оксигенацию и более эффективное лечение основного заболевания. В настоящее время ранний переход на ИВЛ оправдан еще и потому, что современные аппараты и режимы ИВЛ способны обеспечить более безопасную и эффективную вентиляцию, чем респираторы ранних поколении, а также позволяют минимизировать отрицательные эффекты ИВЛ.
Врачам-реаниматологам следует переступать через собственный консерватизм, привитый «старшим» поколением, через предубеждение хирургов что «ИВЛ – это приговор». Больному надо дать отдохнуть, врачу надо время для диагностики и устранения причины неадекватности самостоятельного дыхания. Иногда для этого нужно 12 часов, иногда несколько суток. При грамотном подходе ИВЛ всегда (а не иногда) облегчает состояние больного и повышает выживаемость пациентов.
Клинические показания к ИВЛ
• Апноэ или брадипноэ (< 10 в минуту).
• Тахипноэ > 30 в минуту.
• Гипоксическое нарушение или угнетение сознания.
• Поверхностное дыхание, аускультативное распространение зон «немых легких» у пациентов с тяжелой рестриктивной или обструктивной патологией (например, астматический статус).
• Избыточная работа дыхания, истощение (усталость) основных и вспомогательных дыхательных мышц.
• Прогрессирующий цианоз и влажность кожных покровов.
• Кома любого генеза с нарушением глотательного и кашлевого рефлекса.
• Тяжелый шок, нестабильность гемодинамики.
• Черепно-мозговая травма с признаками нарушения дыхания или сознания.
• При тяжелой травме грудной клетки и легких.
• Повторяющийся судорожный синдром, требующий введения миорелаксантов или больших доз седативных препаратов.
• Прогрессирующая тахикардия гипоксического генеза.
• Прогрессирующий альвеолярный отек легких.
• Остановка эффективной сердечной деятельности.
Лабораторно-инструментальные показания к ИВЛ
• Прогрессирующая гипоксемия, рефрактерная к кислородотерапии.
• РаО2 < 60 мм рт.ст. (< 65 мм рт.ст. при потоке кислорода более 5 л/минуту).
• SaО2 < 90 %.
• РаСО2 > 55 мм рт.ст. (у больных ХОЗЛ > 65 мм рт.ст.).
• ЖЕЛ < 15 мл/кг.
Здесь перечислены общие показания к ИВЛ. При сочетание тех или иных признаков в различных модификациях, ИВЛ показана во всех случаях, когда имеются острые нарушения дыхания, приводящие к гипоксии, гиперкапнии и дыхательному ацидозу. Методические подходы к принятию решения о переводе на ИВЛ смотрите также в разделе «Классификация ОДН» на страницах 15-16.
Принципы работы аппаратов ИВЛ
Сущность работы любого приспособления или аппарата для проведения ИВЛ заключается в том, что необходимо сделать вдох — вдуть в лёгкие газовую смесь, и потом обеспечить выдох — возможность удаления из лёгких этой смеси.
Принципиальным моментом в обеспечении цикличной работы аппарата ИВЛ является способ переключения с вдоха на выдох и обратно.
Существуют несколько способов осуществления цикличности:
— По давлению – аппарат контролирует давление в дыхательном контуре и по заданным величинам давления в конце вдоха и выдоха обеспечивает цикличную ИВЛ. Принцип работы следующий – генератор сжатой газовой смеси (компрессор, турбина) осуществляет вдох – раздувает лёгкие, пока в них не поднимется давление, например до 18 см.вод.ст., после чего срабатывают клапана и лёгким пациента даётся возможность освободиться от избыточного давления, удалив отработанную газовую смесь и снизив давление, например до 0 см вод.ст. Затем опять начинается вдох, опять до достижения 18 см.вод.ст. и т.д. Изменяя величины давления для срабатывания клапанов и производительность генератора можно менять параметры ИВЛ – ДО, ЧД и МОД.
— По частоте – аппарат контролирует время фаз дыхательного цикла – вдоха и выдоха. Зная частоту дыхания и соотношения длительности фаз, можно рассчитать длительность вдоха и выдоха. Например, ЧД – 10 в минуту, значит на один дыхательный цикл (вдох+выдох) уходит 6 секунд. При соотношении вдох:выдох (I:E) – 1:2, длительность вдоха составит 2 секунды, выдоха 4 секунды. Принцип работы следующий – генератор сжатой газовой смеси (компрессор, турбина) осуществляет вдох – раздувает лёгкие в течении 2-х секунд, после чего срабатывают клапана и лёгким пациента даётся возможность освободиться от отработанной газовой смеси в течении 4-х секунд. Изменяя ЧД (и/или I:E) и производительность генератора можно менять ДО и МОД.
— По объёму – аппарат контролирует объём газовой смеси, нагнетаемой в лёгкие пациента, обеспечивая ДО. Затем даётся время для освобождения от отработанной газовой смеси. Изменяя ДО и производительность генератора (МОД), при заданном соотношении I:E, можно изменять ЧД.
Достаточно давно появился (ещё в РО-5), но только сейчас широко используется ещё один принцип управления цикличностью:
— По усилию пациента – когда сам больной инициирует вдох и генератор нагнетает в его лёгкие заданный ДО. В этом случае такие показатели как ЧД и, соответственно МОД, определяются самим пациентом. Эти триггерные (откликающиеся) системы определяют попытки самостоятельного вдоха а) по созданию небольшого отрицательного давления в дыхательном контуре или б) по изменению потока газовой смеси.
Старые аппараты ИВЛ работали по одному из этих принципов («Фаза» — частотные аппарат, РО – объёмные аппараты). Технический прогресс и развитие медицины сделали эту классификацию, так же как и перечисленные аппараты морально устаревшими. В современных аппаратах обеспечивается возможность работы – проведение ИВЛ по нескольким принципам, обеспечивая разные режимы ИВЛ.
В более современном представлении классификацию по принципу обеспечения цикличности можно представить в следующем виде:
— Аппараты или режимы ИВЛ с контролем дыхательного объёма. Работая «по частоте», т.е. в рамках расчётного времени на вдох, аппарат рассчитывает с какой скоростью надо доставить заданный ДО в лёгкие пациента.
— Аппараты или режимы ИВЛ с контролем давления на вдохе. Работая также «по частоте», т.е. в рамках расчётного времени на вдох, аппарат с определённой скоростью и до достижения установленного давления в дыхательных путях, нагнетает в лёгкие пациента ДО, измеряя его величину.
Варианты вентиляции, дыхательные контуры
При проведении ИВЛ возможны два варианта вентиляции: 1) с реверсией и 2) без реверсии. Под реверсией понимают возврат отработанной-выдохнутой газовой смеси в дыхательный контур.
К реверсивным дыхательным контурам относят закрытый, полузакрытый и маятниковый. Закрытый и полузакрытый дыхательные контуры используют при ИВЛ во время ингаляционной анестезии. На рисунке 1 приведена схема наркозного аппарата, позволяющего проводить ИВЛ по закрытому или полузакрытому дыхательному контуру.

Рисунок 1 – Реверсивные дыхательные контуры
О2, N2O, воздух – источники газов
Д – дозиметр, И – испаритель, А — абсорбер
1 – мех или приставка для ИВЛ
2 – клапан разгерметизации
3 – клапан вдоха
4 – клапан выдоха
5 — пациент
Газовая смесь формируется в дозиметре (Д) с использованием газов и воздуха. В испарителе (И) газовая смесь насыщается анестетиком и поступает в дыхательный контур, где с помощью клапанов вдоха и выдоха осуществляется однонаправленное движение газонаркотической смеси. Во время работы аппарата через клапан разгерметизации удаляется излишек смеси, образующийся за счёт постоянной подачи свежей смеси. В зависимости от количества подаваемой через дозиметр свежей смеси дыхательные контуры разделяют на закрытый (низкопоточный) и полузакрытый. Границей, отделяющей закрытый контур от полузакрытого можно считать сумму газотока до 2 л/мин. При полузакрытом контуре газоток свежей смеси составляет более 2 л/мин и сопоставим с минутной вентиляцией. При газотоке более 50% от МОД можно обойтись без абсорбера, так как достаточно интенсивное обновление газовой смеси предотвращает вероятность гиперкапнии. При газотоке, равном МОД дыхательный контур иногда называют «полуоткрытый с реверсией».
Иногда аппараты для ингаляционной анестезии используют для продлённой ИВЛ (из-за отсутствия других или по незнанию). В этом случае необходимо помнить об особенностях этих аппаратов. В старых наркозных аппаратах не предусмотрена подача воздуха в дыхательный контур и вентиляция будет осуществляться почти чистым кислородом, что губительно для лёгких. В этом случае необходимо:
— подавать сжатый компрессором воздух через дозиметр для закиси азота;
— если это невозможно, то необходимо перейти на вентиляцию по полуоткрытому контуру, используя нереверсивный клапан (см. далее).
К нереверсивным дыхательным контурам относят открытый и полуоткрытый. Одинаковым для них является то, что выдох осуществляется в атмосферу. Различием – при открытом дыхательном контуре вдох осуществляется чистым атмосферным воздухом, при полуоткрытом – газовой смесью. Примером может являться ИВЛ с помощью мешка Амбу.

Рисунок 2 – Мешок Амбу.
На рисунке 2 изображён мешок Амбу. Нереверсивный клапан, присоединяемый к пациенту, позволяет выдыхать в атмосферу. Если в мешок набирается только атмосферный воздух, то это будет открытый контур. Если же через специальный штуцер подавать кислород, то пациент будет дышать воздушно-кислородной смесью и контур станет полуоткрытым.
Если необходимо перевести наркозный аппарат на работу по полуоткрытому контуру, то нужно использовать нереверсивный клапан, присоединяемый к шлангу вдоха. Можно использовать нереверсивный клапан ВНИ-ИМП или нереверсивный клапан от мешка Амбу. Шланг выдоха убирается. В этом случае через клапан выдоха в дыхательный контур будет подсасываться воздух из атмосферы. Вдох будет осуществляться из аппарата воздушно-кислородной смесью, а выдох – в атмосферу (см. рисунок 3).
При модернизации наркозных аппаратов, имеющих датчик потока (3) на тройнике для пациента, могут возникнуть проблемы с его работой. На рисунке 4 В показан один из вариантов соединения. В этом случае нереверсивный клапан присоединён к тройнику через датчик потока. Патрубок для шланга выдоха закрыт заглушкой (4). В этом случае аппарат будет измерять только объём вдоха (Vi). Для измерения объёма выдоха (Ve) датчик потока необходимо присоединить к патрубку выдоха нереверсивного клапана.

Рисунок 3 – Схема работы наркозного аппарата без реверсии с использованием
нереверсивного клапана (пояснения в тексте).

Рисунок 4 – Наркозные аппараты с нереверсивным клапаном (пояснения в тексте).
Все аппараты ИВЛ работают без реверсии. Хотя больной выдыхает в аппарат, перемешивание газовых смесей линий вдоха и выдоха не происходит. Схематически любой аппарат ИВЛ можно представить следующим образом – рисунок 5.

Рисунок 5 – Схема аппарата ИВЛ
1 – дозиметр;
2 – линия вдоха;
3 – линия выдоха;
4 – «выхлоп» отработанной смеси в атмосферу;
5 – пациент.
В зависимости от наличия или отсутствия кислорода, ИВЛ может осуществляться по открытому контуру (без О2, FiO2=21%) или по полуоткрытому контуру (FiO2>21%). В любом случае выдохнутая пациентом газовая смесь попадает в атмосферу.
Аппараты ИВЛ советского (Российского) производства обычно комплектуются наркозной приставкой (НП). С помощью этой приставки можно проводить ингаляционную анестезию, вентилируя больного по закрытому, полузакрытому или полуоткрытому контуру. Всё зависит от варианта соединения аппарата ИВЛ и наркозной приставки. На рисунке 6 представлены схемы соединения для работы с реверсией (А) и без реверсии (Б).
Для работы с реверсией необходимо соединить шлангами клапаны вдоха и выдоха НП соответственно с линией вдоха и выдоха аппарата ИВЛ (А).
Для обеспечения работы без реверсии соединяются только клапан вдоха НП и линия вдоха аппарата ИВЛ (Б). Клапан выдоха НП и «выхлоп» аппарата ИВЛ остаются открытыми. В этом случае больной вентилируется газонаркотической смесью из НП, а выдыхает в атмосферу.
При использовании аппарата ИВЛ только для ИВЛ (при проведении в/в анестезии, при пробуждении или для продлённой ИВЛ) наркозный блок используют как дозиметр, и шланг, соединяющий клапан выдоха НП и «выхлоп» аппарата ИВЛ, необходимо снять. Только в этом случае обеспечивается безопасная ИВЛ при внезапном прекращении подачи кислорода и исключается вероятность вентиляции чистым кислородом, развития гиперкапнии.

Рисунок 6 — варианты соединения аппарата ИВЛ и наркозной приставки (пояснения в тексте).
На рисунке 7 А,Б,В показаны варианты соединения НП и аппарата ИВЛ. Дозиметр (1) определяет количество кислорода, подаваемое больному. Через шланг (2) этот кислород поступает в дыхательный контур НП. Там кислород смешивается с воздухом, который забирается из атмосферы через открытый клапан выдоха (4) или специальный клапан (8). Далее воздушнокислородная смесь через клапан вдоха (3) поступает на линию вдоха аппарата ИВЛ (5). Клапан вдоха можно убрать, как показано на рисунке 7 Б и В. Ёмкости абсорбера (9) при работе без реверсии не нужны и их можно убрать. На представленных схемах они выполняют роль демпферирующей ёмкости, так же как и мех (7).
На рисунке 7 Г представлен вариант аппарата ИВЛ без НП. На линию вдоха аппарата ИВЛ (5) (рядом расположен патрубок выхлопа (10)) установлен дозиметр (1) с клапаном подсоса воздуха (8). К нему же присоединён мех-демпфер, позволяющий проводить ИВЛ при отсутствии электроэнергии. Мех может быть заменён на резиновый 2-3 литровый мешок, но в этом случае ИВЛ вручную провести не возможно.
Следует обращать внимание на исправность клапана подсоса воздуха (8). При его негерметичности большая часть кислорода будет уходить в атмосферу операционной, а больной будет дышать воздухом. Невозможно будет проводить и ИВЛ вручную. При залипании этого клапана вентиляция будет осуществляться чистым кислородом и при большом потоке кислорода аппарат может остановиться.

Рисунок 7 – Варианты соединения наркозной приставки и аппарата ИВЛ (пояснения в тексте).
Для того, чтобы правильно собирать аппарат ИВЛ и НП нужно представлять движение газов и воздуха. На рисунке 8 переставлена схема движения кислорода, воздуха и кислородновоздушной смеси применительно к аппарату ИВЛ РО-6-04 и НП.

Рисунок 8 — Схема движения кислорода, воздуха и кислородновоздушной смеси (пояснения в тексте).
Правила проверки аппарата для ИВЛ
Для безопасной эксплуатации и предотвращения ятрогении необходимо проверять дыхательную аппаратуру перед каждым подключением пациента. Алгоритм проверки дыхательной аппаратуры складывается из 1) проверки способности проводить ИВЛ, обеспечивая вдох и выдох и 2) работоспособности системы контроля, сигнализации и безопасности.
Проверка аппарата на способность проводить ИВЛ осуществляется в два этапа – а) проверка способности обеспечить достаточный вдох и б) проверка способности обеспечить выдох. Это можно осуществить двумя способами.
Первый способ, применимый для «старых» аппаратов ИВЛ. Для проверки способности сделать вдох, т.е. развить достаточное давление в дыхательном контуре, закрывают пальцем отверстие на тройнике для подключения пациента и наблюдают за показаниями манометра. Клапан разгерметизации при этом закрывают или устанавливают величину срабатывания на максимум. При установленных средних параметрах (ДО 500-600мл) аппарат должен создавать в контуре давление как минимум в 50-60 см вод.ст. Если аппарат создаёт такое давление и при этом нет слышимой утечки газовой смеси, то переходят ко второму этапу. Если аппарат не развивает достаточное давление, то необходимо проверить герметичность соединений шлангов, переходников,
увлажнителя и т.д. Если негерметичностей нет и аппарат не развивает достаточное давление на вдохе, то он признаётся неисправным и не допускается к эксплуатации!
Следующим этапом проводят проверку аппарата на способность обеспечить возможность пациенту сделать выдох. Для этого врач через марлевую салфетку должен попробовать сам сделать спокойный выдох в аппарат через тройник для присоединения пациента. Делается это в фазу выдоха. Если выдох осуществляется без затруднения, то аппарат и в этом плане можно считать исправным.
Второй способ, применимый для любых аппаратов ИВЛ. Для его осуществления необходим резиновый мешок ёмкостью 1,5-2 литра – имитатор лёгких. Он присоединяется к тройнику вместо пациента. Устанавливаются близкие к максимальным параметры ИВЛ – ДО 900-1000мл, клапан разгерметизации при этом закрывают или устанавливают величину срабатывания на максимум, ПДКВ (РЕЕР) убирают. Наблюдают за мешком и манометром – мешок должен максимально раздуваться на вдохе, создавая сопротивление порядка 30 см вод.ст. и спадаться во время выдоха. Для большей уверенности можно попробовать сжать мешок во время вдоха и получить большее давление. Сжатие мешка во время выдоха подтвердит возможность сделать беспрепятственный выдох.
Проверка работоспособности системы контроля, сигнализации и безопасности. Проводиться при открытии клапана разгерметизации (РО-5, РО-6) или устанавливают величину его срабатывания на обычные параметры – 30-40 см вод.ст. При закрытии пальцем отверстия на тройнике для подключения пациента или сжатии мешка-имитатора на вдохе, давление в контуре не должно превышать установленный предел и должна срабатывать система сигнализации. При разгерметизации контура – снятии мешка, также должна срабатывать система сигнализации.
Следует подчеркнуть важность такой рутинной проверки перед каждым подключением аппарата, перед каждым наркозом. Практика показывает, что любой, даже самый совершенный аппарат способен сломаться, и если эта поломка не выявляется до начала эксплуатации, то её выявление во время ИВЛ обычно сопровождается существенными нарушениями внешнего дыхания и кровообращения, иногда и баротравмой. Эти осложнения смертельны и относятся к ятрогенным!
Чаще всего причиной нарушений работы дыхательной аппаратуры является залипание резиновых мембран, подвергающихся воздействию конденсата. При высыхании – вне эксплуатации, конденсат способен приклеить или деформировать мембраны-клапаны. На это достаточно всего полчаса-час – как раз время перерыва между наркозами.
Параметры вентиляции
Рациональная ИВЛ может сделать ее высокоэффективной и в то же время практически безопасной, если она основана на обеспечении адекватного газообмена при максимальном ограничении вредных эффектов, а также при сохранении субъективного ощущения «дыхательного комфорта» у больного, если он во время ИВЛ остается в сознании.
Понятие «рациональная методика» подразумевает прежде всего рациональный выбор для данного больного следующих параметров ИВЛ: дыхательного объема и частоты вентиляции, а значит и минутной вентиляции. Немаловажно обеспечивать минимальное давления на вдохе, оптимальное отношения продолжительности вдоха и выдоха, скорости вдувания газов (а также особенностей её изменения в течение дыхательного цикла).
Указанные параметры тесно связаны и обусловливают друг друга. Тем не менее, при выборе конкретных величин параметров ИВЛ одному из них придается значение основного, определяющего величину всех остальных. По мнению многих авторов, таким основным параметром является минутный объем вентиляции (МОВ или МОД – минутный объём дыхания). Но МОД складывается из дыхательного объёма (ДО) и частоты дыхания (ЧД): МОД=ДО*ЧД
К настоящему времени практически все авторы сходятся во мнении, что нормальная частота дыхания при ИВЛ должна составлять от 12 до 16 в минуту. Отклонения в ту или иную сторону допускается по определённым показаниям и под контролем газов крови. Таким образом, первостепенную роль всё же играет ДО.
Дыхательный объем. Он должен быть достаточным для «промывки» мертвого пространства и удаления углекислого газа из альвеолярного воздуха. Если дыхательный объем будет меньше или равен объему мертвого пространства, то теоретически альвеолярная вентиляция должна быть равна нулю. Однако практически при дыхательном объеме, который меньше объема мертвого пространства, незначительное количество вдыхаемого газа все же достигает альвеол [Briscoe et al., 1951]. Это происходит главным образом в результате конического (слойного) движения вдыхаемого газа по воздухоносным путям и диффузии газа в газовой же среде.
Для здорового человека размеры физиологического мертвого пространства и количество выделяемого углекислого газа могут быть высчитаны с достаточной точностью, что позволило Radford и соавт. (1954, 1955) предложить способ определения необходимого объема вентиляции.
С учетом объема мертвого пространства и необходимой минутной вентиляции Radford и соавт. составили номограмму для определения оптимального дыхательного объема, обусловленного полом и массой тела пациента, частотой дыхания и температурой тела. Аналогична и номограмма Герцога-Энгстрема-Норландера.
Более простой вариант – формула расчёта МОД Дарбиняна Т.М. (1976):
MOД (л/мин) = масса_тела/10 кг + 1.
Современный подход ещё проще:
ДО(мл) = масса тела(кг) * 10
Такой подход реализован даже в некоторых современных аппаратах ИВЛ, якобы обладающих интеллектом. При включении запрашивается масса тела пациента и аппарат высчитывает должный ДО. Это, конечно, очаровывает врачей, ослабляя их мыслительный процесс в плане подбора параметров – «аппарат умный – сам всё сделает».
Однако в последних рекомендациях и монографиях коэффициент 10 поменяли на 7-8, т.е. расчёт ДО производиться исходя из 7-8 мл/кг.
Следует заметить, что во всех этих рекомендациях есть одна, но очень важная методологическая ошибка. Ещё со времён Рэдфорда считалось, что повышение уровня обмена должно компенсироваться повышением МОД. Т.е. у больных с повышенной температурой или ожирением следует увеличивать МОД до 30% от расчётного и именно за счет ДО. Однако из физиологии известно, что в крови при нормальном дыхании и кровообращении есть примерно тройной резерв кислорода, и именно этот резерв в первую очередь используется при повышении потребности в кислороде. А если верить Рэдфорду и Дарбиняну, то больной с ожирением «последней степени» и весом 100 кг при росте 145 см нужно вдувать по 1 литру в её «куриные» лёгкие. Даже если исходить из 7-8мл/кг — получиться многовато. А если представить мужчину весом 50 кг при росте 190 см, исхудавшем из-за заболевания желудка, то ему ДО нужно определить не более 500 мл!?
Люди с повышенной потребностью в кислороде (например, с ожирением) компенсируют эту потребность не увеличением ДО, а увеличением количества гемоглобина, отсутствием резерва и непереносимостью физических нагрузок. Можно понаблюдать за людьми с ожирением – в покое они дышат как и все –
не очень глубоко с нормальной или несколько повышенной частотой. При любой физической нагрузке возникают признаки дыхательной недостаточности – выраженное гипер- и тахипноэ. А в анализе красной крови всегда есть эритремия, более выраженная у людей с ожирением, которые выполняют физическую работу.
Спортсмены же увеличивают свои физические возможности не столько увеличением ДО, сколько тем же повышением количества гемоглобина. ДО – это понятие скорее анатомическое, чем функциональное.
Таким образом, более рационально определять ДО исходя из должной массы тела:
для мужчин ДО(мл) = (Рост(см) – 100) * 8;
для женщин ДО(мл) = (Рост(см) – 110) * 8.
Ещё более оптимальный подход – определение больным до наркоза ДО при спирометрии. Однако этот вариант неприемлем для экстренно поступающих больных.
Контроль параметров вентиляции
Любой исполняющий механизм обладает определённой точностью. Для аппаратов ИВЛ вопрос точности работы имеет более чем технический смысл — обеспечение заданных параметров вентиляции имеет принципиальное значение для жизни больного. Наиболее важными параметрами вентиляции, которые необходимо контролировать, являются ДО и ЧД. МОД рассчитывается исходя из среднего ДО и ЧД или суммированием ДО в течении минуты. Необходим также контроль за давлением в дыхательных путях и концентрацией кислорода.
В «старых» аппаратах контроль за параметрами вентиляции считался опциональным – в комплект аппарата РО входил волюметр, а «Фазы», «Спироны» волюметрами не комплектовались. В импортных же аппаратах того времени (например Bennet) спирометр уже являлся структурной единицей дыхательного контура. Контроль за давлением осуществлялся по стрелочному манометру.
Соответственно оснащению сформировался и методологический подход врачей к контролю – святая вера в то, что аппарат делает всё как надо и контролировать его точность не надо. Если установили ДО в 500мл, то аппарат обеспечивает эти 500мл, а если что-то не так – виноват сам больной. В аппаратах РО точность обеспечивалась самим принципом вентиляции по объёму и перекачиванием в лёгкие пациента нормированного объёма газовой смеси. Всё зависело от заводской настройки, погрешности могли быть только за счёт утечки или при очень высоком сопротивлении дыханию.
В частотных же аппаратах («Фазы», «Спироны») точность исполнения заданного объёма вообще понятие абстрактное, так как аппарат следит только за временем: 1 секунда — вдох при определённой скорости потока — и аппарат переключается на выдох. Сколько успело за это время газовой смеси дойти до альвеол никому не известно – в комплект аппарата волюметр не входит. Примерно такая же ситуация и с аппаратами нового поколения — «Фаза 7». На экране высвечивается объём газа, который вышел из аппарата, а что дошло до больного остаётся неизвестным. Хотя опционально в комплект поставки может входить электронный волюметр.
Принципиальная схема за контролем ДО и МОД должна быть представлена следующим образом:
— задаётся определённый-расчётный ДО или параметр, его определяющий – при вентиляции «по давлению» это величина инспираторного давления (Pinsp);
— аппарат контролирует (измеряет) объём вдоха – дыхательный объём (VT – Tidal volume или Vi – Inspiratory volume );
— аппарат контролирует (измеряет) объём выдоха – реальный выдыхаемый дыхательный объём (VTE – Expiratory tidal volume или Ve – Expiratory volume);
— по реальной — общей частоте дыхания за минуту (fTOTAL) складывающейся из частоты принудительных вдохов (f) и частоты спонтанных вдохов (fSPONT) и объёмов выдохов за эту же минуту подсчитывается МОД;
— по разнице между объёмами вдоха и выдоха определяется величина утечки и при необходимости включается сигнал тревоги.
Следует подчеркнуть, что врачей должен больше интересовать выдыхаемый объём, т.е. объём газа, который побывал в лёгких. Имеет значение и то, что во время вдоха создаётся высокое давление в шлангах, и при наличии негерметичностей потери будут больше, чем во время выдоха, когда давление в контуре гораздо меньше.
На рисунке 9 представлена схема расположения датчиков контроля.
Технически измерение дыхательного объёма в аппаратах ИВЛ (в наркозных тоже) может реализовываться по разному. В любом аппарате сначала задаётся ДО или величина инспираторного давления (Pinsp). Далее контроль должен осуществляться следующим образом.
В аппаратах РО или «Фаза» волюметр устанавливается в точке 3 – на выдохе. В «Фаза 7» есть датчик в точке 1 – измеряется объём вдоха, дополнительный датчик устанавливается в точку 3 или на выхлоп.

Рисунок 9 – Схема расположения датчиков контроля в аппаратах ИВЛ (пояснения в тексте).
В аппаратах Rafael, Galileo датчик потока расположен в точке 2. Это позволяет измерять одним датчиком и объём вдоха и объём выдоха. Преимущества такого подхода – большая точность, так как исключается учёт утечки на отрезке аппарат-шланги-увлажнитель-шланги. Однако при таком при работе без фильтра — мокрота и конденсат выводят из строя этот датчик почти сразу.
Более стандартная схема для современных аппаратов – датчики расположены в точках 1 и 3.
При любом расположении датчика потока или волюметра, объём выдоха будет завышен, и тем больше, чем выше пиковое давление на вдохе и чем больше ёмкость дыхательного контура – чем длиннее шланги и меньше воды в увлажнителе. Механизм формирования погрешности следующий – сжатая газовая смесь заполняет дыхательный контур и лёгкие пациента, а после открытия клапана выдоха (в точке 3) газовая смесь, увеличиваясь в объёме, покидает не только лёгкие, но и шланги вдоха и выдоха, увлажнитель. Исходя из этого, наибольшей точностью обладает датчик потока, расположенный в точке 2 – сразу за интубационной трубкой.
Подбор параметров ИВЛ. Контроль эффективности ИВЛ
Т.В.Гейронимус (1975) в своей монографии, посвящённой вопросам искусственной вентиляции легких, приводит забавный пример: однажды врач, войдя в палату и увидев посиневшего, с частым дыханием больного, обращаясь к палатной сестре, распорядился:
— Дайте больному кислород.
Однако палатная сестра спросила:
— Сколько, доктор?
В ответ на вопрос доктор пулей вылетел из палаты.
Ответ на этот вопрос действительно не простой. Переведя тяжело больного на ИВЛ, врач должен выставить на аппарате величину дыхательного объема и частоту дыханий, контролировать величину давления на высоте вдоха и выставить величину газотока кислорода или его концентрацию во вдыхаемой смеси (FiО2).
Ориентировочно, для начала, врач может воспользоваться рекомендациями, изложенными выше – ЧД – 14-16 в минуту, ДО – исходя из роста пациента (стр.38). Оптимальность выбранного ДО можно сразу оценить аускультативно и по экскурсии – дыхание должно проводится во все отделы лёгких, в нижних отделах может быть ослабление. Экскурсия должна быть такой, как будто человек дышит сам, находясь в спокойном состоянии. А какой должна быть первоначальная величина FiО2?
Первоначальной величиной FiО2 должна быть 100%. Через 20-25 минут после начала ИВЛ, то есть когда установится газовое динамическое равновесие в системе аппарат-больной, врач должен взять первый анализ крови на предмет определения величины напряжения О2 и углекислоты в крови.
Из какого места должна быть взята кровь на анализ? Только из артерии! Можно, с целью получения постоянной точной информации, произвести канюлирование лучевой артерии.
Итак, через 20-25 минут после начала ИВЛ делается первый анализ артериальной крови на предмет определения в ней напряжения кислорода (РаО2) и углекислоты (РаСО2). В норме показатель РаСО2 колеблется в пределах 35-45 ммНg. Если величина этого показателя меньше нижней границы нормы, это означает, что легкие вентилируются («проветриваются») больше, чем необходимо, что первоначальная ориентировочная величина МОД требует коррекции. В различных источниках литературы даются разные величины РаСО2 (от 30 до 10 мм Нg), при которых гипокапния приводит к функциональному сужению сосудов головного мозга с последующим развитием отёка мозга.
Если величина РаСО2 больше верхней границы нормы, это означает, что легкие вентилируются недостаточно, чем необходимо, что первоначальная ориентировочная величина МОД тоже требуют коррекции, иначе состояние больного осложнится газовым ацидозом и его последствиями.
Если величина РаСО2 окажется в пределах нормы, это означает, что первоначальная величина МОД является вполне подходящей. Далее оценивается показатель РаО2. Его величина должна быть близкой к 90 ммН. Или же к нормальной величине конкретного больного. Наиболее практичной формулой, по которой можно определить индивидуальную норму РаО2 больного является формула Н.Don (1985 г.):
РаО2 = 100 — 0,3 * (возраст больного или больной)
Может оказаться, что величина этого показателя значительно больше нормы. Если при этом уровень РаСО2 нормальный, то следует уменьшить FiО2. Уменьшение FiО2 не должно быть резким. Рекомендуют снизить первоначальную величину на 20-25%.
Если уровень РаСО2 ниже нормы, то в первую очередь следует уменьшить ДО (на 10%) и FiО2.
Если уровень РаСО2 выше нормы, то следует увеличить ДО (на 10%) и (или) увеличить ЧД и уменьшить FiО2.
После коррекции продолжают ИВЛ ещё в течение 10-15 минут. За это время опять наступает газовое динамическое равновесие в системе аппарат – больной, и затем делают повторный анализ крови и его оценку. Допустим при этом величина РаСО2 оказывается в пределах нормы, а величина РаО2 все еще выше индивидуальной нормы больного. Тогда снижают FiО2 еще на 20-25% (то есть на 40-50% от первоначальной величины). Продолжают ИВЛ еще 10-15 минут, затем вновь делают анализ крови. Если при этом величина РаО2 будет достаточно близкой (плюс/минус 10 %) к величине индивидуальной нормы, то можно считать, что подбор режима ИВЛ закончился. В подобранном режиме можно продолжать ИВЛ далее, контролируя РаСО2 и РаО2 через каждые 3-4 часа, и после очередного контроля, если имеются показания, вносят поправку.
Может иметь место и другая ситуация. Допустим, что в первом же анализе крови величина РаСО2 окажется в пределах нормы и нет нужды в коррекции режима вентиляции. А величина РаО2 из-за тяжести состояния больного окажется существенно ниже индивидуальной нормы больного. В чем причина (ведь больному с самого начала ИВЛ подается 100% кислорода!), что надо делать? Причина одна — нарушена диффузия кислорода через альвеоло-капиллярную мембрану, и поэтому кислород не поступает в капилляры малого круга кровообращения (МКК). Это патологическое шунтирование крови в МКК. Протекающая по капиллярам кровь не обогащается кислородом. Поэтому у больного имеется гипоксемия (недостаток кислорода в крови) и гипоксия (органы, ткани, клетки недополучают так необходимый кислород).
Шунтирование крови в МКК, как явление физиологическое, имеется всегда. В норме оно составляет от 2 до 6% от сердечного выброса (СВ), то есть 2-6% крови от СВ проходит через капилляры в лёгких, не обогащаясь кислородом. Имеются сведения о том, что если величина патологического шунта в МКК достигает 15% и более, то такие больные погибают от гипоксии.
Имеются методы определения величины шунта в МКК, но они пока не так просты и доступны, как хотелось бы. Выход из такой ситуации единственный. Не зная истинной величины шунта в МКК (имея лишь только признак его наличия), надо постараться перевести больного из разряда с шунтом 15% и более в разряд с шунтом до 15% и менее (то есть «дать больному шанс на выживание»). Надо усилить диффузионную способность для кислорода. Она может быть усилена за счет повышения напряжения кислорода в альвеолах. Повышение его напряжения можно получить путем повышения давления в альвеолах и (или) увеличения времени контакта альвеолярно-капиллярной мембраны с кислородом. Это достигается применением специальных режимов ИВЛ. Но вновь встает вопрос: сколько подавать больному кислорода? Ответ однозначный — 100%, то есть величина FiО2 должна быть равна величине МВЛ.
Но в то же время необходимо помнить, что длительная вентиляция чистым кислородом губительна для легких – ателектазирование и ожог – известные осложнения жесткой оксигенотерпии. Исходя из этого, даже если при вентиляции чистым кислородом не достигается достаточной оксигенации, продолжать такой вариант не стоит – необходимо уменьшить FiО2 хотя бы до 80% уже через час-два ИВЛ.
Итак, первым показателем достаточности или недостаточности оксигенации больного является РаО2 — показатель респираторного транспорта кислорода (Г.А.Рябов, 1988 г.). Этот показатель информирует о доставке кислорода до МКК и не далее. Но всё остальное уже не относиться к проблеме ИВЛ.
В итоге можно отметить, что при проведении ИВЛ мы фактически имеем дело с двумя режимами.
1. Это режим вентиляции. Достаточность или недостаточность режима вентиляции оценивается по РаСО2. При коррекции этого режима может возникнуть необходимость в изменении параметров вентиляции.
2. Это режим оксигенации. Достаточность или недостаточность режима оксигенации оценивается по РаО2. При коррекции этого режима может возникнуть необходимость в изменении параметров вентиляции, уменьшении или увеличении FiО2 или же применении специальных режимов ИВЛ.
Есть ещё один принципиальный вопрос – какой режим важнее? Вентиляции или оксигенации? Дело в том, что иногда нормальный режим оксигенации достигается только при гиперкапнии, т.е. при недостаточной вентиляции. В ответе на этот вопрос необходимо исходить из того, что длительная гипоксемия губительна для организма, т.к. её следствием являются морфологические — необратимые изменения на клеточном уровне. Последствия же гиперкапнии, даже длительной, носят обычно функциональный — обратимый характер. Исключением являются критические состояния в нейрореанимации, когда гиперкапния может повышать внутричерепное давление и усугублять отёк мозга.
Ещё один принципиальный вопрос – синхронизация больного с аппаратом (поддержка самостоятельного дыхания). Больные в критическом состоянии, с тяжёлой гипоксемией, гипер- или гипокапнией должны быть синхронизированы с аппаратом медикаментозно (седатики, гипнотики, наркотики, миорелаксанты)! Осуществлять поддержку самостоятельного дыхания можно и нужно после выведения больного из критического состояния и нормализации газового состава артериальной крови.
Основные режимы ИВЛ
В современной интенсивной терапии используются два основных режима вентиляции – «по объёму» — с контролем ДО, и «по давлению» — с контролем заданного давления на вдохе, по достижении которого нагнетание газовой смеси в лёгкие прекращается. Множество различных режимов, обеспечиваемых современными аппаратами, являются разновидностями этих двух основных. К сожалению, отсутствует стандартизация в названиях и определении многих параметров современной ИВЛ. Поэтому в аппаратах разных фирм производителей одни и те же параметры имеют разные обозначения и единицы измерения. Поэтому врачу следует чётко определить главные параметры, определяемые им при настройке любого аппарата. Более детальные настройки, присущие определённой модели необходимо подбирать с помощью инструкции по эксплуатации, которая всегда должна быть рядом с аппаратом, а не в кабинете у старшей медсестры отделения. Рассмотрим основные параметры этих двух основных режимов.
Вентиляция с контролем по объёму
Синонимы – обозначения на разных вентиляторах: CMV (Controlled Mechanical Ventilation) – управляемая механическая вентиляция; IPPV (Intermittent Positive Pressure Ventilation) — вентиляция под перемежающимся положительным давлением; А/С (Assist/Control) — ассистируемая/контролируемая вентиляция; VCV (Volume Control Ventilation) — вентиляция с контролем по объему. Буква S, которая может стоять в скобках при аббревиатуре, обозначает возможность синхронизации с самостоятельным дыханием пациента.
Основные параметры
— Дыхательный объём – ДО – VT — Vi. Рассчитывается по должной массе тела (см.стр.38).
— Частота дыхания – ЧД – f. Нормальная величина 12-16 в минуту.
— Концентрация кислорода – FiO2. При вентиляции «здоровых» пациентов – 30-40%, у тяжёлых больных ИВЛ начинают с 100%, затем уменьшают до уровня, обеспечивающего достаточную оксигенацию артериальной крови.
Дополнительные параметры:
— Соотношение длительности вдоха и выдоха – I:E. Нормальное соотношение 1:2. Устанавливается непосредственно в настройках или изменяется путём подбора времени вдоха – Ti и времени «плато на вдохе» — Tinsp. Если соотношение задаётся врачом, то аппарат рассчитывает время на вдох с учётом заданной частоты дыхания и необходимости в инспираторной паузе (плато). Соответственно автоматически рассчитывается или также устанавливается врачом скорость вдоха – инспираторный поток ∆ V в литрах в минуту (л/мин) или скорость нарастания давления в дыхательных путях в мбар/с (FlowAcc в аппаратах Дрегер). Нормальные величины – 40-50л/мин или 30 мбар/с.
В некоторых аппаратах всё наоборот – врачом устанавливаются время вдоха (Ti), время «плато на вдохе» (Tinsp) и скорость вдоха ( ∆ V или FlowAcc). Врачу после всех этих установок необходимо проконтролировать полученное соотношение I:E. Если соотношение не нормальное, то надо напрягать мыслительный процесс и изменять-подбирать вышеперечисленные параметры. В аппаратах РО и старых Фазах соотношение I:E фиксировано – 1:2.
— Ограничение максимального давления в дыхательных путях – Pmax. Предохранят лёгкие пациента от баротравмы. В случае превышения установленной границы включается тревога и излишек газовой смеси стравливается в атмосферу. Обычно устанавливаемая величина Pmax – 30-40 см вод.ст. На некоторых аппаратах устанавливается нерегулируемый клапан разгерметизации, имеющий два положения – «открыто» и «закрыто». В открытом положении клапан срабатывает при превышении заданного давления (в РО-6 при 30см вод.ст.), в закрытом положении давление в контуре не ограничивается.
— Положительное давление в конце выдоха – ПДКВ – РЕЕР. Параметр вентиляции, который обычно используют у больных с рестриктивной диффузионной ОДН. «Физиологический» РЕЕР – 2-3 см вод.ст. не вредит всем больным и обычно создаётся самим аппаратом ИВЛ. Величина лечебного РЕЕР зависит от степени нарушения диффузионной способности и подбирается по газам крови – до нормализации напряжения кислорода в артериальной крови. Обычно используют 5-10, максимум 15 см вод.ст. Следует учитывать, что при повышении РЕЕР ухудшается легочной капиллярный кровоток и венозный возврат.
На старых моделях РО-6 возможность создания РЕЕР не предусмотрена, но его можно осуществить, уменьшая просвет патрубка выхлопа. Другой вариант –
шланг, одетый на патрубок выхлопа, опускают в ведро с водой. Изменяя глубину погружения шланга, меняют величину РЕЕР. Контроль РЕЕР осуществляют по манометру – на выдохе стрелка не доходит до 0 отметки на величину РЕЕР.
Аппараты, способные осуществлять данный режим ИВЛ
Любой современный аппарат, аппараты РО-5 и РО-6. Можно считать, что и частотные аппараты «Фаза», «Спирон» также осуществляют вентиляцию с контролем по объёму.
Область применения вентиляции с контролем по объёму
Обычно этот режим используют при проведении ИВЛ во время наркоза и при пробуждении пациентов, т.е. у пациентов со здоровыми лёгкими. С успехом можно использовать этот режим и у больных с обструктивными состояниями, особенно в период тяжёлой обструкции. При рестриктивной патологии лёгких данный режим может быть показан только при генерализованном и однородном поражении легочной паренхимы.
При обструктивных состояниях следует устанавливать минимальную ЧД – 10-12 в мин. ДО устанавливают исходя из должного веса пациента, но главным критерием является давление на вдохе. ДО может быть выше или ниже расчётного и подбирается таким образом, чтобы давление на вдохе составляло 45-50 см вод.ст. при тяжёлой обструкции (статус, немое лёгкое), и 35-40 см вод.ст. при умеренной обструкции. Соотношение I:E подбирают таким образом, чтобы осуществлялся полноценный выдох и аутоРЕЕР был не более 3-4 см вод.ст. Первоначально это соотношение может быть 1:3-4, но необходимо стремиться к его нормализации или даже инверсии при уменьшении обструкции и сохраняющейся гипоксемии. По возможности обеспечивают и плато на вдохе. На аппаратах РО и Фаза, где нет возможности изменять I:E, для оптимизации вентиляции меняют ЧД, уменьшая её до 7-8 в минуту. Первоначальная концентрация кислорода во вдыхаемой смеси 90-100%. Уменьшают при нормализации РаО2 (до 80 мм рт.ст.). Нормальный уровень РаСО2 для больных с хроническими обструктивными заболеваниями составляет 50-55 мм рт.ст.
При рестриктивной патологии режим с контролем по объёму не обеспечивает оптимальную вентиляционную поддержку. Особенно «нежелателен» при очаговом, негенерализованном поражении лёгких, так как при повышенной жесткости легких создается высокое давление в дыхательных путях, что чревато баротравмой. ЧД следует устанавливать минимальную – 10-12 в мин. ДО устанавливают исходя из должного веса пациента, но главным критерием является давление на вдохе. ДО может быть ниже расчётного и подбирается таким образом, чтобы давление на вдохе составляло не более 25-30 см вод.ст. Более высокое давление при локальных поражениях легочной паренхимы может привести к баротравме.
Соотношение I:E поддерживают нормальным. По возможности обеспечивают максимальное по длительности плато на вдохе. Для этого можно увеличить скорость вдоха, но опять же – следя за величиной максимального давления на вдохе.
Первоначальный РЕЕР – 7-8 см вод.ст. Увеличивают при сохраняющейся гипоксемии под контролем гемодинамики до 15 см вод.ст.
При явлениях тяжёлой сердечно-сосудистой недостаточности, когда увеличение РЕЕР сопровождается ухудшением гемодинамики, собственные наблюдения показали эффективность сочетания умеренного РЕЕР (7-10 см вод.ст.) и инверсии – I:E = 1:1-1,5.
На аппаратах РО и Фаза, где нет возможности изменять I:E, для оптимизации вентиляции меняют ЧД, уменьшая её до 7-8 в минуту и максимально увеличивая время вдоха. Периодически (но не постоянно) можно увеличивать ДО, чтобы давление на вдохе составляло 25-30 см вод.ст.
Первоначальная концентрация кислорода во вдыхаемой смеси 90-100%. Уменьшают FiO2 при нормализации РаО2 (до 90 мм рт.ст.). Повышенный уровень РаСО2 до достижения нормальной оксигенации можно считать некритичным. Нормальные, а тем более сниженные показатели РаСО2 при сохраняющейся гипоксемии можно считать признаком неправильно подобранных параметров ИВЛ.
Вентиляция с контролем по давлению
Обозначение — PCV (Pressure Control Ventilation) — вентиляция с управляемым давлением; BIPAP (Biphasic Positive Airway Pressure) -двухфазное положительное давление в дыхательных путях. Другие названия: PCV+, DuoPAP, SPAP, BiLevel.
Основные параметры:
— Инспираторное (пиковое) давление – Pinsp (Ppeak). В норме 12-15 см вод.ст. Подбирается так, чтобы величина ДО соответствовала расчётной по должной массе тела (см.стр.36).
— Частота дыхания – ЧД – f. Нормальная величина 12-16 в минуту.
— Концентрация кислорода – FiO2. При вентиляции «здоровых» пациентов – 30-40%, у тяжёлых больных ИВЛ начинают с 100%, затем уменьшают до уровня, обеспечивающего достаточную оксигенацию артериальной крови.
Дополнительные параметры:
— Соотношение длительности вдоха и выдоха – I:E. Нормальное соотношение 1:2. Устанавливается непосредственно в настройках или изменяется путём подбора времени вдоха – Ti. При использовании режима PCV у больных с тяжёлой рестриктивной патологией лёгких иногда используют соотношение 1:1,5 – 1:1.
— Положительное давление в конце выдоха – ПДКВ – РЕЕР. Параметр вентиляции, который обычно используют у больных с рестриктивной диффузионной ОДН. «Физиологический» РЕЕР – 2-3 см вод.ст. не вредит всем больным и обычно создаётся самим аппаратом ИВЛ. Величина лечебного РЕЕР зависит от степени нарушения диффузионной способности и подбирается по газам крови – до нормализации напряжения кислорода в артериальной крови. Обычно используют 5-10, максимум 15 см вод.ст.
Аппараты, способные осуществлять данный режим ИВЛ
Любой современный аппарат.
Область применения вентиляции с контролем по давлению
Этот режим может использоваться при проведении ИВЛ во время наркоза и при пробуждении пациентов, т.е. у пациентов со здоровыми лёгкими. При рестриктивной патологии лёгких данный режим является основным и наиболее эффективным.
ЧД устанавливают нормальное – 14-16 в мин. Инспираторное давление устанавливают таким образом, чтобы обеспечить расчетный ДО (исходя из должного веса пациента), при этом инспираторное давление может быть гораздо выше нормальной величины (>20 см вод.ст.).
Соотношение I:E – 1:1,5. Первоначальный РЕЕР – 7-8 см вод.ст.
При сохраняющейся гипоксемии можно попробовать уменьшить ЧД до 10 в минуту или изменить I:E до 1:1, или же применить приём «рекрутмент», а при тяжёлом повреждении лёгких — концепцию «открытых лёгких».
При достижении приемлемой оксигенации, в первую очередь уменьшают FiO2 до 35-40%. При сохраняющейся стабильности уменьшают РЕЕР до 6-8 см вод.ст. и инспираторное давление до той величины, при которой обеспечивается нормальный ДО.
При обструктивных состояниях этот режим применять не следует.
Приём рекрутмента применяют у больных с признаками микроателектазирования, развившимся после гиповентиляции или на фоне интерстициального отёка лёгких. Так как этот приём считается достаточно жёстким и может привести к баротравме, необходимо быть уверенным в том, что паренхима лёгких не подвержена тяжёлой деструкции. Диагностическим критерием может служить рентгенография лёгких – наличие выраженных очаговых изменений будет противопоказанием для данного метода лечения.
Суть приёма заключается в достаточно быстром раздувании спавшихся – ателектазированных альвеол путём ступенчатого повышения уровня инспираторного давления и РЕЕР. Практически это осуществляется следующим образом:
— Если аппаратом предусмотрено тревога или ограничение Pmax в режимах PCV или BIPAP, то необходимо повысить границу срабатывания до 55-60 см вод.ст.;
— Каждые 20-30 секунд, т.е. после каждых 6-7 вдохов повышают инспираторное давление и РЕЕР на 3-5 cм вод.ст. Например, если при исходном инспираторном давлении 19 см вод.ст. и РЕЕР 7 см вод.ст. разница составляет 12 см вод.ст., а общее давление на вдохе — 26 см вод.ст. (20+7), то в течении 2-3 минут давление на вдохе повышают до 50 см вод.ст. При этом разница в 12 см вод.ст. сохраняется. Далее также дискретно снижают инспираторное давление и РЕЕР почти до исходных величин. При этом наблюдают за изменением сатурации – она может увеличиваться и это служит критерием эффективности приёма, т.е. расправляются ателектазированные альвеолы и улучшается оксигенация. При каком-то давлении сатурация может начать уменьшаться – это является признаком превышения необходимого давления – задавливаются легочные капилляры. После возвращения к исходным параметрам оксигенация должна повыситься, что подтверждается при контроле газов крови.
— Более жёсткий вариант рекрутмента – инспираторное давление повышают более интенсивно чем РЕЕР, т.е. разница между инспираторным давлением и РЕЕР на каждой ступени увеличивается. Соответственно увеличивается и дыхательный объём.
При любом варианте рекрутмента, после его проведения, инспираторное давление устанавливают такое, при котором обеспечивается нормальный для этого больного ДО. Следует помнить, что при вентиляции с контролем по давлению необходимо постоянно следить за величиной ДО, которая может постоянно меняться – увеличиваться при «раскрытии» альвеол или уменьшаться при ателектазировании.
При положительной динамике, когда начинает прирастать ДО, необходимо уменьшать и инспираторное давление, вентилируя больного его нормальным-расчетным ДО. При отрицательной динамике, когда ДО уменьшается, необходимо увеличивать инспираторное давление, опять же – стремясь обеспечить расчетный ДО. В течении суток требуется постоянная, чуть ли не ежечасная коррекция инспираторного давления для постоянного поддержания нормального-расчетного ДО.
Концепция открытых лёгких
Этот приём считается более щадящим и применятся при тяжёлом или очаговом паренхиматозном поражении лёгких.
Тактика его проведения аналогична рекрутменту, но повышение инспираторного давления и РЕЕР осуществляют с интервалом 20-30 минут на величину 2-3 см вод.ст. Проводится постоянный контроль сатурации и гемодинамики. В какой-то момент альвеолы раскрываются и сатурация увеличивается. В этот момент прекращают приращивание давления и начинают его снижать до исходных величин таким же темпом и с той же дискретной величиной.
Если во время прироста давления возникают или усугубляются гемодинамические расстройства, то проведение приёма прекращают. После стабилизации состояния на фоне кардиотонической поддержки и инфузионной терапии, приём проводят повторно.
Санация трахеобронхиального дерева (ТБД)
Своевременная и правильная санация ТБД является непременным условием поддержания проходимости дыхательных путей. Значение данной процедуры трудно переоценить. Без поддержания достаточной проходимости дыхательных путей невозможно говорить об обеспечении приемлемой внешней вентиляции, оксигенации и вообще об эффективности ИВЛ. Процедура аспирации секрета и мокроты из трахеи и бронхов на первый взгляд кажется очень простой, но к ней надо подходить ответственно и выполнять по определенным общепринятым правилам и протоколам.
Показания к аспирационной санации устанавливаются персоналом на основании признаков скопления мокроты у больного во время ИВЛ:
— хаотичные кашлевые движения пациента;
— видимая мокрота через прозрачную стенку эндотрахеальной трубки;
— увеличение пикового давления при объемной вентиляции;
— появление крупнопузырчатых хрипов при аускультации над областью трахеи;
Оборудование и принадлежности для аспирации:
— вакуумный отсос с регулятором отрицательного давления и емкостью для отсасываемой жидкости;
— одноразовый стерильный аспирационный катетер с мягким эластичным наконечником, дополнительным боковым дистальным отверстием и Т-образной вставкой в основании катетера с отверстием вакуум-контроля; наружный диаметр аспирационного катетера не должен превышать половину внутреннего диаметра эндотрахеальной или трахеостомической трубки;
— стерильные медицинские перчатки;
— стерильный физиологический раствор (для промывания катетера и/или возможных трахеальных инстилляций);
— мешок Амбу, подключенный к источнику кислорода.
Минимальный обязательный мониторинг во время санации включает пульсоксиметрию. По возможности также мониторируют ЭКГ и ЧСС.
Подготовка больного к санации:
1. Если планируется аспирация мокроты только из трахеи, положение больного — на спине; если планируется также санация из главных бронхов, голову больного поворачивают в сторону, противоположную санируемому бронху. Возможна также санация в положении больного на боку, особенно сразу после вибромассажа одной из половин грудной клетки.
2. За 2-3 минуты до санации увеличивают подаваемый дыхательный объем на 10-15 % (при объемной ИВЛ).
3. Проводят преоксигенацию 100 % кислородом в течение, по крайней мере, 1 минуты перед санацией.
Последовательность действий при санации:
1. Аспирационный катетер подсоединяют к шлангу вакуумного отсоса. Дистальную часть катетера извлекают из упаковки или антисептического раствора (р-р фурацилина или диоксидина) только непосредственно перед введением в трахею.
2. Устанавливают отрицательное давление (не более 70-100 см вод.ст.).
3. Коннектор эндотрахеальной (трахеостомической) трубки отсоединяют с дыхательного контура либо открывают крышку дополнительного прямоугольного адаптера.
4. Катетер осторожно вводят в эндотрахеальную (трахеостомическую) трубку на необходимую глубину, при этом отверстие в основании катетер оставляют открытым. Почувствовав препятствие, катетер далее насильно не продвигают, а наоборот, вытягивают обратно на 1-2 см.
5. Закрывают пальцем отверстие вакумконтроля в основании катетера. При этом, собственно, и происходит удаление секрета и мокроты через катетер. Длительность такой процедуры не должна превышать 10-15 секунд.
6. После извлечения катетера его промывают стерильным физиологическим раствором и вновь, при необходимости, аспирацию повторяют.
7. В процессе санации длительность отсоединения больного от респиратора не должна превышать 1 минуту.
8. При ухудшении состояния больного (резкое снижение SaО2, цианоз, бради- или тахикардия, аритмии, судороги, нарушение сознания и т. д.) санацию немедленно прекращают и возобновляют ИВЛ.
9. Если в процессе санации аспирируется очень густая слизь и/или мокрота, то рекомендуются внутритрахеальные инстилляции 5-8 мл физиологического раствора с последующей его аспирацией.
По окончании процедуры санации продолжают ИВЛ 100 % кислородом в течение 2-3 минут, после чего возвращаются к предыдущей концентрации кислорода.
В процессе длительной ИВЛ показано орошение трахеи для предотвращения скопления и загустевания мокроты. Не следует для этого применять ферментативные препараты типа хемотрипсина, т.к. они обладают определённой агрессивностью по отношению к слизистой трахеи и бронхов. Их назначение – разжижение вязкой мокроты при тяжёлой обтурации бронхов и бронхиол. Для орошения оптимально использовать раствор аминокапроновой
кислоты с добавлением антисептика или антибиотика (при гнойном эндобронхите) и гормонов.
Состав следующий:
— кислота аминокапроновая 5% — 100 мл
— физиологический раствор NaCl – 100 мл
— диоксидин 0,5% — 10 мл
— преднизолон 60 мг (дексаметазон 8 мг)
Этот раствор можно вводить с помощью ингалятора аппарата ИВЛ, инфузоматом или капельно со скоростью 2-3 капли в минуту в интубационную трубку через тонкую иголку. Можно заливать шприцом каждые полчаса по 2-3 мл. При этом хорошо разжижается мокрота и облегчается санация, предотвращается образование корочек и развитие гнойно-геморрагического эндобронхита.
Возможные осложнения процедуры санации трахеи:
— гипоксемия;
— брадикардия, остановка сердечной деятельности;
— тахикардия, аритмии сердца (в основном, экстрасистолия);
— травмирование слизистой оболочки трахеи;
— бронхоспазм;
— артериальная гипертензия, повышение ВЧД (при сопутствующих активных кашлевых толчках).
Метод аспирационной санации с отсоединением или разгерметизацией дыхательного контура широко применяется в практике ИВЛ, но имеет определенные недостатки. Во-первых, увеличивается риск инфекционных осложнений со стороны легких, трахеобронхиального дерева, так как добиться абсолютной стерильности во время процедуры невозможно.
Во-вторых, при разгерметизации контура полностью теряется уровень PEEP, что для ряда пациентов имеет принципиальное значение (особенно при PEEP > 7—8 см вод.ст.). Утрата PEEP при тяжелой рестриктивной патологии (РДСВ) способствуют экспираторному альвеолярному коллапсу и ухудшению оксигенации. После каждой процедуры санации у таких больных приходится повторять прием рекрутмента или «открытия легких». Вот почему в последние годы предпочтение отдается «закрытой» системе санации, когда стерильный катетер заключен в герметичную пластиковую оболочку и постоянно присоединен через специальный адаптер к эндотрахеальной трубке. При необходимости аспирации врач или медицинская сестра вводят катетер в трахею через оболочку, не прикасаясь к нему, и так же его извлекают. При этом контур остается герметичным, PEEP не теряется, снижается риск инфекционных осложнений со стороны больного и персонала.
После аспирационной санации трахеи проводят очистку и обработку полости рта: другим, более широким катетером аспирируют скопившуюся во рту слизь, слюну, затем дважды в сутки полость рта обрабатывают слабым раствором фурацилина или перекиси водорода.
При массивной антибактериальной терапии показано орошение слизистой оболочки рта водным раствором нистатина 2—3 раза в сутки.
При необходимости более полной и тщательной санации ТБД применяют современные гибкие фибробронхоскопы с регулируемым изгибом дистальной части.
Основными показаниями для санационной бронхоскопии являются:
— избыточная слизе- или секретопродукция в дыхательных путях;
— очень вязкая и густая мокрота;
— необходимость лаважа ТБД во время астматического статуса («немые легкие»);
— аспирационный синдром;
— аускультативное ослабление дыхания с одной из сторон легких после исключения неправильного стояния эндотрахеальной трубки и пневмо- и гидроторакса;
— необходимость удаления слизистых (гнойных) «пробок» или инородных тел из отдельных участков бронхиального дерева.
Процедуру бронхоскопии выполняют после преоксигенации 100% кислородом в течение 2—3 минут; некоторые больные требуют дополнительной седативной терапии во время бронхоскопии. При ухудшении состояния больного (гипоксемия, падение SaО2, аритмии, гемодинамические нарушения и т. д.) манипуляцию немедленно прекращают. В целом своевременно проведенная бронхоскопия является очень действенным средством поддержания проходимости дыхательных путей. В большинстве случаев после бронхоскопической санации существенно улучшаются аускультативная картина в легких, объективные показатели оксигенации и легочной механики.
Первоначально для проведения механической ИВЛ в подавляющем большинстве случаев используют интубацию трахеи эндотрахеальной трубкой. Следует только напомнить, что при наличии времени и возможности дистальную часть трубки следует смазать кортикостероидной мазью, с целью уменьшения реакции слизистой оболочки при контакте с трубкой.
Герметичность дыхательных путей достигается за счет раздувания манжеты воздухом через шприц. Давление в манжете не должно превышать 15—16 мм рт.ст., в противном случае увеличивается риск пролежней слизистой оболочки трахеи. С другой стороны, надо следить за достаточно полным раздуванием манжеты, иначе возможна утечка подаваемой дыхательной смеси, а также увеличивается риск затекания содержимого полости рта и/или пищевода в нижние дыхательные пути.
В процессе ИВЛ необходимо следить, чтобы эндотрахеальная трубка была прочно закреплена у входа в полость рта. Способы фиксации могут быть различными: с помощью медицинского пластыря, специальных креплений и т.д.
Во время ИВЛ обязательно следят за тем, чтобы эндотрахеальная трубка не перегибалась, а также не сжималась зубами больного. Для профилактики «перекусывания» трубки применяют специальные эластичные загубники, а при их отсутствии — свернутый бинт между зубами рядом с трубкой.
Имеет значение и прочность контакта коннектора эндотрахеальной трубки с ее стенкой. Если коннектор относительно свободно вращается или скользит в трубке, его необходимо срочно заменить на более широкий. Место соединения эндотрахеальной трубки с ее коннектором — одно из наиболее опасных в плане разгерметизации контура!
С целью профилактики пролежней слизистой оболочки трахеи через каждые 3-4 часа манжету частично сдувают, трубку смещают на 1-1,5 см вверх или вниз и вновь раздувают манжету. Таким образом, зона наибольшего давления манжеты на слизистую периодически меняется, что снижает риск трофических изменений.
Переинтубацию трахеи обычно проводят через каждые двое (максимум трое) суток ИВЛ. Это позволяет предотвратить интенсивную бактериальную контаминацию трубки и быть уверенным в ее проходимости.
Трахеостомия применяется при длительной ИВЛ, а также изначально в случаях, когда интубация трахеи значительно затруднена или невозможна.
Необходимо отметить, что единого мнения о сроках перехода с эндотрахеальной интубации на трахеостомию во время длительной ИВЛ до сих пор нет. При адекватном уходе и своевременной переинтубации эндотрахеальная трубка может оставаться в трахее без серьезных осложнений до 2 недель и более. Но это скорее исключение, чем правило. К явным недостаткам длительного нахождения эндотрахеальной трубки, безусловно, относятся:
— раздражающее действие на ротоглотку, гортань, постоянно открытый рот, что особенно плохо переносят больные в сознании;
— худшие условия для обработки полости рта;
— далеко не всегда адекватная аспирационная санация ТБД, особенно при большом количестве мокроты;
— невозможность глотания, что исключает энтеральное питание через рот без гастрального зонда;
— при интубации через нос — частое развитие синуситов, в том числе гнойных.
В тоже время больные (особенно в сознании) значительно лучше переносят наличие трахеостомической трубки, чем эндотрахеальной. Она позволяет им закрывать рот, самостоятельно глотать слюну, воду, пищу. Через трахеостому легче и лучше проводить санацию ТБД, при отсоединении от контура больные самостоятельно и относительно легко откашливают мокроту, что затруднительно при эндотрахеальной интубации. Сопротивление трахеостомической трубки значительно меньше, чем эндотрахеальной, так как она короче и, как правило, шире — это обстоятельство облегчает спонтанное дыхание больного при его отключении от аппарата в процессе «отучения» от ИВЛ.
Можно считать, что вопрос о трахеостоме нужно радикально решать не позже чем на 5-6-й день ИВЛ. Если врач считает, что ИВЛ продлится еще в течение не более 2—3 суток, большого смысла выполнять трахеостомию нет и целесообразно заканчивать ИВЛ на эндотрахеальной трубке. Если же явно предполагается более длительная ИВЛ, то рекомендуется безотлагательная трахеостомия.
Таким образом, предпочтительным способом доступа к дыхательным путям при длительной ИВЛ является трахеостомия, а при ИВЛ до 6-7 дней — эндотрахеальная трубка.
Список литературы
1. Сатишур О.Е. Механическая вентиляция лёгких. М.: Мед.лит., -2006 г.
2. Белебезьев Г.И., Козяр В.В. Физиология и патофизиология искусственной вентиляции легких. Киев, -2003 г.
3. Бутылин Ю. П., Бутылин В. Ю., Бутылин Д. Ю. Интенсивная терапия неотложных состояний. Киев. 2003 г.
4. Вайман В.А., Аваков В.Е. Критические и неотложные состояния в медицине.
5. Гриппи М. А., Патофизиология легких. Санкт-Петербург. 2001 г.
6. Зильбер А. П., Этюды критической медицины, том II, Респираторная медицина. Петрозаводск. 1996 г.
7. Кассиль В. Л., Лескин Г. С, Выжигина М. А., Респираторная поддержка. Москва «Медицина». 1997 г.
8. Малышева В. Д., Интенсивная терапия. Москва «Медицина». 2003 г.
9. Шурыгин И. А., Мониторинг дыхания в анестезиологии и интенсивной терапии. Санкт-Петербург. 2003 г.
Внимание!
Если вы не являетесь медицинским специалистом:
-
Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
-
Информация, размещенная на сайте MedElement и в мобильных приложениях «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта», не может и не должна заменять очную консультацию врача.
Обязательно
обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
-
Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может
назначить
нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
-
Сайт MedElement и мобильные приложения «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта» являются исключительно информационно-справочными ресурсами.
Информация, размещенная на данном
сайте, не должна использоваться для самовольного изменения предписаний врача.
-
Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший
в
результате использования данного сайта.
