Ключевые слова:
антимикробная активность
альтернативные модели
вирулентность
антибиотикочувствительность
В последние годы в качестве альтернативной модели для изучения бактериальных инфекций, а также для оценки эффективности антибактериальных препаратов широко используют Galleria mellonella — личинки большой восковой моли. Преимущества данной модельной системы — отсутствие биоэтических ограничений, возможности использования большого количества животных в эксперименте, короткий жизненный цикл. Личинки могут расти при широком температурном диапазоне (18–37 °C), что позволяет исследовать на данной модели патогены человека, которым в большинстве случаев необходима инкубация при 37 °C. Несмотря на отсутствие у насекомых приобретенного иммунитета, врожденный иммунитет восковой моли имеет значительное сходство с иммунным ответом позвоночных животных, в том числе и человека.
Цель работы — разработка модели бактериальной инфекции личинок большой восковой моли, включающая сравнительную оценку как эффективности заражения личинок эталонными штаммами микроорганизмов и их клиническими изолятами, так и применения препаратов Рифампицин (ПАО «Красфарма», Россия) и Ципрофлоксацин (Эльфа Лабораториз, Индия) на инфицированных личинках.
Данное исследование предусматривало три последовательных этапа, на I этапе проводили сравнительную оценку вирулентности эталонных штаммов Staphylococcus aureus, Streptococcus pneumoniae, Escherichia coli и их клинических изолятов, а также определяли инфекционную дозу бактериальной суспензии для инъекции личинкам. Таким образом, было установлено, что исследуемые клинические изоляты St. aureus, Str. pneumoniae и E. coli оказались более вирулентными относительно эталонных штаммов микроорганизмов.
На II этапе исследования определяли минимально подавляющую концентрацию in vitro для каждого штамма микроорганизма, что позволяло определить чувствительность штаммов к исследуемым антибиотикам, а именно ципрофлоксацину и рифампицину.
На III этапе после заражения личинок инфекционной дозой была проведена антибактериальная терапия, при этом полученные результаты подтвердили данные II этапа in vitro. Наблюдали гибель личинок, зараженных резистентными штаммами St. aureus и E. coli к ципрофлоксацину и рифампицину соответственно.
Данная модель характеризовалась изменением общего состояния личинок (меланизация, подвижность, образование кокона) и гибелью животных в зависимости от концентрации микроорганизмов в инокулюме. Продемонстрировано, на сколько данная модель применима для оценки чувствительности бактерий к антибиотикам на примере ципрофлоксацина и рифампицина.
Введение
Доклинические исследования эффективности и безопасности лекарственных средств проводят с использованием лабораторных животных, обеспечивающих возможность переносить полученные результаты на человека. В качестве таких тест-систем наиболее часто используют грызунов — мышей, крыс. Однако при проведении исследований на животных необходимо учитывать этические принципы и большую стоимость данных разработок.
Помимо стандартных моделей исследований с применением лабораторных грызунов существуют альтернативные модели, использующие в качестве тест-системы беспозвоночных животных. Данные модели не могут полностью заменить исследования на млекопитающих, но они применяются в качестве дополнительных для расширения знаний о бактериальном патогенезе, изучения вирулентности микроорганизмов, а также открытия новых антибактериальных соединений.
Для изучения бактериальных инфекций, а также для оценки эффективности антибактериальных препаратов широко используются личинки большой восковой моли [1]. Большая восковая моль Galleria mellonella — один из традиционных объектов лабораторных исследований [2]. Отсутствие биоэтических ограничений и возможность применения большого количества личинок в эксперименте позволяют большой восковой моли быть модельным объектом в следующих тестах:
1) определение микробной вирулентности и патогенности микроорганизмов;
2) определение ЛД50 (среднелетальная доза) вещества;
3) фармакокинетика;
4) тестирование эффективности противомикробных средств на зараженных личинках.
Несмотря на отсутствие у насекомых приобретенного иммунитета, врожденный иммунитет восковой моли имеет значительное сходство с иммунным ответом позвоночных животных, в том числе и человека [3]. Эти характеристики делают G. mellonella удобным объектом для оценки вирулентности бактерий, а также исследований на чувствительность к антибиотикам, в частности, штаммов Staphylococcus aureus, Streptococcus pneumoniae и Escherichia coli [4, 5].
Цель данного исследования — разработка модели бактериальной инфекции личинок большой восковой моли, включающая сравнительную оценку эффективности не только заражения личинок эталонными штаммами микроорганизмов и их клиническими изолятами, но и применения препаратов Рифампицин (ПАО «Красфарма», Россия) и Ципрофлоксацин (Эльфа Лабораториз, Индия) на инфицированных личинках.
Материал и методы
Личинки большой восковой моли
В качестве биологической тест-системы использовали личинки большой восковой моли G. mellonella. В исследование отбирали личинки в возрасте 5 нед, массой 200–300 мг. Личинки большой восковой моли до начала эксперимента содержали на искусственном субстрате (22% кукурузной муки, 22% зародышей пшеницы, 11% сухих дрожжей, 17,5% пчелиного воска, 11% меда и 11% глицерина) при температуре 2–8 °C в затемненных контейнерах для замедления созревания и перехода в стадию куколки [6]. После заражения личинки помещали в чашках Петри без субстрата, затем — в термостат при температуре 37 °C на 5 сут [7]. Распределение животных на группы по 10 личинок в каждой проводили методом слепой рандомизации [8]. Исследование выполняли в соответствии с принципами 3Rs, то есть осуществили замену лабораторных животных на альтернативную модель более низкой филогенетической группы. Проведение исследования было одобрено экспертной комиссией (ЭК) АО НПО «ДОМ ФАРМАЦИИ» (протокол ЭК № 8/21).
Микроорганизмы
В качестве инфекционных агентов были выбраны эталонные штаммы микроорганизмов из Американской коллекции типовых культур (American Type Culture Collection, ATCC): E. coli ATCC 25922 (ВКПМ В-8076), St. aureus ATCC 29213, Str. pneumoniaе ATCC 6303, а также их клинические изоляты: E. coli ENV 194, St. aureus SA 0077 (MRSA), Str. pneumoniaе 1068 19 А. Музейные тест-штаммы и клинические изоляты, используемые в исследовании перед началом эксперимента, были активированы высевом в гидролизат говяжьего мяса ферментативного (ГМФ-бульон) с последующим пересевом на соответствующий питательный агар: ГМФ-агар, колумбийский агар.
Определение инфекционной дозы
Заражение штаммами E. coli, Str. pneumoniaе, St. aureus проводили в 1‑й день эксперимента путем введения бактериального инокулюма в гемоцель через последнюю левую ложноножку с помощью микрошприца Hamilton (Hamilton, СШA) 10 мкл [9]. Для удобства введения инокулюма личинки были обездвижены путем помещения на 15 мин в холодильную камеру при температуре 2–8 °С. Для создания оптимальных условий развития патогена после заражения личинки содержали в термостате при температуре 37 °C [6, 9]. Инфекционная доза определялась как доза, вызывающая иммунный ответ, распознаваемый по потемнению кутикулы, а также 60–80% летальность [9].
Регистрация показателей здоровья личинок
Для оценки заражения штаммами микроорганизмов проводили учет показателей здоровья личинок (в соответствии с табл. 1 и рис. 1). Было оценено состояние здоровья личинок путем присвоения баллов по 4 основным показателям: подвижность личинок, образование коконов, меланизация и выживаемость [7]. При оценке подвижности личинки использовали в качестве стимула стерильные одноразовые петли.


Личинки признавали мертвыми, если они не проявляли реакции (движений) на прикосновение. Оценку выживаемости проводили методом построения кривой Каплана–Мейера. Летальность и учет показателей здоровья личинок оценивали каждые 24 ч [6, 7, 10, 11].
Определение антимикробной активности in vitro
На данном этапе исследования определяли чувствительность используемых штаммов микроорганизмов к рифампицину и ципрофлоксацину in vitro для дальнейшего исследования эффективности лечения данными препаратами инфицированных личинок. Определение антимикробной активности исследуемых объектов проводили методом микроразведений в планшетах с определением минимальной подавляющей концентрации (МПК). Для метода микроразведений грамположительных и грамотрицательных микроорганизмов использовали бульон Мюллера–Хинтона [12], для микроорганизма Str. pneumoniae — бульон Мюллера–Хинтона с добавлением 5% лизированной бараньей крови [13, 14].
На данном этапе изучали тестируемые объекты ципрофлоксацин и рифампицин. Рифампицин активен в отношении грамположительных микроорганизмов Streptococcus spp. и Staphylococcus spp., а также является стандартным средством лечения метициллинрезистентного стафилококка (S. aureus MRSA). Однако по отношению к грамотрицательным микроорганизмам E. coli рифампицин менее активен. К ципрофлоксацину чувствительны грамотрицательные аэробные микроорганизмы E. coli, также он активен в отношении грамположительных микроорганизмов Streptococcus spp. и Staphylococcus spp. Однако большинство стафилококков, устойчивых к метициллину (S. aureus MRSA), резистентны к ципрофлоксацину [15, 16].
Приготовление рабочих растворов исследуемых объектов осуществляли с использованием бульона Мюллера–Хинтона. Были изучены концентрации от 0,007 до 512 мкг/мл. Планшеты инкубировали при температуре 34–37 °С в течение 18±2 ч [12]. После инкубации визуально оценивали наличие или отсутствие роста микроорганизмов в лунках планшетов. МПК исследуемых объектов соответствовала лунка с наименьшей концентрацией исследуемых объектов без признаков видимого роста тест-микроорганизмов.
Антибактериальная терапия инфицированных личинок
Личинок большой восковой моли заражали инфекционной дозой, установленной на I этапе эксперимента в последнюю левую ложноножку, затем инкубировали в термостате при температуре 37 °C. Через 2 ч вводили тестируемые препараты в последнюю правую ложноножку и продолжали инкубацию.
Согласно инструкции по медицинскому применению (ИМП) препарата Рифампицин в виде лиофилизата для приготовления раствора для инфузий (150 мг) [15], максимальная суточная доза 600 мг, что при пересчете на 1 кг массы тела взрослого человека составляет:
Терапевтическая доза = 600 мг/60 кг (средняя масса тела человека) = 10 мг/кг.
Терапевтическая доза (ТД) ципрофлоксацина, согласно инструкции по медицинскому применению, также равна 10 мг/кг [16].
Расчет концентрации (С) инъекции антибиотика проводили по формуле:
Cинъекции = (Cin vivo×Vличинки)/Vинъекции,
где Cинъекции — концентрация тестируемого объекта в инъекции; Cin vivo — концентрация тестируемого объекта в личинке; Vличинки — объем личинки, Vличинки=0,3 мл; Vинъекции — объем инъекции, Vинъекции=10 мкл.
При перерасчете концентрации ципрофлоксацина на личинку с учетом отношения массы гемолимфы личинки к ее объему, приблизительно равному единице [17], соответствует:
10 мг/кг = 10 мкг/г = 10 мкг/мл = Cin vivo.
Концентрация вводимого препарата для личинки:
Cинъекции = (10 мкг/мл×0,3 мл)/0,01 мл = 300 мкг/мл.
Таким образом, было исследовано 3 дозы: 1/2 ТД; ТД; ТД×2.
В каждой исследуемой группе было по 10 личинок, причем в каждый первый день использовали 3 контрольные группы: интактную, травмированного контроля (нарушение целостности кутикулы, прокалывание иглой) и контрольную с введенным буфером (PBS). Также были добавлены контрольные группы для тестируемых препаратов, чтобы исключить токсическое влияние самих антибиотиков. На протяжении всего III этапа осуществляли регистрацию гибели ежедневно с балльной системой учета показателей здоровья (см. табл. 1).
Эвтаназия
Эвтаназию всех использованных в эксперименте личинок большой восковой моли проводили путем погружения в 70% раствор этилового спирта в последний, 5‑й день эксперимента [18].
Анализ данных
Для данных, полученных на I этапе исследования, был применен анализ выживаемости методом Каплана–Мейера с последующей оценкой межгрупповых различий логранговым тестом Мантела–Кокса с построением кривой выживаемости.
Различия считали достоверными при уровне значимости р<0,05. Статистический анализ выполняли с помощью программного обеспечения Prism 9 (GraphPad Software, СШA).
Расчет летальных доз (ЛД50 и ЛД70) проводили с помощью пробит-анализа по Прозоровскому [19].
Результаты и обсуждение
I этап — моделирование патологии
На протяжении всего эксперимента (до заражения, в 1‑й день и далее каждые 24 ч до эвтаназии) проводили учет показателей здоровья личинок (см. табл. 1).
До заражения у личинок всех экспериментальных групп наблюдали активное движение и способность к коконообразованию, меланизация отсутствовала.
При учете показателей здоровья через 24 часа после контрольного укола и введения индукторов патологии в интактной группе не установлено признаков угнетения личинок. Все личинки проявляли умеренную активность с возможностью коконообразования. Меланизация и гибель отсутствовали (рис. 2).
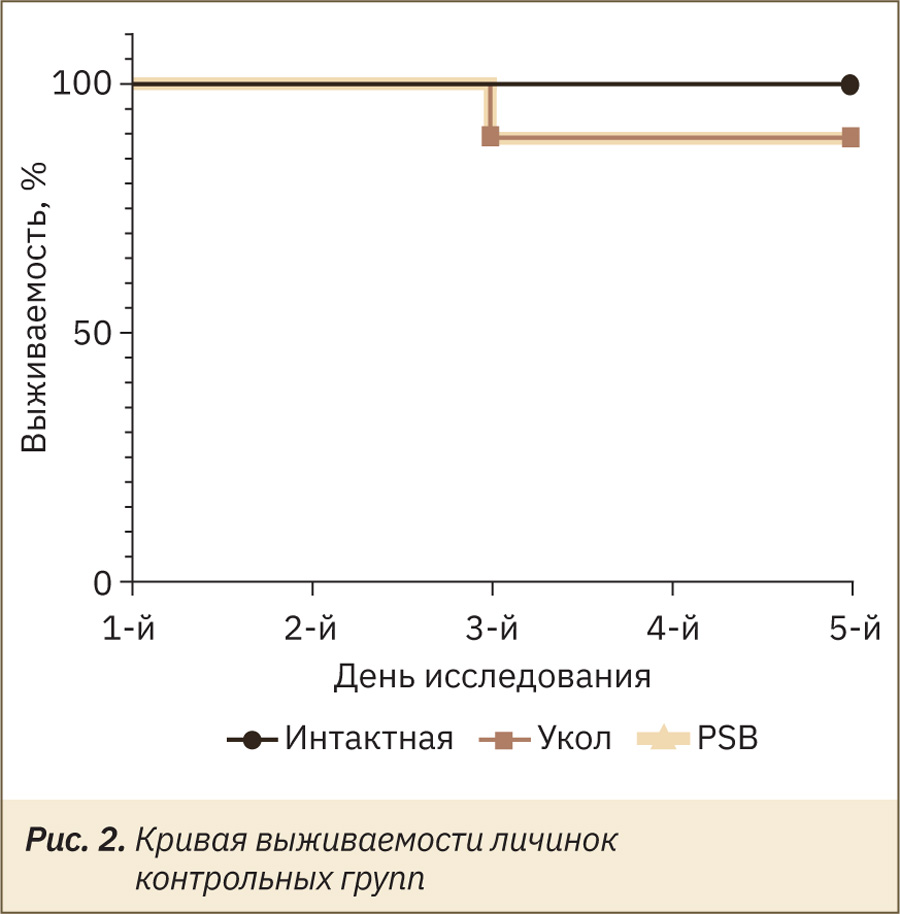
Во всех группах с нарушением целостности покровов регистрировали единичные случаи гибели личинок. В группах с контрольным проколом и с введенным фосфатно-солевым буфером регистрировали гибель одной личинки в каждой группе. Оставшиеся в живых личинки не отличались по своим жизненным показателям от интактных (рис. 3).

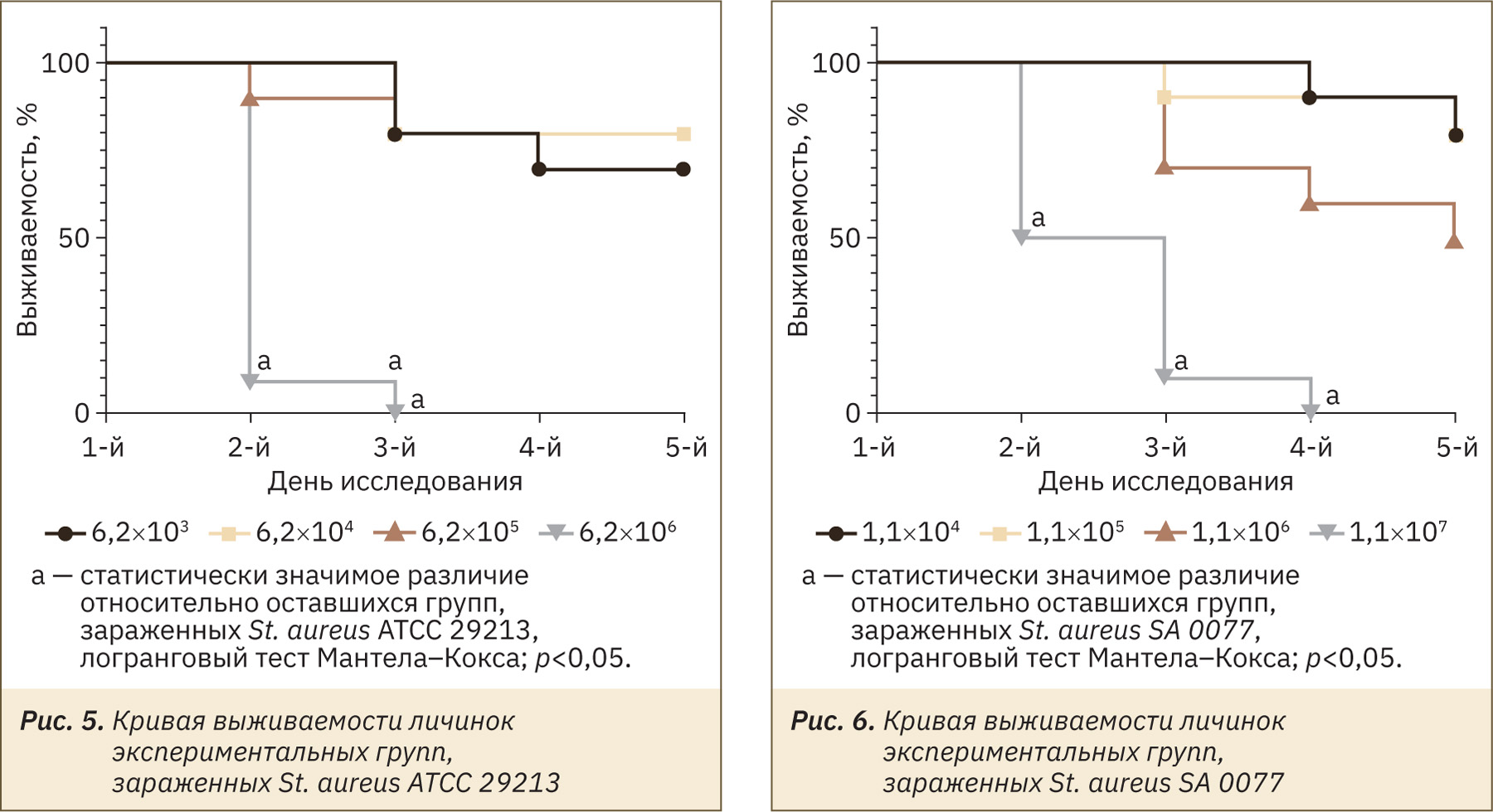
В группах, зараженных инокулюмом в более низких концентрациях, наблюдали гибель нескольких личинок (рис. 4). Выжившие личинки были в основном активны, меланизация либо отсутствовала, либо была слабо выражена, способность к коконообразованию сохранилась. С увеличением концентрации инокулюма, смертность в группах значительно возрастала (рис. 5, 6). У оставшихся в живых личинок регистрировали снижение активности, потемнение кутикулы и угнетение способности коконообразования (см. рис. 4). У погибших личинок отмечали полное почернение покровов тела (рис. 7).

Для оценки вирулентности штаммов было принято решение рассчитать летальные дозы с использованием пробит-анализа по Прозоровскому (табл. 2).
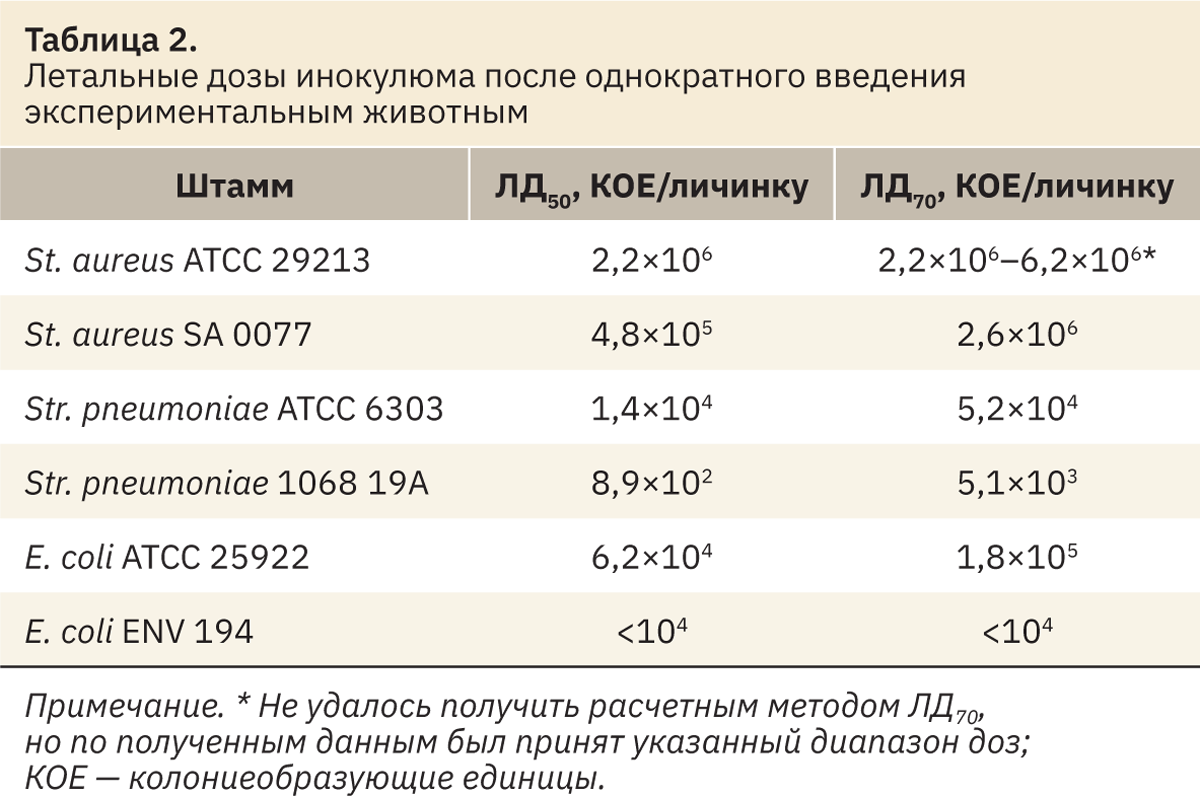
Исходя из полученных значений ЛД50, можно сделать заключение, что клинические изоляты являются более вирулентными относительно соответствующих эталонных штаммов.
Для заражения и дальнейшего лечения личинок большой восковой моли была установлена инфекционная доза. За инфекционную дозу бактерий приняли дозу, вызывающую 60–80% летальность. Исходя из расчетов летальной дозы (ЛД70), были выбраны дозы для инфицирования и дальнейшей антибактериальной терапии личинок на III этапе исследования.
II этап — определение МПК
Через 18 ч после инкубации планшетов оценивали антимикробную активность рифампицина и ципрофлоксацина в отношении используемых штаммов микроорганизмов. Для подтверждения вносимого количества клеток микроорганизмов в лунки планшетов в день постановки теста проводили высев содержимого лунки на чашки Петри. Контроль посевной дозы подтвердил необходимое количество клеток, вносимых в лунки планшетов, для бактерий в диапазоне 2×105–8×105 КОЕ/мл [13].
Также вместе с контролями посевных доз проводили учет результатов с 96‑луночных планшетов. Результаты учитывали визуально в проходящем свете. Данные оценки антимикробной активности сравнивали со значениями ECOFF (Epidemiological cut-off value, эпидемиологическое пороговое значение), представленными EUCAST (European Committee on Antimicrobial Susceptibility Testing, Европейский комитет по тестированию чувствительности к антимикробным препаратам), полученные сведения отображены в табл. 3.
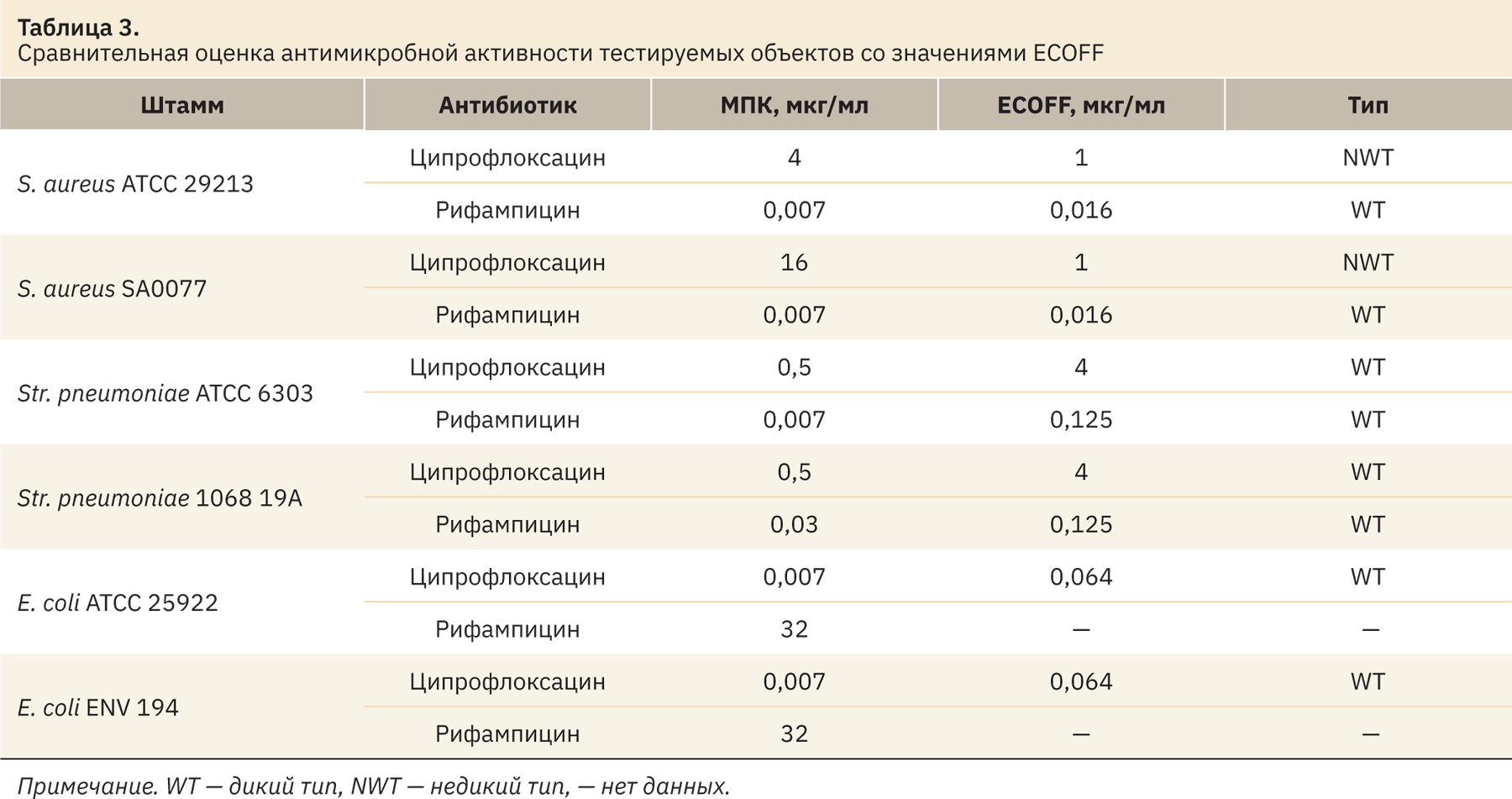
При сравнении полученных значений МПК и ECOFF можно сделать выводы о чувствительности микроорганизмов к антибиотикам.
Клинический изолят S. aureus SA0077 по паспорту является метициллинрезистентным золотистым стафилококком (MRSA) соответственно, штамм оказался устойчивым к ципрофлоксацину и чувствительным к рифампицину. Эталонный штамм S. aureus ATCC 29213 также чувствителен к рифампицину и начал вырабатывать устойчивость к ципрофлоксацину. Str. pneumoniae, эталонный штамм и клинический изолят оказались оба чувствительными к исследуемым антибиотикам. E. coli, как и ожидалось, был чувствителен к ципрофлоксацину и устойчив к рифампицину.
III этап — антибактериальная терапия
На III этапе исследования проверяли работу антибиотиков in vivo, заражали личинок большой восковой моли инфекционной дозой, а затем осуществляли антибактериальную терапию. При этом, как и на I этапе, проводили учет показателей здоровья личинок до заражения, в 1‑й день и далее каждые 24 ч. До заражения все личинки были активны и способны к коконообразованию, меланизация отсутствовала.
В 1‑й день эксперимента заражали личинок большой восковой моли соответствующими инфекционными дозами для каждого исследуемого штамма. Расчетные и фактически полученные концентрации инокулюмов представлены в табл. 4.

Концентрация инокулюма у штаммов Str. pneumoniae ATCC 6303, Str. pneumoniae 1068 19A, E. coli ENV 194 превысила расчетные концентрации на порядок, однако антибактериальная терапия все же оказалась эффективной относительно негативного контроля — инфицированных личинок без лечения.
При учете показателей здоровья через 24 ч после контрольного укола и введения индукторов патологии в контрольных группах не установлено признаков угнетения личинок. Все личинки проявляли умеренную активность с возможностью коконообразования. Меланизация и гибель отсутствовали, за исключением гибели одной личинки в группе контрольного прокола. Сумма баллов при оценке показателей здоровья в течение 5 дней наблюдения не была ниже 87,5. Также в группах контроля токсичности антибиотика гибель не зарегистрирована, личинки чувствовали себя хорошо — сумма баллов здоровья не ниже 91 из 100. В негативном контроле (зараженные личинки без лечения) регистрировали значительную гибель, потемнение кутикулы и снижение активности.
Как и ожидалось по результатам исследования in vitro, ципрофлоксацин оказался неэффективным, а рифампицин был действенным во всех концентрациях относительно микроорганизма St. aureus. Рифампицин in vivo чуть лучше воздействовал на инфекцию, вызванную эталонным штаммом St. aureus ATCC 29213, чем клиническим изолятом SA 0077. Оценка (в баллах) здоровья личинок, получавших антибактериальную терапию рифампицином, была значительно выше, чем в негативном контроле, что подтверждает действие антибиотика по отношению к штамму St. aureus SA 0077 (рис. 8).
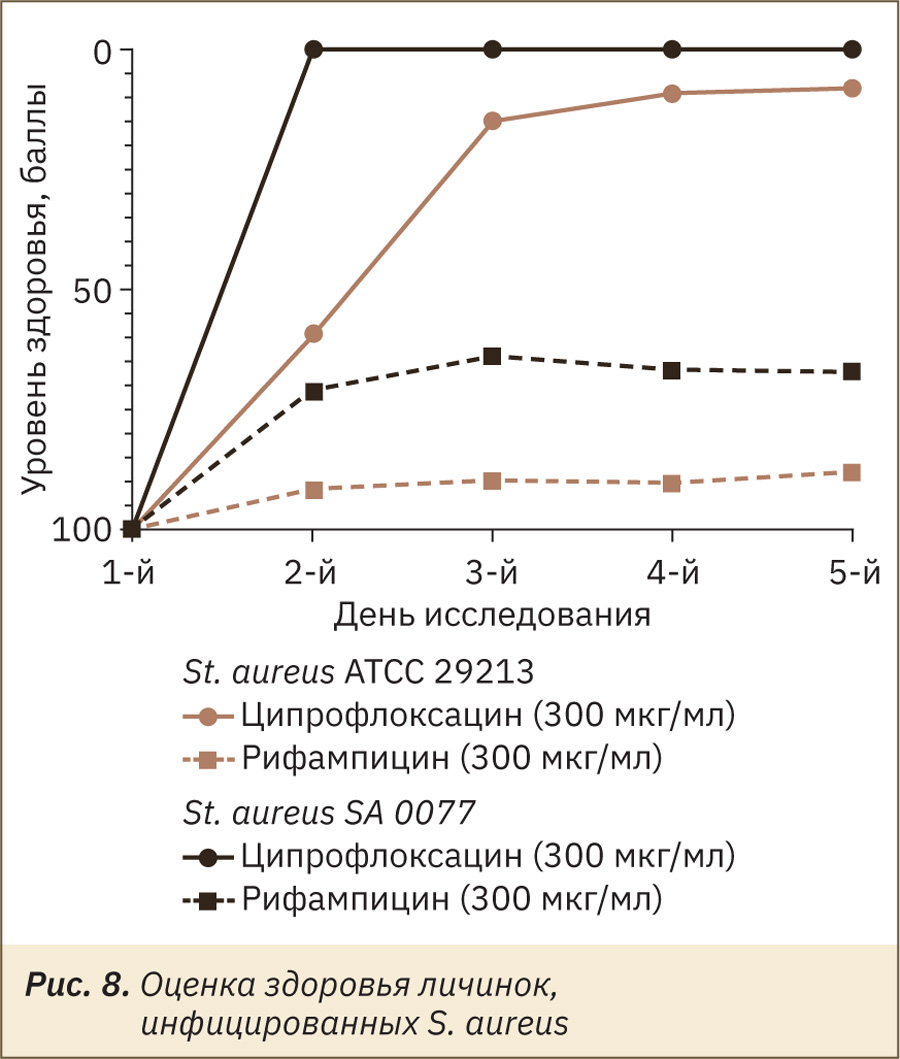
Штаммы Str. pneumoniae оказались чувствительны по отношению к исследуемым антибиотикам во всех концентрациях. Установлено, что на уровень здоровья личинок эталонный штамм Str. pneumoniae ATCC 6303 и клинический изолят Str. pneumoniae 1068 19A влияли одинаково (рис. 9).

Из II этапа следует, что штамм E. coli устойчив по отношению к рифампмцину, что можно увидеть на графике при оценке уровня здоровья (рис. 10), однако к ципрофлоксацину E. coli был чувствителен во всех концентрациях.
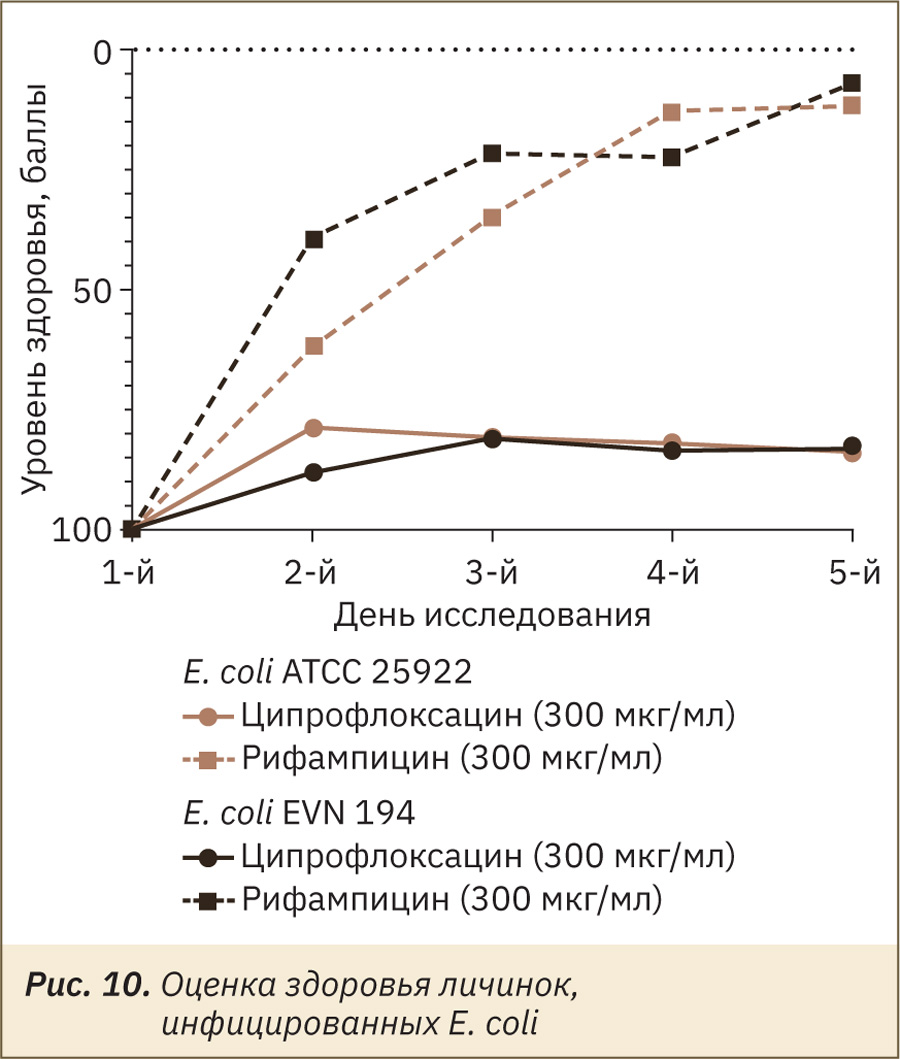
Таким образом, антибактериальная терапия во всех трех исследуемых дозах, рассчитанных исходя из терапевтических, оказалась эффективной. Как и ожидалось, in vivo наблюдали резистентность S. aureus по отношению к ципрофлоксацину, E. coli — к рифампицину.
Заключение
В рамках проведенного эксперимента была разработана модель бактериальной инфекции личинок Galleria mellonella на примере эталонных штаммов Escherichia coli, Staphylococcus aureus, Streptococcus pneumoniae и их клинических изолятов. Модель характеризовалась изменением общего состояния личинок (меланизация, подвижность, образование кокона) и гибелью животных в зависимости от дозы микроорганизмов.
Было установлено, что исследуемые клинические изоляты Staphylococcus aureus, Streptococcus pneumoniae и Escherichia coli оказались более вирулентными относительно эталонных штаммов микроорганизмов при инфицировании личинок Galleria mellonella. Штаммы микроорганизмов, оказавшиеся резистентными к антибиотикам в исследовании in vitro, приводили к гибели личинок на фоне антибактериальной терапии теми же антибиотиками.
Таким образом, совокупность полученных результатов продемонстрировала применимость в качестве модельного объекта личинок Galleria mellonella для оценки эффективности антибактериальных препаратов.
Авторы заявляют об отсутствии конфликта интересов.
Ю.В. Салмова — дизайн исследования, выполнение экспериментальной части, сбор и систематизация материала, анализ и статистическая обработка данных, написание текста статьи.
Л.Р. Никифорова — выполнение экспериментальной части, сбор и систематизация материала.
К.Е. Боровкова — концепция исследования, редактирование текста статьи.
Галлерия Мелонелла (огнёвка) Здравница: инструкция и применение
Восковая моль — это единственное на земле живое существо, личинки которого способны переваривать и усваивать пчелиный воск. Помимо основной своей пищи — воска, личинки употребляют в пищу цветочную пыльцу, пергу, восковую сушь, мед в сотах, прополис, маточное молочко, хитин пчелы.
Поэтому она обладает кумулятивным (накопительным) свойством в отношении биологически активных продуктов пчеловодства (БАП). Первые исторические сведения об использовании личинок «золотой бабочки» в медицинских целях восходят к античным временам Древней Греции, Египта, Месопотамии. В данном случае личинке Galleria melonella пристальное внимание уделял лауреат Нобелевской премии великий русский ученый И. И. Мечников (премия вручена за открытие и обоснование фагоцитарной теории иммунитета в 1908 году), который в конце XIX века пытался изобрести эффективное противотуберкулезное средство.
Много сил и энергии изучению экстракта личинок восковой моли отдал С. А. Мухин, излечившийся им от туберкулеза. в 1961 году.
Около 7 лет назад в г. Барнауле исследовательская группа (руководитель Г. В. Якубко) разработала и наладила производство экстракта из личинок «Galleria melonella» в виде биологически активной добавки.
Личинок большой восковой моли выращивают по оригинальной методике (Г.В. Якубко). Во время максимальной активности роста личинок материал подвергается сложной многоступенчатой обработке с экстракцией действующих веществ и получением готового продукта. Такая методика предполагает максимально полное и длительное сохранение фармакологической активности препарата.
Состав экстракта содержит: ферменты, нуклеотиды, нуклеозиды, высокомолекулярные белки, пептиды, ксантин и гипоксантин, серотониноподобные вещества, значительное количество микроэлементов, витамины, 20 из 28 свободных аминокислот, (в том числе 9-незаменимых аминокислот), липиды и высшие жирные кислоты (в том числе незаменимые — линолевая и линоленовая).
Установлена выраженная стимуляция поглотительной и переваривающей способности клеток защиты — макро- и микрофагов, а также стимуляция продукции гуморальных факторов иммунитета. Нормализуется содержание иммуноглобулинов G и М и циркулирующих иммунных комплексов.
Обнаружено антиоксидантное действие, которое обеспечивается аминокислотами — цистеином и метионином. Они входят в состав антиоксидантных ферментов — метионинпироксидазы, глютатионпироксидазы и белка глютатиона, препятствующих перекисному окислению липидов и макромолекул организма. Это свойство препятствует стрессорному повреждению тканей и развитию атеросклероза, благодаря чему препарат эффективен как кардиопротекторное средство для профилактики и вспомогательного лечения ИБС.
Препарат содержит фермент сериновую протеазу, который обладает мощным лизирущим эффектом. Экстракт является антибактериальным и противовирусным препаратом широкого спектра действия. Установлена бактерицидная активность препарата.
Противовирусная защита организма обусловлена аминокислотой лизином и биофлавоноидами. Аминокислоты — гистидин и метионин защищают организм от ионизирующей радиации и интоксикации. Благодаря наличию пальмитиновой, линолевой и линоленовой кислот, экстракт обладает антиандрогенным действием.
Таким образом, Galleria melonella — перспективный продукт пчеловодства для укрепления и оздоровления организма человека. Не имеет противопоказаний к применению; не вызывает выраженных проявлений аллергии и других побочных реакций.
-
Состав
настойка личинок восковой моли
-
Способ применения
Употреблять по 1-й капле (при тяжести заболевания по 3 капли) на 10 кг массы тела 2 раза в день за 30 минут до еды п оформуле: 21 день пить — 7 дней перерыв, 21 день пить — 14 дней перерыв, 21 день пить — 21 день перерыв.
Рекомендуется цикл 2 раза в год — весна и осень.
-
Срок годности
2 года
-
Упаковка
стекло
-
Форма выпуска
жидкость
Ищите где купить Галлерия Мелонелла (огнёвка)?
Вы можете приобрести Галлерия Мелонелла (огнёвка) по выгодной цене в интернет-аптеке Здравница.
Оформить заказ легко — укажите необходимое количество товара и нажмите кнопку «В корзину» или позвоните по бесплатному номеру 8-800-302-1165. Наши менеджеры также примут у вас заказ в онлайн-чате, Telegram или WhatsApp.
Получить заказ вы можете в пункте выдаче заказов, в отделении почты или же его доставят на указанный вами адрес.
Оплата возможна при получении или непосредственно на сайте в момент оформления заказа. По предопате мы предоставляем скидку на продукцию.
Ознакомьтесь с инструкцией по применению, прочтите отзывы и если возникнут вопросы — наши консультанты с радостью на них ответят в чате или по телефону.
Мы гарантируем подлинность продукта, так как работаем напрямую с производителем Здравница. Это позволяет нам деражть низкий уровень цен и высокое качество обслуживания.
УДК [611.08:611.018.5:615.324]:615.451.3 DOI 10.18286/1816-4501-2022-2-114-119
АНАЛИЗ ЭФФЕКТИВНОСТИ ФРАКЦИИ ПРОДУКТОВ ЖИЗНЕДЕЯТЕЛЬНОСТИ GALLERIA MELLONELLA L. ПРИ СТРЕССЕ В ЭКСПЕРИМЕНТЕ
Осокина Анастасия Сергеевна1, кандидат биологических наук, старший научный сотрудник Гущин Александр Владимирович2, директор
Михеева Екатерина Александровна, кандидат ветеринарных наук, доцент, ФГБОУ ВО Ижевская ГСХА,
Удмуртский Федеральный исследовательский центр УрО РАН Ижевск, Россия, e-mail: [email protected] 2ООО «М-Технология», Ижевск, e-mail: [email protected] 3Ижевск, Россия, e-mail: [email protected]
Ключевые слова: острый стресс, адаптация, продукты жизнедеятельности личинки Galleria mel-lonella, морфометрия надпочечников, показатели крови
Цель исследования — изучение уровня стресса по показателям периферической крови и гистологии внутренних органов мышей при применении различных фракций экстракта на основе продуктов жизнедеятельности (ПЖ) личинок Galleria mellonella L. Для проведения опыта были сформированы три группы лабораторных мышей по принципу пар-аналогов (n=5). Экстракт легкой фракции ПЖ и 40% раствор спирта (контроль) вводили трансдермально через кожу хвоста мышей с интервалом через день в течение 30 суток по 5 мкл на голову. Для проведения опыта выбран способ экспериментального моделирования общей гипертермии. Обнаружены статистические значимые различия показателей лейкоцитарной формулы мышей опытной группы легкой фракции ПЖ личинок G. mellonella по сравнению с контролем. Сумма юных и палочковидных нейтрофилов в контрольной группе больше, чем этот же показатель в опытной группе, что свидетельствует о стимуляции выработки нейтрофилов в контрольной группе мышей, а это обычно связано с наличием патологических процессов в организме. Полученные нами данные свидетельствуют о реактивности и мобилизации защитных сил организма мышей под влиянием легкой фракции продуктов жизнедеятельности личинок G. mellonella, в связи с чем повышается стрессоустойчивость мышей. При трансдермальном введении раствора легкой фракции происходит уменьшение пучковой зоны, что может приводить к уменьшению секреции глюкокортикоидов. Полученные результаты являются основой для дальнейших для лабораторных и теоретических исследований легкой фракции в качестве адаптогенного средства в животноводстве с целью повышения продуктивных качеств животных.
Введение
Стрессовые нагрузки неизбежны и связаны с нарушением экологии, чрезмерными физическими и психоэмоциональными нагрузками, конкурентными взаимоотношениями и др. Компенсаторные реакции при стрессе характеризуются мобилизацией защитных свойств организма, что спасает от гибели при чрезмерных нагрузках. В настоящее время в современном животноводстве остро стоит вопрос о профилактике и способах снижения стресс-фактора, в том числе для продуктивных животных [1]. На фармацевтическом рынке предложено множество средств защиты от стресса растительного и животного происхождения [2]. Известно также, что экстракт личинок большой восковой моли (Galleria mellonella L.) увеличивает стрес-соустойчивость животных [3]. Как правило, исследования стрессоустойчивости проводились на лабораторных животных, подвергающиеся воздействию экстракта из нативных личинок G. mellonella последней стадии развития перед
окукливанием, массой более 150 мг. Эксперименты этих и других авторов [4,5,6] по изучению влияния экстракта личинок G.mellonella на адаптационные возможности показывают значительное повышение стрессоустойчивости изучаемых животных. Группа исследователей [7] доказали антистрессорное действие при курсовом приеме экстракта из личинок G.mellonella, которая предотвращала или значительно ослабляла действие стресса на митохондрии, а также на клетки крови. Проведенные группой исследователей эксперименты в 2018 г. [8] доказали, что водный и спиртовой экстракты из личинок G.mellonella, хотя и в разной степени, но оказывают стресс протекторное действие на вегетативном уровне. При этом экстракты из личинок G.mellonella трансформируются в поведенческую реакцию. Доказано, что под воздействием спиртового экстракта из личинок G.mellonella происходят изменения в структуре надпочечников, свидетельствующие об ответной реакции организма при стрессе [9,10].
Ряд исследователей свойств экстракта из личинок G.mellonella отмечают более высокую активность препаратов, выделенных из продуктов жизнедеятельности (ПЖ) личинок G. те1-1опе11а [11,12].
В связи с этим целью проведенного исследования явилось изучение уровня стресса по морфометрическим показателям гистологии надпочечников и селезенки мышей при транс-дермальном введении легкой фракции продуктов жизнедеятельности личинок G. те11опе11а.
Материалы и методы исследований
Объект исследования — продукты жизнедеятельности (ПЖ) личинки G.mellonella. Для получения изучаемого сырья личинки G.mellonella выращивались в лабораторных условиях Удмуртского ФИЦ УрО РАН. Из экстракта ПЖ личинок G. те11опе11а растворителями была выделена лёгкая фракция (ЛФ). Основу ЛФ составляли относительно низкомолекулярные химически активные соединения. Эксперимент проводили на кафедре эпизоотологии и ветеринарно-сани-тарной экспертизы ФГБОУ ВО Ижевской ГСХА.
Для проведения эксперимента был выбран способ экспериментального моделирования общей гипертермии по стандартной методике [13]. Было сформировано три группы подопытных животных, в качестве которых использовались белые беспородные мыши. Подборка лабораторных мышей осуществлялась по принципу пар-аналогов с учетом возраста (2 месяца), происхождения и пола (использовались только самцы), живой массы (10,2 г). Подопытные животные содержались в одинаковых условиях, с однотипным кормлением (стандартный рацион для мышей на период краткосрочных экспериментов). В каждой группе было по 5 мышей, которые содержались в стандартных условиях вивария. Эксперименты выполнялись в соответствии с этическими нормами обращения с животными, соблюдением рекомендаций и требований [14,15]. В опытной группе вводили 1% раствор ЛФ трансдермально через кожу хвоста мышей с интервалом через день в течение 30 суток по 5 мкл на особь. Для контрольной группы производилось трансдермальное введение 40 % раствора спирта также через кожу хвоста.
Изготовление гистологических срезов осуществлялось на микротоме СМ-1. Срезы окрашивались гематоксилином и эозином. Морфометрию производили при помощи фотографирования, с использованием цифровой фотокамеры Levenhuk С 510NG на микроскопе
JENAMED 2, окуляр GF — PW 10, объективы 10 х 0,20, 40 х 0,65. Для проведения измерений клеток исследуемых органов использовалась программа ToupView. Анализ морфометрии серийных гистологических срезов изучаемых органов проводился по методике Г.Г. Автандилова (1990) [16]. В микросрезах надпочечников проводили замеры толщины коркового вещества (клу-бочковая зона, пучковая зона, сетчатая зона) и мозгового вещества. Для проверки экспериментальных результатов на наличие грубых экспериментальных ошибок использовался вариационный критерий Диксона.
Для интерпретации результатов в мазках крови проводили дифференциальный подсчет клеток крови, окрашенных по Романовскому-Гимзе. Подсчет количества форменных элементов крови проводили в камере Горяева по общепринятым методикам.
Для определения достоверности различий физиологических параметров мышей как результатов проведения эксперимента использовался критерий Стьюдента, для чего вычислялось эмпирическое значение критерия Стью-дента, которое определялись по формуле (1)
-1
«к Л-
где t — эмпирическое значение критерия Стьюдента, П1 и П2 — первый и второй сравниваемые параметры соответственно, s12 и s22 — дисперсии для первого и второго параметров соответственно, п1 и п — количество мышей участвующих в эксперименте.
Количество степеней свободы f определялось по формуле (2)
f = П1+П2 — 2 (2)
Вычисленное по формуле (1) эмпирическое значение сравнивалось с табличным критическим значением для критерия Стьюдента, после чего делался вывод о степени достоверности полученных результатов разности параметров.
Результаты исследований
Уровень стресса проявляется на разных физиологических уровнях организма, начиная с клеточного уровня и заканчивая системами органов.
После реализации модели эксперимента в виде гипертермии у мышей одновременно
было отмечено сильное различие в клинических проявлениях воздействия гипертермии в опытной группе и контроле. Проведенный эксперимент выявил, что в контроле из пяти мышей погибли две особи. При этом в контрольной группе наблюдали следующие клинические симптомы: выделение пота, атаксию, легкую синюшность лапок, мордочек, при этом время реабилитации составила 15-30 мин. В опытной группе погибла только одна лабораторная мышь. В этой группе наблюдалась легкая потливость, слизистые оболочки и кожа имели светло-розовый цвет. Время реабилитации для мышей первой группы сокращалось в 3 раза по сравнению с контролем (5-10 мин).
Лейкоцитарная формула также отражает картину воздействия стресса (табл. 1).
Таблица 1
Лейкоцитарная формула крови (лейко-грамма),%
Группа Контрольная группа Опытная группа Эмпирический критерий Стьюдента
Средние значения Дисперсия Средние значения Дисперсия
Юные нейтро-филы 0,31 0,01 0 0 5,2*
Палочковидные нейтрофилы 5,3 3,24 3,0 0,36 2,13**
Сегментные нейтрофилы 41,7 3,84 37,3 10,2 2,25**
Эозинофилы 1,6 0,09 1,6 0,09 0
Моноциты 4,3 0,09 3,0 0,01 7,21*
Лимфоциты 45,7 4,1 54,7 7,29 5,04*
Базофилы 0 0 1,0 0,01 20*
При достоверной разнице с контролем **Р<0,01; * Р<0,1
Как следует из таблицы 1 в группе контроля наблюдается достоверно увеличенное количество нейтрофилов по сравнению с первой опытной группой с незначительным сдвигом влево. При этом количество лимфоцитов в лей-кограмме контрольной группы было сниженным по сравнению с первой опытной группой, а количество моноцитов было в контрольной группе достоверно увеличенным по сравнению с первой опытной группой. Таким образом, слабая нейтрофилия с незначительным сдвигом влево и лимфопенией слабой степени в лей-кограмме, а также повышение уровня моноцитов и уменьшение уровня базофилов может свидетельствовать о перенесенном стрессе для
контрольной группы, что согласуется с результатами, отраженными в таблице 1. В этом отношении мыши опытной группы имели показатели формулы крови, соответствующие большей стойкости к стрессовому фактору гипертермии.
Кроме того, сумма юных и палочковидных нейтрофилов в контрольной группе больше, чем этот же показатель в опытной группе, что свидетельствует о стимуляции выработки нейтрофилов в контрольной группе мышей, а это обычно связано с наличием патологических процессов в организме.
Были произведены сравнительные мор-фометрические исследования надпочечников, селезенки, которые проводились для всех групп мышей. В таблице 2 показаны результаты таких исследований для надпочечников мышей.
Таблица 2
Морфометрические показатели надпочечников, мкм
Изучаемые показатели Контрольная группа Опытная группа Эмпирические коэффициенты Стью-дента
Зоны надпочечников Средние значения Дис-персия Средние значения Дисперсия Опытная группа
Клубочковая зона 53,17 116,9 74,69 70,93 2,86**
Пучковая зона 303,22 909,0 191,33 485,8 5,47*
Сетчатая зона 59,6 853,7 21,41 38,18 3,97*
Мозговое вещество 386,04 14945 230,72 3346,7 1,25
При достоверной разнице с контролем *Р<0,01; ** Р<0,05.
Из этой таблицы видно, что клубочковая зона опытной группы на 21,52 мкм больше, чем в контроле. Толщина пучковой зоны опытной группы в 1,58 раз меньше, чем в контроле. Сетчатая зона надпочечников опытных мышей в среднем в 1,7 раз тоньше, чем у контрольных животных. Аналогичная ситуация отмечается в мозговом веществе.
Как следует из таблицы 2, при длительном воздействии ЛФ происходит уменьшение пучковой зоны, что может приводить к уменьшению секреции глюкокортикоидов. В нормальном, вне стрессовом состоянии мышей опытной группы, глюкокортикоидов может вырабатываться достоверно на 37% меньше по сравнению с контрольной группой.
Контрольная группа
Опытная группа
Рис. 1 — Гистологический срез надпочечников. Увеличение х 150. Окраска гематоксилин и эозин
Мозговое вещество надпочечников синтезирует катехоламины (адреналин и норадре-налин). В опытной группе выработка гормонов стресса — адреналина и норадреналина в связи с их морфометрическими показателями тоже снижается.
Обсуждение
Анализ лейкограммы крови контрольной группы указывает на слабую нейтрофилию с незначительным сдвигом влево и лимфопенией слабой степени в лейкограмме, а также повышение уровня моноцитов и уменьшение уровня базофилов может свидетельствовать о перенесенном стрессе, что согласуется с результатами, отраженными в таблице 1. В этом отношении, мыши опытной группы, имели показатели формулы крови, соответствующие большей стойкости к стрессовому фактору гипертермии. Кроме того, стимуляция выработки нейтрофилов в кон-
трольной группе мышей свидетельствует о большом количестве суммы юных и палочковидных нейтрофилов, по сравнению с опытной группой, что обычно связано с наличием патологических процессов в организме.
Морфометрия надпочечников демонстрирует, что под действием АКТГ в момент стресса глюкокортикоидов (при уменьшении пучкового слоя) тоже будет вырабатываться соответственно меньше как результата длительного действия ЛФ на организм мыши, что соответствует менее острой и поэтому менее разрушительной стрессовой реакции животного по линии глюкокортикоидов в проводимом эксперименте. С другой стороны, глюкокортикоиды как гормоны стресса, участвуют в метаболизме гликогена с образованием глюкозы и регулируют восприимчивость к воспалительным реакциям организма. В опытной группе толщина пучковой зоны минимальная, что в свою очередь соответственно уменьшает метаболизм гликогена, белков и жиров, которые используются для энергетического питания организма в виде глюкозы. В таком случае, возможно меньшее повреждение тканей организма во время стресса.
Это может говорить о более мягкой реакции организмов мышей в опытной группе на стрессовое состояние организма по сравнению с мышами контрольной группы. Например, под действием адреналина происходит сужение периферических сосудов, а значит, снижается транспортировка крови, и, как следствие, потенциально происходит ухудшение снабжения тканей кислородом для контрольной группы мышей
Заключение
Под влиянием ЛФ происходило усиление реактивности и мобилизации защитных сил организма мышей вследствие задействования сложных механизмов регуляции гомеостаза и деинтоксикации организма мышей. В крови опытной группы выявили увеличение абсолютного содержания лейкоцитов и эритроцитов по сравнению с контролем. Морфометрические исследования свидетельствуют о перестройке при длительном воздействии ЛФ экстракта структуры надпочечников, которые ведут к повышению выносливостей мышей.
Полученные результаты являются основой для дальнейших для лабораторных и теоретических исследований легкой фракции в качестве адаптогенного средства в животноводстве с целью повышения продуктивных качеств животных.
Библиографический список
1. Бурловская, В.К., Адаптационные реакции у коров при технологических процессах /В.К. Бурловская, А.Ю. Ковтуненко, Ю.П. Рыжкова // Актуальные вопросы сельскохозяйственной биологии. — 2019. — №2(12). -С.3-9.
2. Хабибуллин, Р.М. Применение адапто-генов растительного и животного происхождение на фоне повышенной физической нагрузки в тесте «Плавание» / Р.М. Хабибуллин, И.В. Миронова, И.М. Хабибуллин// Ученые записки Казанской государственной академии ветеринарной медицины им. Н.Э. Баумана.-2022.-№1. том249.—С.229-233. DOI: 10.31588/2413_4201_ 1883_1_249_233
3. Способ получения биологически активного продукта из личинок большой восковой моли: пат. RU 2038086 Рос. Федерация / Спиридонов Н.А., Рачков А.К., Мухин С.А. и др. заявл. 26.03.1991;опубл. 27.06.1995, Бюл. №18 — 9 с.
4. Костина, Д.А. Влияние биологически активных компонентов гемолимфы личинок Galleria mellonella на рост и ферментативную активность Escherichia coli / Д.А. Костина, О.С. Федоткина, Н.А. Кленова и др. // Известия Самарского научного центра Российской академии наук. — 2013. — Том 15. — №3-1. — С. 567-574.
5. Кондрашова, М.Н. Создание антиок-сидантного и иммуностимулирующего препарата из личинок восковой моли, обладающего лечебным и профилактическим действием при тяжелых бронхолегочных заболеваниях, а также профилактическим действием при простудных заболеваниях и гриппе / М.Н. Кондрашова, Е.Г. Литвинова, А.А. Овсепян и др. // Фундаментальные науки — медицине. Материалы конференции. 14-16 декабря. М.: Фирма «Слово» 2005. С. 33-35.
6. Овсепян, А.А. Антиоксидантное и им-муннопротекторное действие экстракта личинок восковой моли при окислительном стрессе у крыс, вызванном потреблением корма, обогащенным железом / А.А. Овсепян, Н.И. Венедик-това, М.В. Захарченко, Р.Е. Казаков, М.Г. Кондрашова, Е.Г. Литвинова, И.Р. Саакян, Т.В. Сирота, И.Г. Ставровская, П.М. Шварцбург // Вестник новых медицинских технологий. 2009. Том 16. №1. С.170-173.
7. Литвинова, Е.Г. Антистрессорное действие препарата гусениц восковой моли по реакциям митохондрий и нейтрофилов / Е.Г. Литвинова, А.А.Овсепян, А.В. Захарченко // Международная конференция «Рецепция и внутриклеточная сигнализация» Пущино 2-4 июня 2009.
Том 2. С. 599-603.
8. Khudyakova, N.A., Study of the larvae Galleria mellonella extract activity of animals by the method of «Open field» and «Suoktest» / N.A. Khudyakova, A.S. Osokina, A.V. Guschin // Conference 8th International «Social Science and Humanity» 23-29 March 2018. -P. 41-47.
9. Осокина, А.С. Влияние спиртового экстракта большой восковой моли (Galleria mellonella) на внутренние органы мышей / А.С. Осокина, Е.А. Михеева, Т.В. Бабинцева // Вестник Новосибирского аграрного университета. -2018. — № 2(47). — С. 91-100.
10. Осокина, А.С. Ресурсный потенциал личинок большой восковой моли (Galleria mellonella L.) при выращивании в лабораторных условиях: 03.02.14 — биологические ресурсы: автореферат диссертации на соискание ученой степени кандидата биологических наук / Осокина Анастасия Сергеевна, Тимирязевский сельскохозяйственный аграрный университет им. К.А. Тимирязева — Москва, 2016. — 23 с.
11. Осокина, А.С. Определение микробной чувствительности к экстрактам из личинок большой восковой моли (Galleria mellonella L.) и их продуктов жизнедеятельности / А.С. Осокина, И.В. Масленников// Вестник КрасГАУ. — 2021. -№7. — С. 100-107. DOI: 10.36718/1819-4036-20217-100-107
12. Соломка, В.А. Большая восковая моль («ЗОЛОАЯ БАБОЧКА») Технологии. Свойства. Киев: Медицина Украины. — 2012. 40 с.
13. Усай, Л.И. Энергетический обмен головного мозга в условиях длительного воздействия на организм высокой температуры: 03.00.04 — биохимия: автореферат на соискание кандидата медицинских наук / Усай Людмила Ивановна, Смоленский мед. ин-т — Смоленск, 1990. — 23с.
14. Биологическая этика: рекомендации по проведению медико-биологических исследований с использованием животных (сборник материалов и нормативных документов) / Ново-сиб. гос. аграр. ун-т; Биолого-технолог. факультет; сост.:Е.А. Борисенко, Ю.К. Кисьора. — Новосибирск, 2017. 63 с.
15. Руководство по лабораторным мышам и альтернативным моделям в биомедицинских технологиях / Под редакцией Н.Н. Каркищенко, С.В. Грачева. М., 2010. 344 с.
16. Автандилов, Г.Г. Медицинская морфо-метрия. Руководство. — М., Москва, 1990. 384 с.
ANALYSIS OF FRACTION EFFICIENCY OF GALLERIA MELLONELLA L. WASTE PRODUCTS UNDER EXPERIMENTAL
STRESS
Osokina A.S.1, Gushchin A.V.2, Mikheeva E.A.3 1 Udmurt Federal Research Center, Ural Branch of the Russian Academy of Sciences, Izhevsk, Russia, e-mail: [email protected] 2 OOO «M-Technology», Izhevsk, Russia, e-mail: [email protected] 3 FSBEI HE Izhevsk State Agricultural Academy, Izhevsk, Russia, e-mail: [email protected]
Key words: acute stress, adaptation, waste products of Galleria mellonella larvae, adrenal gland morphometry, blood parameters
The aim of the research was to study the stress level in terms of parametres of peripheral blood and histology of the internal organs of mice when using various fractions of the extract based on waste products of Galleria mellonella L. For the experiment, three groups of laboratory mice were formed according to the principle of analogue pairs (n=5). An extract of the light fraction of waste products and a 40% alcohol solution (control) were administered transdermally through the skin of the tail of mice every other day for 30 days at a dose of 5 pl. Method of experimental modeling of general hyperthermia was chosen for the experiment. Statistically significant differences in leukocyte formula indexes of mice in the experimental group of light fraction of waste products of G. mellonella larvae were found compared with the control. The sum of young and rod-shaped neutrophils in the control group is greater than the same parametre in the experimental group, which indicates stimulation of neutrophil production in the control group of mice, this is usually associated with pathological processes in the body. The obtained data show reactivity and mobilization of body defenses of mice under the influence of a light fraction of the waste products of G. mellonella larvae, and therefore, stress resistance increases. A decrease of fascicular zone occurs in case of transdermal administration of light fraction solution, which can lead to a decrease of secretion of glucocorticoids. The obtained results are the basis for further laboratory and theoretical studies of the light fraction as an adaptogenic agent in animal husbandry in order to improve productive qualities of animals.
Bibliography:
1. Burlovskaya, V.K. Adaptive reactions of cows during technological processes /V.K. Burlovskaya, A.Yu. Kovtunenko, Yu.P. Ryzhkova // Current issues of agricultural biology. — 2019. — № 2 (12). -P.3-9.
2. Khabibullin, R.M. The usage of adaptogens of plant and animal origin in case of increased physical activity in the «Swimming» test / R.M. Khabibullin, I.V. Mironova, I.M. Khabibullin // Scientific notes of Kazan State Academy of Veterinary Medicine named after N.E. Bauman.-2022.-N°1.vol.249.—P.229-233. DOI: 10.31588/2413_4201_1883_1_249_233
3. A method for obtaining a biologically active product from the larvae of a large wax moth: Pat. RU 2038086 Rus. Federation / Spiridonov N.A., Rachkov A.K., Mukhin S.A. et al. appl. 26.03.1991;publ. 27.06.1995, Bull. № 18 — 9p.
4. Kostina, D.A. Influence of biologically active components of the hemolymph of Galleria mellonella larvae on growth and enzymatic activity of Escherichia coli / D.A. Kostina, O.S. Fedotkina, N.A. Klenova et al. // Izvestiya of Samara Scientific Center of the Russian Academy of Sciences. — 2013. — Volume 15. — № 3-1. — P. 567-574.
5. Development of antioxidant and immunostimulating medication from wax moth larvae, which has a therapeutic and preventive effect in severe bronchopulmonary diseases, as well as a preventive effect in colds and flu / M.N. Kondrashova, E.G. Litvinova, A.A. Ovsepyan et al. // Fundamental sciences for medicine. Conference materials. December 14-16. Moscow: Firma Slovo, 2005, P. 33-35.
6. Antioxidant and immunoprotective effect of the extract of wax moth larvae in oxidative stress of rats caused by consumption of food enriched with iron /A.A. Ovsepyan, N.I. Venediktova, M.V. Zakharchenko, R.E. Kazakov, M.G. Kondrashova, E.G. Litvinova, I.R. Saakyan, T.V. Sirota, I.G. Stavrovskaya, P.M. Schwarzburg // Vestnik of new medical technologies. 2009. Volume 16. № 1. P.170-173.
7. Litvinova E. G. Antistress action of the preparation of wax moth caterpillars according to reactions of mitochondria and neutrophils / E. G. Litvinova, A.A. Ovsepyan, A.V. Zakharchenko // International conference «Reception and intracellular signaling» Pushchino June 2-4, 2009. Volume 2. P. 599-603.
8. Khudyakova, N.A., Study of the larvae Galleria mellonella extract activity of animals by the method of «Open field» and «Suoktest» / N.A. Khudyakova, A.S. Osokina, A.V. Guschin //Conference 8th International «Social Science and Humanity» 23-29 March 2018. -P. 41-47.
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
9. Osokina, A.S. Influence of alcohol extract of great wax moth (Galleria mellonella) on internal organs of mice/A.S. Osokina, E.A. Mikheeva, T.V. Babintseva // Vestnik of Novosibirsk Agrarian University. -2018. — № 2 (47). — P. 91-100.
10. Osokina, A.S. The resource potential of great wax moth larvae (Galleria mellonella L.) when grown in laboratory conditions: 03.02.14 — biological resources: abstract of the dissertation for the degree of candidate of biological sciences / Osokina Anastasia Sergeevna, Timiryazevsky Agricultural University named after K.A. Timiryazev — Moscow, 2016. — 23 p.
11. Osokina A.S. Specification of microbial sensitivity to extracts from great wax moth larvae (Galleria mellonella L.) and their waste products / A.S. Osokina, I.V. Maslennikov// Vestnik of KrasSAU. — 2021. — № 7. — P. 100-107. DOI: 10.36718/1819-4036-2021-7-100-107
12. Solomka, V.A. Large wax moth («GOLDEN BUTTERFLY») Technologies. Properties. Kiev: Medicine of Ukraine. — 2012. 40 p.
13. Usai, L.I. Energy metabolism of the brain under conditions of prolonged exposure to high temperature: 03.00.04 — biochemistry: abstract of the dissertation for the degree of candidate of medical sciences / Usai Lyudmila Ivanovna, Smolensk Medical Institute — Smolensk, 1990. — 23p.
14. Biological ethics: recommendations on conducting of biomedical research using animals (collection of materials and regulations) / Novosibirsk state agrarian University; Biological and technological faculty; comp.: E.A. Borisenko, Yu.K. Kisiora. — Novosibirsk, 2017. 63 p.
15. Textbook on laboratory mice and alternative models in biomedical technologies/Edited by N.N. Karkishchenko, S.V Grachev. M., 2010. 344 p.
16. Avtandilov, G.G. Medical morphometry. Textbook. — M., Moscow, 1990. 384 p.
Галлерия Мелонелла Тонус | Восковая моль (экстракт личинок) в капсулах
Предлагаем вашему вниманию Мелонелла Тонус — препарат на основе экстрактов личинок восковой моли и красной щетки из новой серии Galleria melonella.
Мелонелла Тонус — уникальное средство, изготовленное из экологически чистых, богатых полезными веществами природных компонентов, предназначенное преимущественно для устранения и профилактики эндокринных нарушений.
Так, экстракт личинок восковой моли богат ферментами, витаминами, аминокислотами, липидами, высшими жирными кислотами. В нем содержатся высокомолекулярные белки, пептиды, серотониноподобные вещества. Такой универсальный состав позволяет широко использовать экстракт для стабилизации, лечения и профилактики множества заболеваний, воспалительных и дегенеративных процессов. Кроме того, доказано, что экстракт личинок восковой моли благотворно влияет на мочеполовую систему, показан при снижении либидо, аденоме предстательной железы, импотенции, хронических воспалительных процессах женских половых органов, импотенции, уретритах и циститах. В комплексной терапии препарат восстанавливает репродуктивные функции, как у женщин, так и у мужчин.
Входящая в состав препарата красная щетка, растущая исключительно в горных районах Алтая, способствует омоложению и очищению организма от шлаков, снимает сосудистые спазмы, повышает потенцию. Ее назначают при анемии, атеросклерозе, заболеваниях сердца, пониженном гемоглобине. В народной медицине красную щетку используют для лечения женских заболеваний (мастопатии, миомы матки, эрозии шейки матки, при кровотечениях, кистах, эндометриозе, болезненных и нерегулярных менструациях, опухолях различной этиологии, климаксе).
Следует отметить, что Мелонелла Тонус выпускается в удобной лекарственной форме в виде капсул. Благодаря этому, во-первых, вам не придется самостоятельно отмерять необходимую дозу препарата подручными средствами, достаточно просто проглотить капсулу и запить водой. Во-вторых, препарат легко хранить, брать с собой в дорогу. Он не испачкает ваши вещи, и всегда можно взять с собой не весь пузырек, а лишь необходимое количество капсул.
При производстве препаратов серии Galleria melonella использованы современные технологии экстракции трав, а также авторские разработки, учитывающие постоянные изменения экологии внешней среды и иммунной системы человеческого организма, что обеспечивает более устойчивый результат после применения этих средств.
Показания к применению:
• заболевания щитовидной железы;
• нарушение репродуктивной функции у мужчин и женщин;
• циститы;
• уретриты;
• аднексит;
• опухоли молочных желез;
• кисты, полипы;
• болезненные и нерегулярные менструации;
• климакс;
• нарушение потенции у мужчин;
• простатит;
• анемия;
• заболевания сердечно-сосудистой системы;
• туберкулез легких;
• аллергические реакции;
• нарушение мышечного тонуса бронхов;
• нарушение обмена веществ;
• снижение иммунитета;
• вирусные заболевания.
Способы применения и дозы:
Мелонелла Тонус следует принимать по 1 капсуле 2 раза в сутки за 30 минут до еды, запивая достаточным количеством воды. Не рекомендуется употреблять препарат после 17.00 часов, т.к. экстракт личинок восковой моли способствует повышению активности человека.
Побочные эффекты::
Возможны аллергические реакции.
Противопоказания:
Индивидуальная непереносимость компонентов препарата, повышенное артериальное давление, нервное возбуждение, лихорадка, сердечная недостаточность, прием гормональных, противозачаточных препаратов и фитогормонов. Не следует применять препарат детям, беременным и кормящим женщинам.
Особые указания:
Во время применения Мелонелла Тонус желательно отказаться от алкоголя, пряностей и придерживаться диеты, в которую входит легко усвояемая пища. Пациентам, страдающим лактазной недостаточностью, следует учитывать, что в составе препарата имеется лактоза. Перед применением рекомендуется консультация врача.
Условия и сроки хранения:
Препарат следует хранить в сухом темном месте при температуре не выше 25 С.
Галлерия Мелонелла – Тонус в капсулах 50 шт отзывы
About this product reviews yet. Be the first!
Гастрострон рекомендуется в качестве профилактического средства и компонента вспомогательной терапии заболеваний пищеварительной системы.
Гастрострон рекомендуется также для улучшения обмена веществ.
Показания к применению препарата Гастрострон:
-
Профилактика и лечение гастрита
-
Язвенной болезни желудка и двенадцатиперстной кишки
-
Хронические колиты
-
Используется в качестве средства, улучшающего пищеварение, стимулирует обмен веществ.
-
Способствует оздоровлению пищеварительной системы.
Противопоказания: повышенная чувствительность к составляющим препарат компонентам, беременность, детям до 12 лет.
Состав: экстракт личинок большой восковой моли (огневки), экстракт корня лопуха, экстракт подорожника, экстракт алоэ, экстракт полыни, лактоза.
Применение: по 1 капсуле 2 раза в день во время приема пищи.
Особые указания: во время применения препарата не рекомендуется употреблять алкоголь и продукты, содержащие консерванты.
Описание компонентов входящих в состав капсул Гастрострон:
Экстракт большой восковой моли является мощнейшим природным иммуностимулятором и антиоксидантом, что в свою очередь помогает организму мобилизовать на борьбу с болезнью естественные защитные силы, изначально заложенные в нём самой Природой.
Экстракт корня лопуха — ускоряет процесс пищеварения, улучшает состав микрофлоры кишечника, способствует восстановлению обмена веществ, стимулирует образование ферментов поджелудочной железы.
Экстракт подорожника — используется для улучшения работы желудочно-кишечного тракта. Кроме того, считается противоопухолевым средством.
Экстракт алоэ — способствует процессу пищеварения, применяется при гастритах, язвенной болезни желудка и двенадцатиперстной кишки, поддерживает гомеостаз (постоянство химического состава и свойств внутренней среды, а также устойчивость основных физиологических функций) в организме.
Экстракт полыни — используют при гастрите, язвенной болезни желудка и двенадцатиперстной кишки, энтероколите, заболеваниях печени и почек, анемии, ожирении, метеоризме, изжоге и др. заболеваниях. Экстракт полыни эффективен для возбуждения аппетита и усиления деятельности пищеварительного тракта.
Он регулирует работу поджелудочной железы и желудка, нормализует кислотность, усиливает желчеотделение, снимает вздутие живота и катаральные явления в желудке, воспалительные процессы в области слепой кишки, устраняет спазм толстого кишечника.
Лактоза — это источник энергии. Лактоза нормализует кальциевый обмен в организме, поддерживает нормальную микрофлору кишечника, способствуя росту лактобактерий, предотвращающих гнилостные процессы в кишечнике. Это мощный стимулятор нервной системы и средство профилактики сердечно-сосудистых заболеваний.
Гастрострон оказывает спазмолитическое и противовоспалительное действие, применяется для профилактики и лечения язвенной болезни желудка и двенадцатиперстной кишки, хронических колитах. Гастрострон улучшает обмен веществ, способствует восстановлению собственной микрофлоры пациента. Улучшает работу печени и поджелудочной железы, повышает секрецию желчи, панкреатического и желудочного сока.
Кол-во в упаковке: 56 капс.
Форма выпуска: капсулы по 0,5 гр.
Описание: желатиновые капсулы со слабым специфическим запахом.
Условия хранения: При температуре не выше 25 С.
Срок годности: 2 года.
Произведено: ООО «Доктор Корнилов» Алтайский край г. Барнаул ул. Аносова д.3
Как купить Гастрострон «Галлерия меллонелла +» №56 капс (Доктор Корнилов)
Чтобы приобрести Гастрострон «Галлерия меллонелла +» №56 капс (Доктор Корнилов) по привлекательной цене 589 руб.
выберите на этой странице необходимое количество товара Гастрострон «Галлерия меллонелла +» №56 капс (Доктор Корнилов) и нажмите кнопку «В корзину».
При необходимости добавляйте в корзину и другие понравившееся товары на нашем официальном сайте Зеленой аптеки https://apteka72.com.
Когда все нужные товары выбраны, нажмите на КОРЗИНУ в верхнем правом углу сайта и Вам будет доступна форма для оформления заказа.
Возможны варианты доставки на дом или самовывоз с пунктов выдачи товара.
Пункты выдачи товара вы можете увидеть здесь.
Вы можете выгодно купить Гастрострон «Галлерия меллонелла +» №56 капс (Доктор Корнилов) с хорошей скидкой от 29.45 руб. до 117.8 руб. в зависимости от объема заказа.
Скидка рассчитывается автоматически.
Размеры скидок представлены на этой странице.
Доставка в города России возможна только при заказе на сумму не менее 1000 рублей.
