
Предваряя курс по технологии содержания сельскохозяйственной птицы от образовательного проекта «VCUBE», организованного ИД «Сфера», Николай Крохин, ветеринарный эксперт по птицеводству ООО «Агрофид Рус», рассказал sfera.fm о нюансах дезинфекции и тонкостях подготовки помещений птицеводческих хозяйств.
— Как правильно выбрать подходящие препараты для снижения микробной обсемененности помещений?
— Прежде всего мы должны взять в расчет направленность цикла производства данного помещения. Очень многое зависит от того, является ли это помещение животноводческим, птицеводческим или это помещение, где происходит убой птицы, где птицу разделывают или там происходит охлаждение, или ещё что-то, либо это инкубаторий, всё — это будет влиять на выбор препарата.
Если в помещении находятся животные, и мы в присутствии животных проводим дезинфекцию, то, соответственно, мы должны подбирать такие препараты и концентрацию препаратов, которые для них будут безопасны.
Если готовится животноводческое помещение, в котором была проведена первоначальная дезинфекция, так называемая «по грязи» — когда все обрабатывается до мойки и чистки, а потом, когда поверхность чистая и сухая, осуществляется обработка либо тем же дезинфектантом, либо другим дезинфектантом, но здесь уже играет роль технологичность самого препарата, а именно какой препарат будет наиболее приемлем в технологическом цикле помещения. Также есть моюще-дезинфецирующие препараты, которые можно использовать.

Необходимо учитывать фактор безвредности, то есть безвредность по отношению к людям и собственно безвредность по отношению к объектам животноводства и безвредность по отношению к оборудованию. Препарат должен обладать качеством нейтральности к поверхностям — должны беречь оборудование. Мы не можем использовать коррозийные препараты там, где у нас металлическое оборудование, потому что оно долго не проживёт, либо мы должны использовать такие концентрации, которые не будут воздействовать коррозийно на оборудование. Что касается безвредности по отношению к людям — позиция понятна: обрабатывается все людьми и мы должны беречь наш персонал и использовать дезинфектанты, которые безвредны по отношению к людям.
Существенный нюанс — это технологичность и универсальность способов применения. Технологичность — это возможность его использовать при помощи каких-либо распылителей, нанесения на поверхности при помощи технологических устройств. Универсальность способов применения — это возможность как замочить в нем какое-то оборудование, так и просто помыть тряпкой, нанести орошением, либо применить аэрозольно.
При выборе дезинфектанта мы обязательно должны учитывать степень микробного заражения, она может быть зависима в том числе и от сезона года. Степень его активности в отношении широкого спектра патогенной микрофлоры — тут я в том числе имею ввиду и грибы, и вирусы, и микроорганизмы, то есть в отношении всей микрофлоры, потому что есть достаточно устойчивые микроорганизмы, например, псевдомона или аспергила, они очень устойчивы во внешней среде, и не все дезинфектанты на них одинаково хорошо действуют. Несмотря на то, что на препарате может быть написано, что он воздействует на данную микрофлору, к сожалению, в промышленных условиях не всегда все так однозначно.
Если есть некий контаминант, который характерен для вашего предприятия, то именно на него нужно подбирать препарат, который будет эффективно работать. Для этого можно выделить его и провести определение чувствительности к предполагаемым в использовании дезинфектантам.
Нельзя обойти вниманием вопрос цены. Здесь важно то, что не всегда нужно смотреть стоимость литра, или килограмма дезинфектанта. Определяет выбор все же стоимость обработки квадратного метра помещения — сколько будет стоить этот дезинфектант уже в разведённом виде, в нужной концентрации для обработки квадратного метра помещения. Таким образом просчитываются затраты на препарат.
— Как влияет качество всей дезинфекционной обработки на прогноз инфекционных патологий?
— Влияет напрямую, потому что если дезинфекция проведена с недостаточным качеством, то можно считать, что дезинфекцию практически не проводили, и микрофлора остаётся. Причём именно патогенная микрофлора склонна оставаться в большей степени. Хотя мы обычно делаем тесты по кишечной микрофлоре — берём смывы по E.Coli и оцениваем качество обработки поверхности после дезинфекции. Здесь также нужно понимать, что должен быть ещё предварительный прогноз — то есть накопленная история предприятия: какие контаминанты присутствуют, то есть присутствует ли сальмонелла, допустим, или там, присутствует ли пастерелла, синегнойная палочка, кокковая микрофлора, аспергилла.
Все это будет влиять на дальнейший прогноз и на разработку мероприятий по подготовке помещения, куда будет входить не только мойка и дезинфекция помещения, но и так называемый «чистый период» — определенное время, которое должно пройти после финальной дезинфекции до посадки птиц, то есть так называемый биологический отдых помещения.
Это очень важный процесс, который зачастую на предприятиях не соблюдается, в результате чего работа по дезинфекции становится менее эффективной. Даже если будет применен очень качественный дезинфектант в нужной дозировке, но за счёт того, что вы не сделали биологический отдых помещения, то все равно какая-то часть микрофлоры в этом помещении не успеет погибнуть. Таким образом, когда помещение откроют, проветрят, посадят суточного цыплёнка, цыплёнок будет контаминирован либо вирусной, либо грибковой, либо бактериальной микрофлорой. Соответственно владелец хозяйства получит на выходе снижение продуктивных качеств, увеличение отхода — то есть негативный прогноз по эпизоотической ситуации.

И такая ситуация очень распространена, чаще говорят про бройлерные хозяйства, потому что они склонны к сокращению сроков подготовки из-за того, что хочется больше получить мяса с квадратного метра в течение года. Ускорить рост бройлера довольно-таки проблематично, если хозяйство уже вышло на высокие показатели роста, и тогда либо нарушают такой показатель, как плотность посадки, сажают больше птицы, что в свою очередь опять же ухудшает продуктивность, либо на что производитель идёт чаще, это сокращение сроков подготовки помещения. Конечно, это очень заманчиво для собственника, потому это дает возможность получить больше мяса получить, увеличить прибыль, но таким образом происходит очень быстрое накопление микрофлоры в помещении за счёт того, что не происходит биологический отдых.
Идёт передача микрофлоры как раз в том числе и патогенной, которая, пассажируясь на птице, наращивает свою вирулентность и патогенность. Таким образом в начале были показатели прекрасные, не было того же колибактериоза, через 6-12 месяцев появляется колибактериоз, которого не было. Возникает вопрос: в чем причина? Вроде как дезинфекция качественно проводится, смывы берут и результаты хорошие. Но дело в том, что смывы берут сразу после дезинфекции, а если мы возьмём через 2-3 дня, то вполне возможно, что там уже будет рост. Это связано с тем, что колония защищается от внешних воздействий, то есть на поверхность колонии сверху она выделяет биологически активные вещества, которые защищают её от воздействия дезинфектантов и не все дезинфектанты способны разрушать эту биологическую плёнку.
Кстати, к вопросу о выборе дезинфектанта мы должны ещё учитывать вот этот момент, потому что зачастую, когда мы читаем инструкцию к препарату, там написано, что в определенной концентрации им можно обрабатывать такую-то поверхность. Но не всегда производитель тестирует препарат во всех условиях: тесты проводятся на сухую поверхность, наносится дезинфектант и соответственно, он срабатывает, но если мы говорим о системе поения, или системе кормления, особенно в зоне риска трубы кормления, в которых идёт шнек, там внутри образуется достаточно большой массив биологического налёта, так в виде микрофлоры, водорослей, жировые плёнки в трубах кормления, потому что в корме присутствует масло, и соответственно жировые масляные плёнки накапливаются. В этой питательной среде размножается большое количество микрофлоры, и уже рекомендуемые концентрации препарата зачастую могут работать не так эффективно при таких загрязнениях. И приходится как-то уже подходить по-другому, то есть индивидуально в каждом случае, использовать несколько дезинфектантов и т. п.
— Если качественный микробный состав воздушной среды и конструкции птичников варьирует по сезонам, то будут ли меняться средства дезинфекции и будет ли меняться их дозировка?
— Да, это может меняться в зависимости от сезонности или в зависимости от рисков поступления каких-то контаминантов, то есть, допустим, если поступает яйцо от заражённой птицы, например, энтерококками — и мы предполагаем, что это будет бактериальное обсеменение яйца, то, соответственно, нужно будет менять средства дезинфекции для того, чтобы минимизировать контаминацию вот этим яйцом инкубатория.

Когда происходят сезонные колебания температуры, часть помещений не отапливается, например, у промышленной несушки, соответственно нужно будет подбирать дезинфектанты в зависимости от того, какой температурный режим в помещении. Многие дезинфектанты работают при достаточно высоких температурах, выше хотя бы 16 градусов.
И практически нет дезинфектантов, которые работают при отрицательных температурах. Если взять формалин, то он работает при температуре выше 20 градусов, а лучше, чтобы температура была от 28 градусов в помещении. При низких температурах он не будет работать, то есть ниже 16 он вообще очень быстро теряет свою эффективность, а если температура близится к нулю, то соответственно эффективность формалина тоже будет стремиться к нулю.
— Как определяют продолжительность профилактического перерыва? Только по циклограмме производства?
— Тут есть 2 момента. С одной стороны, мы зависим от производства, с другой стороны, мы зависим от эпизоотической ситуации внутри хозяйства. Зачастую эпизоотическая ситуация, а именно её ухудшение, может нам диктовать совершенно другие циклы подготовки помещения, когда нам нужно, чтобы, допустим, помещение стояло не менее 10 дней. Общий период подготовки -14 дней, из которых 4 дня — это чистка, мойка, дезинфекция и 10 дней помещение стоит чистое сухое, продезинфицированное, туда никто не заходит, оно подготовлено к посадке птицы.
Иногда даже бывает, что за этот период можно сделать дополнительную дезинфекцию, например, аэрозольную, для того, чтобы убрать какой-то контаминант, который невозможно убрать технологическими средствами — введением каких-либо препаратов в корм: антибиотиков, кокцидиостатиков и так далее. Но зачастую есть контаминанты, с которыми не справиться терапевтическими методами и единственный метод, который способен исправить ситуацию — это увеличить сервис-разрыв, а именно биологический отдых.
Например, при аденовирусной инфекции, при реовирусной инфекции, при синдроме мальабсорбции и так далее, зачастую мы никак не можем воздействовать на птицу, потому что заражение происходит очень рано, практически в первые дни жизни, а на этот период пока ещё нет средств воздействия, экономически оправданных, поэтому единственный способ — это увеличить разрыв, чтобы патогенная микрофлора погибла в чистом помещении.
Иногда бывает и так, что при вспышке острой, инфекционной патологии нам приходится делать большой разрыв вот, допустим, при птичьем гриппе у нас определено 4 месяца санитарного разрыва. Есть технологический цикл и если мы что-то меняем в нём, то это, как правило, вынужденная мера, которая продиктована изменением состояния птицепоголовья.
Онлайн-курс «Улучшенные рационы кормления и технологии содержания сельскохозяйственной птицы» стартует 14 августа.
Интервью провела: Полина Асланова, sfera.fm
Эксперты / Корма и ветеринария
23 мая 2023г.
читайте также
Дезинфекция инкубационных яиц формальдегидом
Микробиологическое загрязнение инкубационных яиц является основной проблемой производителей птицы, поскольку оно приводит к снижению выводимости и продуктивности цыплят. Микроклимат внутри инкубатора идеально подходит не только для развития эмбриона, но и для размножения разного рода патогенных микроорганизмов.
Очевидно, что в инкубаториях должны соблюдаться высокие стандарты гигиены, чтобы свести к минимуму загрязнение яиц, но дезинфекция яиц также необходима для ограничения численности бактерий. Способы дезинфекции бывают разные – окунание яиц в дезраствор, протирка или распыление. Но для крупного производства наиболее эффективным методом является обработка поверхности яиц парами формальдегида (фумигация).
Дезинфекционная обработка обычно производится перед закладкой яиц в инкубатор. Чтобы снизить издержки и сделать обработку быстрой и массовой, в инкубатории для этих целей оборудуют специальное помещение – дезинфекционную камеру или, как ее еще называют, камеру газации яйца, комнату обработки яиц формальдегидом перед инкубацией. Яйца поступают в дезкамеру через «грязный вход» после сортировки, миражирования и закладывания в инкубационные лотки, которые загружены на инкубационные тележки. А после обработки их выкатывают через другую дверь — «чистый выход», и отправляют прямиком в инкубатор.
Наша компания производит комплекты оборудования и автоматики для создания дезинфекционных помещений в инкубатории «под ключ». Мы выпускаем оборудование двух типов: для жидких дезинфицирующих растворов (формалин, вироцид) и для испарения порошка параформа.
Узнать цену, купить, заказать коммерческое предложение, посмотреть подробные технические характеристики можно в нашем официальном интернет-магазине:
– УУДК-Ф-15.02, оборудование для обработки яиц жидким формалином;
– УУДК-Ф-15.03, оборудование для обеззараживания яиц испарениями порошка параформа.
Давайте рассмотрим особенности такого способа обработки яиц подробнее.
Загрязнение инкубационных яиц
Согласно проводимым микробиологическим исследованиям, в момент откладки яйца курицей количество бактерий на скорлупе может колебаться от 300 до 500 шт. В подходящих условиях это число начинает быстро увеличиваться, и уже через час после откладки яйца на нем может присутствовать от 20 000 до 30 000 бактерий. А если яйца грязные, то количество возрастает до 80 000 бактерий. Типичными загрязнителями являются микрококк, сальмонелла, псевдомонада и эшерихия (кишечная палочка). Также на скорлупе идентифицируются различные типы плесневых грибов.
На многочисленных опытах было продемонстрировано, что, если инкубационные яйца не подвергнуть санитарной обработке перед инкубацией, то чрезмерное бактериальное загрязнение и последующий рост бактерий могут привести к снижению выводимости, плохому качеству цыплят, их росту, продуктивности и увеличению смертности. В некоторых случаях из-за несоблюдения гигиенических стандартов может произойти потеря запасов до 20%.
Фумигация яиц формальдегидом
Формальдегид (H2CO, формалин, формол) является газом при комнатной температуре и легко растворим в воде. Его обычно используют в качестве дезинфицирующего средства, поскольку он дешев, не вызывает коррозии и убивает большинство бактерий и грибков (включая их споры). Биоцидная эффективность формальдегида обусловлена его способностью воздействовать на белки и основания нуклеиновых кислот микроорганизмов. Присоединяясь к первичным амидным и аминогруппам белков, формальдегид образует стабильные метиленовые мостики и, следовательно, межмолекулярные поперечные связи. Кроме того, формальдегид также алкилирует (замещает) атомы азота пуриновых и пиримидиновых оснований в ДНК и РНК.
Впервые о его применении в качестве дезинфицирующего средства сообщалось в 1892 году, но, по-видимому, ПЕРНО (1908) был первым исследователем, продемонстрировавшим использование фумигации яиц и инкубаторов формальдегидом в качестве средства борьбы с болезнями домашней птицы.
Формальдегид можно применять в жидком виде, но он более эффективен при использовании в виде газа. Газ может быть получен несколькими способами. Сначала наиболее распространенным способом, используемым в птицеводстве, было добавление формалина к перманганату калия (KMnO4) в соотношении 2:1 (по массе). В настоящее время эта процедура не применяется, она заменена испарением полимерного параформальдегида при контролируемой температуре.
Факторы, влияющие на эффективность обеззараживания формальдегидом
На воздействие формальдегида на микроорганизмы влияют:
- Концентрация формальдегида и продолжительность воздействия;
- Влажность (содержание воды в микроорганизмах);
- Температура;
- Количество органического вещества на поверхности скорлупы.
Концентрация формальдегида и продолжительность окуривания
На количество формальдегида, необходимое для достаточной фумигации влияют такие факторы, как размер камеры для фумигации, продолжительность воздействия и температура. Рекомендации по применению обязан указывать поставщик реагентов, размеры дезкамеры вашего инкубатория вам известны, а рекомендации по объёму растворов можно прочитать в документации к оборудованию для фумигации (газации) или на нашем сайте в описании оборудования.
Опыты с концентрацией (УИЛЬЯМС, 1970) показали, что 565 мг выделяемого формальдегида на м3 убивает 99,8% микроорганизмов на поверхности скорлупы. Более высокие концентрации (1696 мг выделяемого формальдегида на м3 и 2827 мг выделяемого формальдегида на м3) не показали существенной разницы в эффекте.
Воздушное пространство камеры фумигации является основным фактором, который необходимо учитывать при расчете количества формальдегида, необходимого для достижения желаемой концентрации. Другие факторы, такие как степень поглощения воды стенками и скорость, с которой газ выходит из камеры, также влияют на необходимое количество формальдегида. Кроме того, неисправные вентиляционные жалюзи или другие проблемные точки дезкамеры могут снижать концентрацию в камере, и поэтому важно регулярно определять концентрацию формальдегида в конце фумигации, чтобы убедиться, что поддерживался надлежащий уровень.
Также были проведены исследования, изучающие влияние различного времени воздействия реагента на качество дезинфекции. ФУРУТА и САТО (1977) проводили газацию искусственно загрязненных яиц, используя 40 мл формалина и 20 г KMnO4 на м3 (т.е. 533 мг выделившегося формальдегида на м3) при комнатной температуре (25°C) в течение 0.5, 1, 2 и 3 часов. Они обнаружили, что, когда яйца были сильно загрязнены (105 или более организмов), небольшое количество бактерий (100-101) всегда выживало после фумигации, независимо от времени воздействия; полная дезинфекция поверхности скорлупы была невозможна. Напротив, когда яичная скорлупа была менее загрязнена (до 104 организмов), окуривание в течение 30 минут уже обеспечивало полную дезинфекцию.
Несколько исследователей изучали влияние концентрации формальдегида и времени воздействия на выводимость. Результаты получились немного разными. ПРАУДФУТ и СТЮАРТ (1970) исследовали возможные последствия изменения как концентрации фумиганта, так и продолжительности воздействия фумиганта. В более позднем эксперименте ФУРУТА и ВАТАНАБЕ (1978) изменяли только продолжительность воздействия фумиганта, сохраняя постоянную концентрацию. Ни в одном из этих исследований не сообщалось о значительном снижении общей выводимости. Однако в более поздней работе (ELIBOL et al., 2003) была обнаружена взаимосвязь между эмбриональной смертностью, продолжительностью окуривания и концентрацией формальдегида. Авторы сообщили о снижении выводимости на 8% при длительной фумигации формальдегидом и более высокой концентрации.
Влажность
Если формальдегид используется в качестве дезинфицирующего средства в паровой фазе, на его активность влияет относительная влажность (RH), поскольку частицы газа переносятся каплями воды. Таким образом, убойная сила формальдегида для бактерий выше в теплой, влажной атмосфере, чем в прохладных, сухих условиях. Следовательно, поддержание высокой относительной влажности воздуха (75% и более) во время дезинфекции может принести лучший эффект. Кроме того, микроорганизмы становятся более активными и быстрее усваивают фумигант по мере увеличения влажности. В раннем исследовании УИЛСОН (1949) заметил, что бактерицидный эффект формальдегида был максимальным при относительной влажности 68%. Его выводы были также подтверждены более поздними исследованиями. Ученые пришли к выводу, что относительная влажность 60-78% не оказывает вредного влияния на выводимость и может быть безопасно использована для достижения максимального бактерицидного эффекта.
Температура
Высокая температура необходима для обеспечения высокого уровня влажности, поскольку при более высокой температуре газовая фаза способна удерживать пар в более высокой концентрации. Однако применение высокой температуры имеет свои ограничения. В только что снесенном яйце эмбрион содержит 30000-60000 клеток, и его обычно называют эмбрионом стадии X. Чтобы поддерживать состояние покоя эмбриона, яйцеклетку следует держать ниже физиологического нуля. Температура в диапазоне от 20°C до 27°C была определена как физиологический ноль для домашней птицы. Однако, эксперименты ПРАУДФУТА и СТЮАРТА (1970) не показали отрицательного влияния на выводимость, когда температура фумигации колебалась от 23°C до 37°C. В итоге стандартной коммерческой практикой является рекомендация проводить фумигацию яиц при температуре 25°C.
Органическое вещество на поверхности скорлупы
Присутствие на поверхности скорлупы органических веществ, таких как кровь, фекалии, почва, остатки пищи, является одним из наиболее важных факторов, влияющих на эффективность дезинфицирующего средства. Органическое вещество на поверхности яиц снижает эффективность фумиганта, поскольку активные вещества инактивируются загрязняющим веществом. Кроме того, антибактериальная активность может быть снижена из-за химической реакции между фумигантом и органическим веществом. Формальдегид может вступать в реакцию с белками органического вещества, и, таким образом, нейтрализоваться. В итоге для дезинфекции микроорганизмов концентрации формальдегида может не хватить.
Воздействие формальдегида
Во время фумигации формальдегид вступает в контакт не только с поверхностными микроорганизмами, но и с самой яичной скорлупой и, при поглощении, с эмбрионом. Концентрация поглощенного формальдегида (в скорлупе и в белке) была определена УИЛЬЯМСОМ и СИГЕЛОМ (1969) с использованием 565 мг выделившегося формальдегида на м3. Авторы пришли к выводу, что уровень фумиганта, обнаруженный в яйце, был намного ниже токсичного уровня. Однако в дальнейшем было обнаружено, что токсический эффект формальдегида наиболее высок при 60-минутном воздействии. Эксперимент также показал, что этот эффект наиболее выражен в яйцах, полученных от молодых (в возрасте 38-39 недель) кур.
Воздействие формальдегида на яичную мембрану
Мембрану яичной скорлупы ещё называют кутикулой или пленкой. Яичная скорлупа изнутри покрыта органическим слоем – мембраной, содержание белка в которой составляет 90%, а формальдегид алкилирует амидные и амидо-группы белков. Поскольку кутикула является одним из основных физических барьеров оболочки яйца, препятствующих проникновению микроорганизмов, было бы важно знать, повреждает ли фумигация этот слой.
Первые эксперименты по разрушению кутикулы, вызванному фумигацией, не дали полезных ответов. Сначала исследователи использовали в экспериментах муравьиную кислоту, которая сама разрушила мембрану и исказила полученные результаты. Затем были более поздние эксперименты, которые оказались не вполне достоверными по причине неправильных гипотез о роли мембраны во влаго- и газообмене яйца.
Дальнейшее исследование, проведенное КАДИРЧИ (1997), показало, что фумигация инкубационных яиц при температуре 25°C выделением 600 мг газообразного формальдегида на м3 в течение 15, 30 или даже 60 минут существенно не изменяет поглощение воды яйцами. Это же исследование также показало, что электропроводность яичной скорлупы также не пострадала от фумигации формальдегидом при таких воздействиях.
Итоги
Потери из-за микробного загрязнения инкубационных яиц в птицеводстве могут исчисляться миллионами и десятками миллионов рублей. Фумигация газообразным формальдегидом является наиболее эффективным способом дезинфекции инкубационных яиц.
Для дезинфекции от сальмонелл яйца перед инкубацией следует окуривать при комнатной температуре (25°C) и влажности окружающей среды 60-78% в течение не менее 20 минут с минимальной концентрацией 600 мг газообразного формальдегида на м3. Фумигация в этих условиях убивает 99,8% микроорганизмов на поверхности скорлупы и не связана с повышенной смертностью эмбрионов.
- Фумигацию не следует проводить в течение первых 9 дней после начала инкубации и за несколько дней до вывода.
- Фумигация вылупившихся цыплят запрещена, т.к. это повредит их дыхательную систему, окажет неблагоприятное воздействие на здоровье и производственные показатели.
- Формальдегид также опасен для здоровья человека – нахождение оператора в камере газации в процессе обработки яйца категорически запрещено! Автоматика после обработки формальдегидом нейтрализует вредные пары аммиаком и выведет всю эту смесь наружу при помощи принудительной вентиляции, после чего вход в камеру газации будет разрешен.
Закажите надёжное оборудования для дезинфекционной камеры в Микроэл! Подробности по ссылкам в нашем интернет-магазине:
Л. Дядичкина, ГНУ-ВНИТИП
Инкубаторий является начальным звеном в производственном процессе птицеводческого предприятия, и поэтому необходимость принятия самых действенных мер по предотвращению проникновения и распространения инфекций очевидна. Ущерб от инфицирования инкубационного яйца, а затем эмбрионов и полученного молодняка птицы, может быть чрезвычайно велик, поскольку прерывание возникшей эпизоотической цепи обычно оказывается невозможным без полной остановки производства. Поэтому крайне важно направить внимание всего персонала инкубатория на строгое соблюдение соответствующих требований ветеринарной санитарии и гигиены, а также правил проведения противоэпизоотических мероприятий, что позволит достигнуть высоких производственных показателей и избежать перебоев в работе предприятия.
Инкубаторий размещают как можно дальше, но не ближе чем за 300 м от помещений для содержания птицы, ее убоя и переработки, желательно в лесном массиве. Целесообразно иметь на одной территории два отдельных здания инкубатория, что обеспечит возможность проведения вынужденного или планового ремонта и санации одного из подразделений без полной остановки производства. Расстояние между этими зданиями должно быть не менее 100 м. Территорию вокруг инкубаториев следует обнести надежным ограждением, а при въезде оборудовать дезбарьер. Все входы на эту территорию инкубатория должны быть закрыты, а доступ диких и домашних животных исключается. Проход людей и машин осуществляется только по специальному разрешению, а въезжающий транспорт должен быть чистым и продезинфицированным.
Прием яиц на инкубацию проводят только при наличии ветеринарного свидетельства о благополучии хозяйства по инфекционным заболеваниям птиц. При этом не следует допускать одновременной инкубации яиц от разных видов птицы, а также доставленных из хозяйств, различающихся в эпизоотическом отношении. Доставка яиц должна осуществляться в чистой таре специальным транспортом и передаваться через люк в стене, при этом доставившие яйцо люди не должны входить в инкубаторий. Для сбора и перевозки племенных яиц (от птицы исходных линий, прародителей и родителей) следует использовать одноразовые картонные прокладки. Бывшие в употреблении картонные коробки и прокладки не должны использоваться повторно, поскольку надежная дезинфекция их невозможна.
Целесообразно маркировать упаковочные материалы соответственно их принадлежности к птичникам и фермам. При сборе и доставке инкубационного яйца для получения бройлеров и промышленных несушек допустимо применять многоразовые пластиковые прокладки, но после каждого использования их, как и деревянные или пластиковые ящики, необходимо подвергать мойке и дезинфекции, а затем тщательно просушивать во избежание плесневения. При входе в здание инкубатория должна быть оборудована дезванна. Все конструкции инкубатория должны быть устойчивы к воздействию моющих и дезинфицирующих средств, а устройство полов под уклоном обеспечивать удаление стоков. В здании необходимо иметь помещения для стирки и дезинфекции одежды, душевые кабины, раздевалки для персонала и посетителей (рабочих по вакцинации, определению пола и пр.). Инкубаторий должен быть устроен по принципу однонаправленного конвейера, исключающего возможность встречного движения инкубационных яиц, выведенного молодняка и отходов инкубации. При этом все основные залы и секции инкубатория должны быть герметично изолированы друг от друга, а люк для выгрузки цыплят должен располагаться с той стороны здания, которая противоположна входу для поступающего инкубационного яйца.
Движение воздуха также должно происходить только в одном направлении, причем для предотвращения попадания загрязненного воздуха в «чистые» участки помещения давление воздуха в последних должно быть выше, чем в «грязных» участках. Воздухозаборные устройства не должны располагаться рядом с воздухоотводами, а на пути подачи свежего воздуха должны быть установлены фильтры или пылеулавливатели. Окна, вентиляторы и другие сквозные отверстия в стенах оборудуют заслонками против насекомых и птиц.
Здание инкубатория должно быть всегда закрыто для посторонних, а обслуживающий персонал может входить в него только по сигналу (звонку) извне. Всем входящим в инкубаторий должны ежедневно выдавать стерильные (выстиранные и продезинфицированные) рабочие комбинезоны, халаты, головные уборы и обувь, причем, при входе в те помещения, где инкубируют яйца исходных линий, прародителей и родителей, все работники и посетители должны принимать душ. В тех же помещениях, где инкубируют яйца для получения коммерческих гибридов (бройлеров или несушек), все входящие перед сменой верхней одежды и обуви должны принять душ, либо вымыть руки с мылом, желательно жидким, и продезинфицировать их 2 %-ным раствором хлорамина или мыльным спиртом. Частое мытье рук в процессе работы также должно стать обязательным правилом для всех рабочих.
Инкубаторий должен быть разделен на три отделения, в каждом из которых — свои обувь и одежда определенного цвета, а переход работников из одного зала в другой без переодевания и мытья рук — запрещен.
Необходимо ежегодное проведение медицинского осмотра и обследования всех работников инкубатория на сальмонеллез, а в случае обнаружения бактерионосительства — проведение лечения и повторного обследования.
Новых работников также предварительно обследуют на сальмонеллез.
В помещениях инкубатория не должно быть собак, кошек, грызунов и насекомых. Нежелательно также иметь в помещениях тканевые шторы и мягкую мебель во избежание накопления пыли.
Помещения для приема и сортировки яиц, а также инкубационное отделение моют и дезинфицируют не реже одного раза в неделю, а краны, ручки, туалеты и прочее — ежедневно. Инкубационные шкафы также моют и дезинфицируют после каждой выемки яиц.
Перед входом в инкубационный и выводной залы должен быть установлен противень с ковриком, смоченным дезраствором. Проход между этими залами следует держать закрытым и открывать лишь на время передачи эмбрионов на вывод. После каждого вывода все выводное отделение, включая выводные шкафы, сопутствующее оборудование и вентиляционные каналы, а также помещения для сортировки и вакцинации молодняка, подвергают мойке и дезинфекции. Одновременно моют и обрабатывают оборудование для проведения вакцинаций и комнату для приготовления вакцин, которая всегда должна быть закрыта. Для проведения этих работ в выводных залах предусматривают профилактический перерыв не менее 36 часов до загрузки новой партии эмбрионов. Инкубационные отходы упаковывают в плотно закрытую тару и удаляют из инкубатория после окончания выборки молодняка. Использованная тара перед возвращением в инкубаторий должна быть вымыта и продезинфицирована.
Мусор и отходы инкубации нельзя складировать рядом с инкубаторием и следует вывозить с территории инкубатория как можно чаще. При этом необходимо постоянно проводить борьбу с грызунами и мухами.
Ежегодно инкубаторий ставится на профилактический перерыв не менее чем на 7 дней, во время которого проводится капитальный ремонт и тщательная дезинфекция всех помещений, оборудования и вентиляционной системы.
Свежеснесенные яйца, полученные от здоровых птиц, практически стерильны, но подстилка, поверхность оборудования и воздух птичника содержат огромное количество плесневых грибков и различных микроорганизмов, в том числе — возбудителей многих инфекционных заболеваний птицы, преимущественно кишечной группы. При остывании яиц эти микроорганизмы вместе со слизью проникают в поры скорлупы и становятся трудно доступными для любых средств дезинфекции. Поэтому сбор и первую дезинфекцию яиц следует проводить как можно раньше, но не позднее 1,5-2 часов после их снесения. Для этого в птичнике, в кузове автомобиля или яйцескладе должна быть оборудована специальная герметичная дезинфекционная камера.
Проникновение условно-патогенной и патогенной микрофлоры в поры скорлупы яиц может происходить и при их загрязнении, поэтому собранные с пола и грязные яйца могут быть допущены к инкубации только после их мойки и дезинфекции. Для этого должно быть оборудовано специальное помещение при яйцескладе.
Однако даже чистые яйца, поступающие в инкубаторий после их сбора, упаковки, перевозки и хранения, обычно содержат на поверхности скорлупы значительное количество грибковой и микробной флоры. Повышение уровня микробной обсемененности скорлупы яиц может происходить в ходе их сортировки и укладки в лотки, поэтому рассортированные яйца подвергают повторной предынкубационной дезинфекции.
Наряду с этим проводят систематическую санацию всего технологического оборудования и самого инкубатория, что позволяет минимизировать вредное воздействие бактерий и плесени на яйца и выведенный молодняк птицы.
Программа санации должна быть разработана с учетом конкретных особенностей каждого предприятия и включать не только виды используемых моющих и дезинфицирующих средств, но методику их правильного применения и постоянный контроль их эффективности.
Предложены разные методы и способы санации яиц и оборудования инкубатория: ультрафиолетовое и лазерное облучение, озонирование, высокодисперсная или низкодисперсная аэрозольная обработка растворами дезинфектантов, мойка и замачивание в дезрастворах, глубинная обработка яиц антибиотиками, а также термодезинфекция. Каждый из этих методов имеет свои преимущества и недостатки, поэтому целесообразность их применения может быть определена только в конкретной хозяйственной и эпизоотической обстановке.
Большинство дезинфектантов, традиционно применяемых в промышленных инкубаториях, являются высокотоксичными или агрессивными веществами, поэтому при работе с ними следует строго соблюдать правила техники безопасности.
Для профилактической дезинфекции инкубационных яиц в санпропускниках, яйцескладах и инкубаториях может быть использован озон, который получают из кислорода с помощью специальных генераторов различных типов. Являясь сильным окислителем, озон приводит к значительному снижению уровня микробной обсемененности скорлупы яиц, в том числе — плесневыми грибками, но, в то же время, может разрушать изделия из резины и оказывать токсическое действие на человека. Поэтому дезкамера для озонирования должна быть герметичной, с плотно закрывающейся дверью, причем в качестве уплотнителя необходимо использовать синтетические материалы. Яйца, уложенные в лотки, размещают в инкубационных тележках через ряд, чтобы приток озона к ним был достаточным, а для более полного контакта озона с поверхностью яиц следует периодически включать вентилятор. Концентрация озона в дезкамере должна поддерживаться на уровне 300-500 мг на 1 м3 в течение 60 мин. при температуре воздуха 20-26 °С и относительной влажности 50-80 %. По истечении срока дезинфекции озон удаляют из дезкамеры через вытяжную вентиляцию.
Одним из наиболее популярных дезинфектантов является формалин (37%-ный водный раствор формальдегида), который применяют в виде высокодисперсного аэрозоля или пара (газа). Аэрозоль формальдегида необходимой концентрации может быть получен путем распыления с помощью специальных генераторов (САГов и пр.) 25-30 мл формалина на каждый м3 воздуха камеры. Но обычно аэрозоль формальдегида той же концентрации получают путем химической возгонки формалина окислителями, расходуя на 1 м3 воздуха камеры 30-45 мл формалина, столько же воды и 20-30 г марганцовокислого калия или 30 мл формалина и 30 мл хлорной извести (при содержании активного хлора 28-30 %). При дезинфекции утиных или гусиных яиц дозу этих веществ следует увеличить в 2 раза. Экспозиция обработки должна составлять 20-30 минут при температуре 20-26 ° С и относительной влажности воздуха камеры не ниже 80 %. Для возгонки формалина нельзя использовать металлическую посуду с поврежденной эмалью. После дезинфекции пары формальдегида нейтрализуют 25%-ным раствором аммиака (нашатырным спиртом), взятым в количестве, равном половине объема израсходованного формалина.
Формалин обладает жестким, но не продолжительным бактерицидным действием, поэтому при неблагополучии хозяйства по инфекционным заболеваниям требуется проведение дополнительных дезинфекций яиц. Однако формалин не следует использовать для повторных обработок яиц в процессе их инкубации, поскольку он вызывает гибель или уродства у эмбрионов раннего возраста, а также представляет значительную опасность для здоровья обслуживающего персонала.
Кроме того, озонирование и газация формалином оказываются не достаточно эффективными при дезинфекции яиц с пыльной и загрязненной скорлупой. В этих случаях более приемлема так называемая влажная дезинфекция яиц, одним из методов которой является обработка скорлупы низкодисперсными аэрозолями водных растворов различных дезинфектантов. Традиционными средствами влажной дезинфекции являются 0,2-0,5 % раствор надуксусной кислоты, 1,5-2,0 % раствор хлорамина Б и некоторые другие препараты. Для получения низкодисперсных аэрозолей дезинфектантов используют различные компрессоры с насадками ТАН, ПВАН и их аналогами, а для мелкокапельного распыления — распылительную штангу, подсоединенную к ЛСД. ВДМ, ДУК, а также гидропульты или ранцевые распылители различного типа. Влажную дезинфекцию проводят в открытых помещениях при работающей приточно-вытяжной вентиляции и в отсутствии посторонних лиц. Оператор должен быть одет в спецодежду, защитные очки и респиратор или противогаз. Уложенные в лотки яйца размещают в инкубационных тележках через ряд, что позволяет обрабатывать их с двух сторон. Обработку яиц прекращают после полного увлажнения скорлупы дезраствором, а перед инкубацией их высушивают на воздухе.
Значительно загрязненные яйца водоплавающей птицы подвергают мойке в дезрастворах. Мойку-дезинфекцию яиц проводят в помещениях, оборудованных ванными, специальными яйцемоечными машинами или нестандартными приспособлениями для мойки, столами и вытяжной вентиляцией. Уложенные в сетчатые кассеты или инкубационные лотки яйца на 2-3 мин. замачивают в дезрастворе, моют в течение 1-2 мин., а затем обрабатывают свежим дезраствором и просушивают. Температура дезраствора должна быть на 5-8 °С выше температуры яиц, что позволяет избежать всасывания через поры скорлупы грязного дезраствора, содержащего микроорганизмы и вредные химические вещества. В 500 л рабочего раствора дезинфектанта следует обрабатывать не более 15 тыс. яиц, после чего его заменяют новым. Концентрация и состав дезрастворов могут быть скорректированы в зависимости от степени загрязненности и микробной обсемененности скорлупы яиц. Обычно для мойки яиц используют 1-1,5 % раствор перекиси водорода или хлорамина Б, формалина или ниртана, 4-5 % раствор дезмола или персинтама, 0,2-0,5 % раствор надуксусной кислоты или йодтриэтиленгликоля и т. д. При возникновении колибактериоза дополнительно проводят йодирование яиц в 0,5—1 %-ном растворе йода или хлорирование в растворе хлорной извести, содержащем 1,2-1,5 % активного хлора, а при возникновения аспергилеза их обрабатывают 5%-ным растворомѵ медного купороса.
В последнее время все более широкое применение в практике проведения ветеринарно-санитарных мероприятий в инкубатории находят санирующие препараты на основе поверхностно-активных веществ «ПАВ», представляющих собой четвертичные соединения аммония с сополимерами стирола и дивинилбензола. Эти вещества характеризуются минимальной токсичностью и запахом, они совершенно не агрессивны и не летучи, прекрасно растворимы в воде и обладают высокой моющей способностью. Растворы ПАВ проявляют выраженную микробоцидную активность, а после их высыхания на обработанных поверхностях образуется полимерная пленка, которая оказывает длительное бактериостатическое действие. Обработку яиц растворами санирующих препаратов на основе ПАВ проводят в основном путем непосредственного орошения скорлупы или создания крупнодисперсного аэрозоля. При этом, как и при применении традиционных дезинфектантов, оператор должен пользоваться средствами индивидуальной защиты, а в помещении, где проводится дезинфекция, не должно быть посторонних лиц. Рабочие растворы тех же препаратов могут быть использоваы для мойки загрязненных яиц. Обработанные яйца закладывает на инкубацию только после полного высыхания скорлупы. Для текущей санации яиц достаточно однократной обработки 0,1 %-ным раствором септодора, 0,25 %-ным раствором ВВ-1, 0,3 %-ным раствором АТМ, 0,5 %-ным раствором глютекса или бромосепта-50, 1 %-ным раствором виркона С и т.д. При неблагополучии хозяйства по инфекционным заболеваниям птицы рекомендуется проводить повторную обработку яиц аэрозолями указанных растворов непосредственно в выводном шкафу во время перевода на вывод.
Инкубационные и выводные шкафы подвергают дезинфекции перед каждой закладкой яиц на инкубацию и переводом их на вывод, а во время межцикловых профилактических перерывов проводят плановую дезинфекцию остального оборудования, инвентаря и самих помещений инкубатория. Для этого применяют низкодисперсные аэрозоли или мелкокапельное распыление таких традиционных средств дезинфекции как 1,5 % раствора криодеза, 4 % раствора надуксусной кислоты. 5 % раствора демоса, 10 % раствора однохлористого йода и т. п., а также вышеуказанных и некоторых других санитарных препаратов нового поколения. Возникновение в хозяйстве инфекционных заболеваний птицы вынуждает проводить дополнительные дезобработки оборудования и помещений инкубатория в процессе инкубации кш и вывода молодняка. Но традиционные дезинфектанты не безвредны для обслуживающего персонала и выведенного молодняка, поэтому для вынужденных дезинфекций лучше использовать санитарные препараты нового поколения, в частности — анолит (рН 2,0-3,0; ОВП 1000-1200 мВ), аэрозоли которого применяют через день, а также различные препараты на основе ПАВ, аэрозоли которых можно применять значительно реже, поскольку их бактериостатическое действие сохраняется в течение 13-18 дней. Однако при выборе конкретных препаратов этой серии необходимо иметь в виду, что некоторые из них, в частности — септодор и АТМ, недостаточно активны в отношение грибков и спор. Поэтому предпочтение следу¬ет отдать таким многокомпонентным препаратам, как зиркон С, Дез-1, Пемос-1 и проч., имеющим в своем составе перекисные соединения, а также плютексу, аламинолу, ВВ-1 и ВВ-5, содержащим альдегиды и некоторые другие фунгицидные и спороцидные вещества. В состав препарата ВВ-5, кроме того, введен пенообразователь, что позволяет использовать его для санации так называемых скрытых очагов инфекции, то есть, остатков пыли и грязи, расположенных в труднодоступных местах приточно-вытяжной системы инкубатория, воздуховодах инкубаторов и т. п.
Следует учитывать, что эффективность дезинфицирующих средств зависит от ряда факторов:
— отсутствие органического вещества в зоне санации (пух, кровь, скорлупа, меконий, грязь — дезактивируют дезинфектанты);
— тип поверхности, на которой будет применяться химикат;
— свойства растворителя, которым разбавляют химикат до рабочего состояния; температура дезинфицирующего раствора и обрабатываемой поверхности;
— использование эффективной концентрации дезинфектанта, обеспечивающей соответствующую гибель микроорганизмов;
— совместимость используемых моющих средств и дезинфектантов;
— включать в программу санации системы ротации химикатов для предотвращения развития устойчивых микробов (со временем микроорганизмы становятся устойчивыми к дезинфектанту постоянного применения).
В эпизоотически неблагополучных хозяйствах проводят также дезинфекцию воздуха выводных шкафов во время вывода молодняка птиц. Для этого на полу инкубатора ставят кюветы общей площадью 300 см2, заполненные на 8-10 см 20 %-ным раствором формалина или 20-30 %-ным раствором молочной кислоты из расчета 100-200 мл раствора на 1 м3, в системе увлажнения инкубатора используют анолит (рН 2,5; ОВП 1000-1200 мВ) вместо водопроводной воды. Выведенный молодняк птиц размещают в герметично закрытой камере (комнате) и в течение 7-15 мин. обрабатывают высокодисперсными аэрозолями 5 % раствора гекола или гексахлорофена в диэтиленгликоле в дозе 15 мл на 1 м3 воздуха. С той же целью могут быть использованы высокодисперсные аэрозоли некоторых эфирных масел или растворов антибиотиков и нитрофурановых препаратов, приготовленных на серебряной воде или 10 % эмульсии аквитала и др.
Обязательным элементом санитарной профилактики инфекций в инкубатории является бактериологический контроль качества проведенной дезинфекции различных объектов. Бактериологический контроль за качеством обработки проводят по следующей схеме: микробное число (в т. ч. кишечную и синегнойную палочку, сальмонеллы) в смывах определяют по каждой партии яиц перед закладкой; эмбрионы и цыплят исследуют один раз в месяц, а пробы воздуха, поверхностей инкубатория (стен, полов, шкафов и пр.), подстилки из ящиков, а также смывы с рук обслуживающего персонала — один раз в неделю.
Если в воздухе выводных шкафов инкубаторов в 1 г пробы пуха или пыли содержится до 300 тыс. микробных тел при отсутствии патогенной микрофлоры, то ветеринарно-санитарное состояние их можно считать удовлетворительным.
Предельно допустимая концентрация в воздухе инкубатория: пыли 1,5 кг/м3; микробов — 30-50 тыс./м’; аммиака — 10 мг/м3.
Микробиологический мониторинг и данные по сохранности при выращивании молодняка с первых дней жизни позволяют судить не только о санитарном состоянии инкубатория, но и об эффективности используемых средств и методов дезинфекции.
Здоровье птицы и биозащита
Неудовлетворительное состояние здоровья птицы имеет отрицательное воздействие на все аспекты технологии и производства, включая рост, кормоконверсию, выбраковку, сохранность и характеристики переработки.
Производство начинается со здоровых суточных цыплят хорошего качества. Необходимо получать цыплят из минимального числа родительских стад одинакового селекционного и ветеринарного статуса. Оптимально все цыплята должны быть от одного родительского стада.
Внутренняя программа контроля заболеваний включает:
- Профилактику заболеваний (программа биозащиты и/или вакцинации)
- Раннее выявление заболеваний (контроль здоровья поголовья и параметров производства)
- Лечение выявленных заболеваний Биозащита и вакцинация являются составными факторами технологического процесса.
Биозащита служит профилактике заболеваний, а эффективная программа вакцинации создает защиту от заболеваний, имеющихся в регионе.
Регулярный контроль параметров производства является критическим для раннего выявления и лечения заболеваний. Раннее выявление заболевания и лечение в одном стаде поможет предотвратить распространение болезни в соседних и последующих стадах.
Такие производственные параметры, как транспортный падеж, живая масса в 7 дней, суточный и недельный отход, потребление воды, суточный привес живой массы, кормоконверсия и выбраковка в цехе переработки необходимо регулярно контролировать и сравнивать данные с нормативными показателями хозяйства. Если параметры производства ниже ожидаемых, следует провести ветеринарное исследование стада квалифицированными специалистами.
Биозащита
Эффективная программа биозащиты критически необходима для поддержания здоровья стада. Биозащита уменьшает контакт поголовья с болезнетворными организмами. Понимание и выполнение программы биозащиты должно входить в рабочие обязанности каждого сотрудника. Для этого рекомендуется регулярно проводить обучение персонала.
При составлении программы биозащиты необходимо принять во внимание 3 компонента:
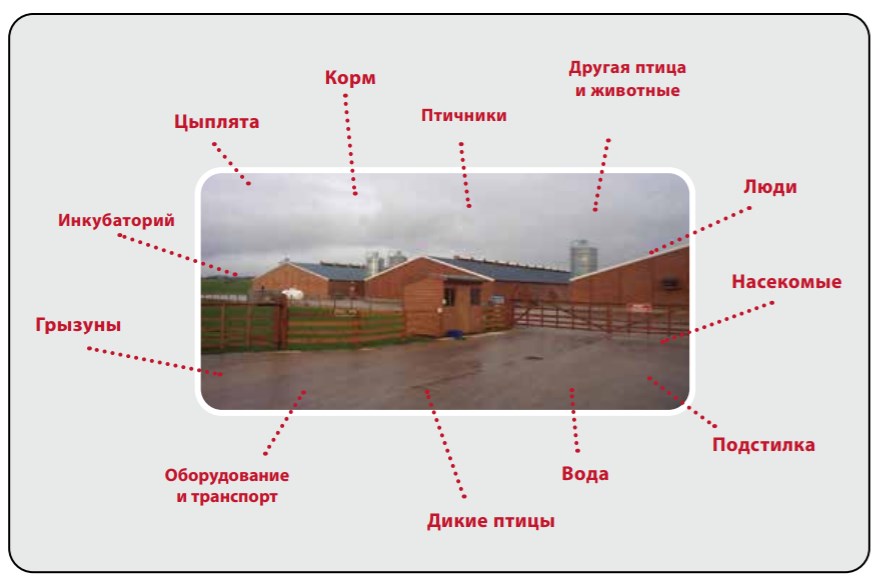
- Расположение хозяйства: Хозяйство должно располагаться так, чтобы быть изолированным от контакта с другой птицей и с/х животными — предпочтительно минимум в 3.2 км от ближайшего сельскохозяйственного производства, а также от дорог, по которым перевозится птица. Эффективнее всего создавать одновозрастные хозяйства для ограничения циркуляции возбудителей заболеваний и штаммов живых вакцин.
- Планировка хозяйства: Птичники необходимо проектировать так, чтобы сократить движение, облегчить мытье и дезинфекцию и изолировать от дикой птицы и грызунов. Рекомендуется также обнести хозяйство забором для предотвращения входа посторонних.
- Птичники должны иметь бетонные полы, водонепроницаемые стены и потолки; обязателен доступ к вентиляционным проемам; в птичниках не должно быть внутренних колонн или карнизов. Земляные полы не поддаются мытью и дезинфекции.
- Вокруг птичников должна быть создана зона шириной 15 м, на которой можно легко косить траву. Непосредственно к птичнику должна прилегать зона шириной 1-3 м, покрытая бетоном или гравием для препятствия входу грызунов и в качестве площадки для мытья и хранения оборудования во время мытья птичника.
- Производственный процесс: Следует составлять программу контроля передвижения людей, корма, оборудования и животных в хозяйстве для предупреждения переноса и распространения заболеваний. Эту программу необходимо регулярно пересматривать в случае изменения состояния хозяйства по заболеваниям.

Программа биозащиты должна быть:
- Обязательной
- Практичной в выполнении
- Экономически эффективной
- Частью программы обучения персонала
- Регулярно обновляемой
- Применяемой всей компанией и всеми сотрудниками
- Имеющей финансовую поддержку
Мытье и дезинфекция
Планирование:
Эффективное мытье хозяйства требует, чтобы все операции осуществлялись в запланированное время. Мытье площадки предоставляет возможность осуществления ремонтно-эксплуатационных работ в хозяйстве, которые должны быть включены в программу мытья и дезинфекции. Необходимо заранее составить план, включающий даты, время, человеческие ресурсы и оборудование, требуемые для мытья. Это позволит убедиться в том, что все необходимые операции будут благополучно выполнены.
Мытье площадки:
В подготовку площадки входит мытье и дезинфекция птичников с целью уничтожения всех возбудителей заболеваний птиц и людей и максимального снижения остаточного количества бактериальных организмов, вирусов, паразитов и насекомых между бройлерными турами.
Контроль насекомых:
Насекомые должны уничтожаться до того, как они перешли в деревянные детали или другие материалы. Немедленно после вывоза стада из хозяйства и пока птичники еще теплые, оборудование, подстилку и все поверхности птичника необходимо обработать рекомендуемым инсектицидом в виде спрея. Альтернативно птичники можно обработать препаратом для уничтожения насекомых за 2 недели до окончания бройлерного тура. Затем следует повторить обработку птичника до проведения фумигации.
Уборка пыли:
Всю пыль, мусор и паутину необходимо удалить из вентиляционных шахт, с балок перекрытий, карнизов, выступов и каменной кладки. Наиболее эффективно применять для этого щетки (или воздуходувную машину) таким образом, чтобы пыль падала в подстилку.
Предварительное мытье:
Для этого используется мыльный раствор, который наносится аэрозольным спрейраспылителем низкого давления на все внутренние и внешние поверхности птичника от потолка до пола для увлажнения пыли перед выносом оборудования и вывозом подстилки. В птичниках открытого типа следует сначала закрыть штору.
Оборудование:
Все оборудование и весь инвентарь (поилки, кормушки, перегородки и т.д.) необходимо вынести из здания и установить на бетонной площадке снаружи. Автоматические линии поения и кормления необходимо поднять во время мытья птичника.
Уборка подстилки:
Всю подстилку и мусор следует вывезти из птичника. Прицепы или контейнеры для мусора нужно установить внутри или рядом с птичником и наполнить грязной подстилкой из птичника. Полный прицеп или контейнер перед вывозом необходимо накрыть, чтобы не допустить сдувания ветром и падения на землю мусора и пыли. При выезде из птичника колеса автотранспорта следует продезинфицировать спреем.
Вывоз подстилки:
Подстилку не следует хранить в хозяйстве или разбрасывать ее на прилегающей к хозяйству территории. Ее необходимо вывезти за пределы на расстояние не менее 3.2 км (2 мили) от хозяйства и ликвидировать в соответствии с местным законодательством одним из следующих способов:
- Раскидать на с/х территории и вспахать не позднее 1 недели
- Вывезти на свалку, закопать в яме или карьере
- Оставить минимум на месяц для нагревания, затем раскидать на пастбищной территории
- Сжечь
- Использовать в качестве биотоплива
Мытье:
До начала мытья следует убедиться, что электроэнергия в птичнике выключена. Общий рубильник нужно отключить и запереть. Затем следует использовать пенный мыльный раствор и с помощью моечной машины под высоким давлением необходимо удалить грязь и мусор с оборудования и поверхностей птичника. На рынке есть широкий ассортимент моющих средств. При мытье важно выполнять инструкции их изготовителя. Моющий раствор должен быть совместим с применяемым позже дезинфектантом. После мытья мыльным раствором обязательно промыть поверхности птичника и оборудование чистой свежей водой, используя моечную машину под высоким давлением. Делается это горячей водой, после чего воду с пола требуется удалить, используя скребок с резиновой лентой. Грязную воду следует убирать из птичника так, чтобы не было риска ее вторичного попадания в птичник. Все оборудование, вынесенное из птичника, также необходимо смочить, вымыть и ополоснуть, после чего вымытое оборудование закрывают пленкой.
Во время мойки внутри птичника особое внимание требуется уделять следующим точкам:
- Вентиляционные блоки
- Вентиляционные шахты и проемы
- Вентиляторы
- Решетки вентиляторов
- Верхняя поверхность потолочных балок
- Выступы
- Трубы системы поения
- Линии кормления
Для мытья труднодоступных точек птичника рекомендуется использовать переносные лестницы и портативное освещение. Наружные стены птичника также необходимо вымыть, уделяя особое внимание следующим точкам:
- Приточные форточки
- Водосточные желоба
- Бетонные дорожки
В птичниках открытого типа следует вымыть внешнюю и внутреннюю поверхность штор. Материал, который не поддается мытью (полиэтилен, картон), необходимо уничтожить.
После окончания мытья не должно оставаться грязи, пыли, мусора и остатков подстилки. Эффективное мытье требует времени и внимания к деталям.
Помещения для сотрудников, а также все оборудование в них необходимо на этой стадии также тщательно вымыть.
Мытье системы поения и кормления
Все оборудование внутри птичника должно быть тщательно вымыто и продезинфицировано. После мытья важно накрыть оборудование, чтобы избежать его загрязнения.
Система поения.
Метод мытья системы поения следующий:
- Слить воду из труб и баков.
- Промыть линии чистой водой.
- Вымыть и выскрести баки для воды, удалив налет и биопленку, затем слить грязную воду за пределами птичника.
- Наполнить бак чистой водой и добавить дезинфицирующее средство для питьевой воды.
- Пропустить дезинфицирующий раствор через линии поения, проверив, не возникли ли в трубах воздушные пробки. Дезинфицирующее средство должно быть разрешено для использования, и его следует разводить в рекомендуемой дозировке.
- Наполнить бак водой в нормальном объеме, добавляя дезинфицирующее средство в рекомендуемой дозировке. Закрыть бак крышкой. Оставить дезинфицирующий раствор в баке минимум на 4 часа.
- Слить раствор и наполнить бак свежей водой.
- Вновь наполнить бак чистой водой перед прибытием цыплят.
Внутри линий поения образуется биопленка, которую необходимо регулярно (минимум 1 раз за тур) удалять для того, чтобы не допустить уменьшения напора и бактериального заражения воды. Перед каждым бройлерным туром рекомендуется проводить очистку воды до применения дезинфицирующего средства. На образование биопленки влияет материал, из которого изготовлены трубы. Например, в алкатеновых трубах и пластиковых баках биопленка развивается быстрее. Применение витаминов и минеральных добавок в питьевой воде может ускорять развитие биопленки и прилипание загрязнений к поверхности труб. Физическая чистка внутренней поверхности труб для удаления биопленки не всегда возможна, поэтому в период санразрыва можно удалять биопленку с помощью высококонцентрированного раствора (140 мг/л) хлора или перекиси водорода (раствор двуокиси хлора в рекомендуемой пропорции также применяется). Эти растворы затем необходимо полностью удалить из системы поения методом промывания чистой водой. В процесс мытья может входить чистка кислотой при высоком минеральном содержании воды (особенно кальция и железа). Металлические трубы моются так же, но коррозия труб может вызывать утечки воды. Обработка питьевой воды перед использованием может быть необходима в регионах с высоким содержанием минеральных солей в воде.
Системы охлаждения испарением и туманообразования можно обрабатывать в период мытья птичника, применяя бигуанидный дезинфекционный раствор. Бигуаниды могут также применяться также в период производства для снижения бактериального числа в системе поения и предотвращения попадания их в микроклимат птичника.
Необходимо применять следующий метод мытья системы кормления:
- Опорожнить, вымыть и продезинфицировать оборудование кормления, т.е. накопительные баки, транспортер, цепь и подвесные кормушки
- Опорожнить кормовые баки и соединительные трубы, вычистить щеткой, где возможно. Вычистить и герметично закрыть все отверстия
- Обработать формалином, где это возможно
Ремонтно-эксплуатационные работы
Чистый пустой птичник предоставляет идеальную возможность для ремонтно-эксплуатационных работ. При этом следует уделять особое внимание следующим видам работ:
Заделать трещины в полу бетонным или цементным раствором • Починить кладочные швы и повреждения стен • Починить или заменить поврежденные стены, шторы и потолки • Покрасить или побелить стены там, где необходимо • Починить прокладки дверей • Проверить эффективность работы вентиляции, системы отопления, заслонок приточных форточек и всего контролирующего оборудования • Затянуть вентиляционные ремни и отремонтировать вентиляционные затворы
Каждое хозяйство должно иметь набор инструментов для выполнения основных ремонтно-эксплуатационных работ. Это ограничивает необходимость вносить инструменты из-за пределов хозяйства.
Дезинфекция
Дезинфекция должна проводиться только после того, как все здание (включая наружные стены) вымыто, все ремонтные работы завершены, и птичник, и оборудование высохли. Дезинфицирующие средства малоэффективны при контакте с грязью или органическим материалом и теряют свою эффективность на влажных поверхностях изза уменьшения концентрации дезинфицирующего средства.
Дезинфицирующие средства, разрешенные для использования местными органами, для контроля возбудителей заболеваний птицы как бактериального, так и вирусного типа, являются наиболее эффективными. При их применении необходимо выполнять инструкции изготовителя. Дезинфицирующие средства применяются с помощью оборудования для мытья высокого давления либо переносного спрей-оборудования.
Пенистые дезинфицирующие средства имеют более длительное время реакции с обрабатываемой поверхностью, поэтому намного эффективнее. После обработки птичника можно улучшить дезинфекцию, если нагреть закрытый птичник до высокой температуры.
Большинство дезинфицирующих средств не имеют влияния на спорулированные кокцидиальные ооцисты. При необходимости противококцидиальной обработки можно эффективно использовать препараты, выделяющие аммиак; при этом обработку должен проводить только специально обученный персонал! Эти средства наносятся на все чистые внутренние поверхности и будут эффективны даже при таком коротком периоде реакции с поверхностью, как несколько часов.
Обработка формалином
В регионах, где разрешено применение формалина, обработка формалином должна осуществляться сразу после завершения дезинфекции. Поверхности должны быть влажные (это можно обеспечить, используя установки туманообразования для увеличения относительной влажности птичника), а птичник необходимо нагреть до температуры, минимум, 21oC (70oF). Фумигация неэффективна при более низкой температуре и относительной влажности менее 65%.
Двери, вентиляторы, решетки вентиляторов и окна необходимо закрыть. Следует также выполнять инструкции изготовителя формалина по его применению. После обработки птичник нужно оставить закрытым и установить на дверях предупредительные знаки ВХОД ЗАПРЕЩЕН на дверях. До входа в птичник его следует тщательно провентилировать.
После укладки свежего подстилочного материала требуется повторить обработку формалином, как описано выше. Формалин является вредным веществом как для людей, так и для животных и не разрешен для применения в некоторых странах. Там, где это разрешено, обработка формалином должна проводиться обученным персоналом, применяющим местные правила техники безопасности. Также важно выполнять правила личной безопасности, включая использование защитной одежды (респираторы, защитные очки и перчатки). Минимум два человека должны находиться в птичнике во время фумигации.
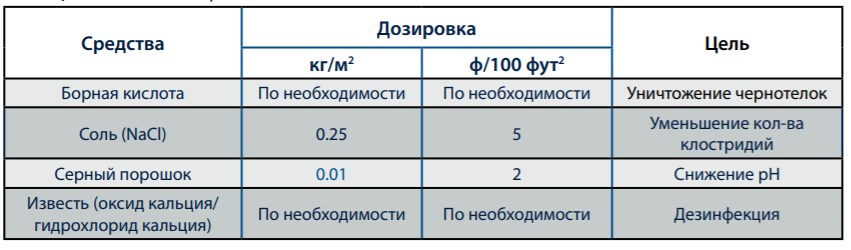
Обработка пола В отдельных ситуациях требуется также проводить обработку пола. Некоторые средства обработки приводятся в Таблице
Уборка прилегающей территории
Важно, чтобы территория, прилегающая к птичникам, также подвергалась тщательной очистке. Оптимально птичники должны быть окружены бетонной отмосткой или гравием шириной 1-3 м. Если этой зоны не существует, прилегающая к птичнику территория должна:
- Быть свободной от растительности
- Не использоваться для хранения оборудования/инвентаря
- Иметь гладкую ровную поверхность
- Иметь хороший сток воды, не иметь луж
Особое внимание должно уделяться уборке и дезинфекции следующих зон:
- Под вентиляторами и вытяжными проемами
- Под кормовыми бункерами
- Подходы к зданию
- Зона вокруг входа в птичник
Все забетонированные поверхности необходимо вымыть и продезинфицировать так же тщательно, как и внутри здания.
Оценка качества мытья и дезинфекции хозяйства
Необходимо также применять систему оценки качества мытья и дезинфекции. Эффективность мытья обычно оценивается исследованиями на сальмонеллу, а также на общее микробное число (ОМЧ). Эти два исследования следует проводить минимум один раз за бройлерный тур. Контроль изменения результатов исследования сальмонеллы и ОМЧ позволяют улучшать гигиену хозяйства, а также сравнивать эффективность различных методов мытья и дезинфекции. Если дезинфекция эффективна, при исследовании образцов не будет выявлено возбудителей сальмонеллы. Для подробного описания методов взятия образцов для исследования и рекомендаций рекомендуется посетить раздел услуги
- Для обеспечения биозащиты площадки необходимо составить программу гигиены хозяйства, включающую программы мытья и дезинфекции.
- Эффективная биозащита не позволит возбудителям инфекционных заболеваний проникать в хозяйство через людей или животных.
- Мытье площадки должно включать интерьер и экстерьер птичников, а также системы поения и кормления
- Также необходимо иметь и применять систему оценки качества мытья и дезинфекции.
Качество воды
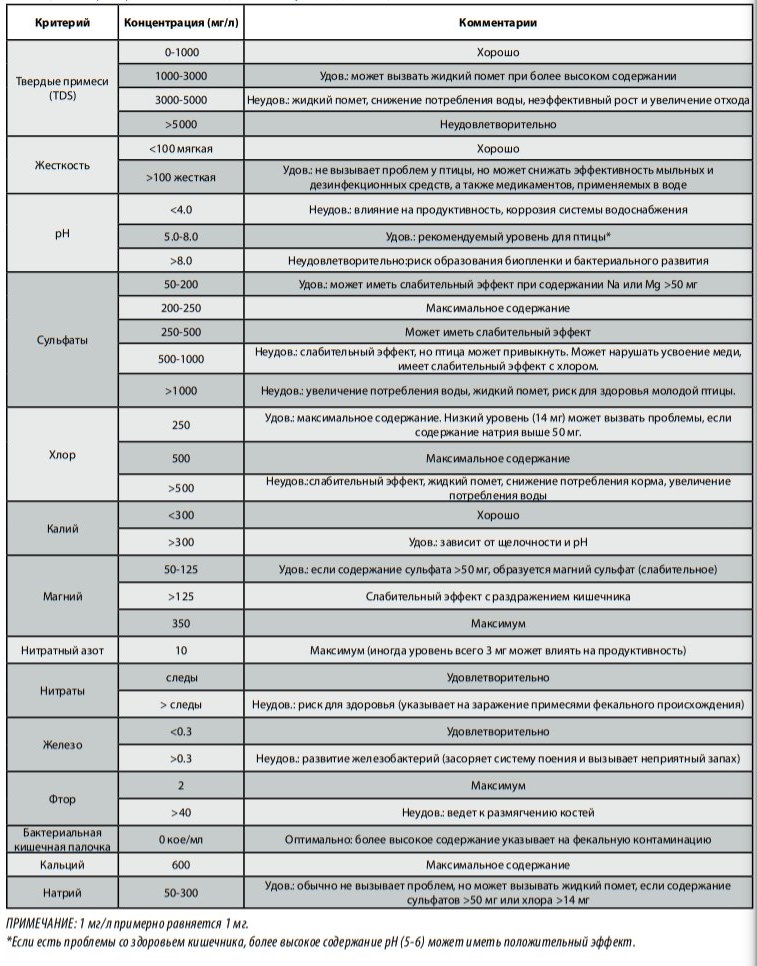
Питьевая вода должна быть чистой, без органических примесей и осадка. Необходимо контролировать чистоту воды и отсутствие в ней возбудителей заболеваний. Особенно важно, чтобы вода была свободной от видов Pseudomonas и Escherichia coli. Вода не должна содержать более одной кишечной палочки на 1 мл в любом произвольно взятом образце, а последующие пробы могут содержать кишечную палочку максимум в 5% взятых образцов.
Критерии качества воды приводятся в Таблице ниже .Если вода поступает из водопровода, ее качество, как правило, не вызывает опасений. Однако вода из артезианских скважин может иметь избыточный уровень нитратов и высокое микробное число как результат загрязнения колодца водой, стекающей с полей, обработанных удобрениями.
При высоком общем микробном числе следует найти и немедленно выявить и уничтожить бактериальный источник. Хлорирование концентрацией 3-5 мг/л на высоте поилок обычно является эффективным способом контроля бактериального загрязнения, но это зависит от типа используемого хлора. Показатель рН воды должен составлять 5-7 для эффективности обработки хлором. Измерение окислительно-восстановительного потенциала (ОВП) воды является оптимальным методом определения эффективности применяемой программы дезинфекции воды. Счетчик ОВП измеряет объем кислорода в воде и дает представление о чистоте воды, а также возможности воды разрушать загрязняющие примеси. Чем больше примесей в воде, тем меньше содержание в ней кислорода. Значение ОВП 700-800 мВ указывает на то, что программа дезинфекции воды хлором будет эффективна для контроля большего числа потенциального бактериального заражения воды и распространения инфекции в стаде из источника воды.
Для дезинфекции воды можно также применять ультрафиолетовый свет (в точке поступления воды в птичник). При применении этого метода следует выполнять инструкции производителя.
Жесткая вода или вода с высоким содержанием железа (>3 мг/л) может вызывать засорение клапанов поилок и труб, а также вести к развитию бактериальной среды. Осадок засоряет также водопроводные трубы, и в таких ситуациях рекомендуется фильтровать поступающую воду с помощью сетчатого фильтра с размером ячейки 40-50 микрон. Минимум раз в год или чаще, если существуют проблемы с водой или продуктивностью поголовья, следует проводить общее исследование воды. После мытья птичника до прибытия цыплят необходимо взять образцы воды и исследовать их на бактериальное заражение в источнике, в баке и точках поения.
Также хорошей практикой является регулярная проверка качества питьевой воды во время бройлерного тура. Для этого стоит проверить поступление воды в каждой ниппельной линии и сделать визуальную оценку ее чистоты. Если дезинфекция линий поения и воды неудовлетворительная, в воде будут содержаться твердые примеси, видимые невооруженным глазом. В этом случае необходимо принять меры по выявлению причины нарушения и ее устранению.
- Высокое качество питьевой воды важно для здоровья и благополучия поголовья.
- Требуется регулярно исследовать качество воды на бактериальное и минеральное содержание и принимать меры при необходимости.
Уничтожение отходов производства
Способы уничтожения отходов производства, а также преимущества и недостатки каждого из них приводятся в Таблице
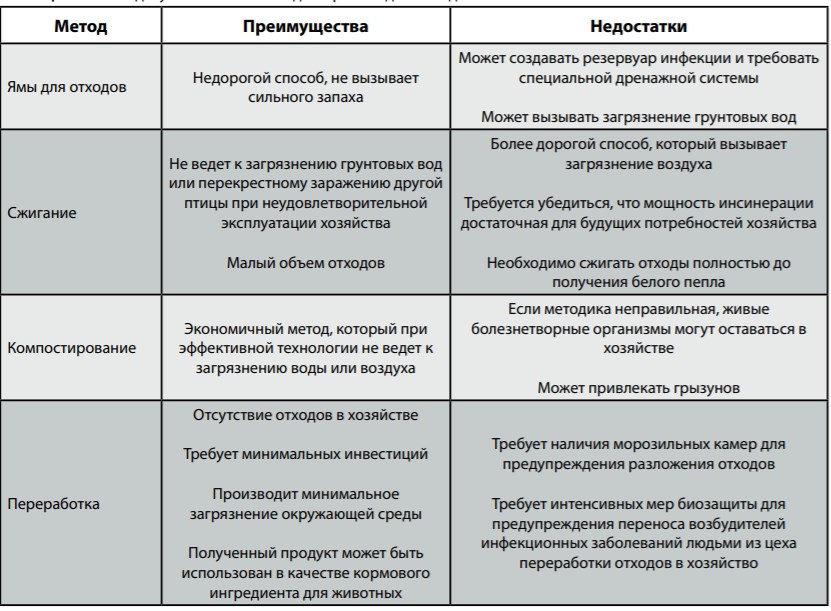
- Отходы производства (падеж) уничтожаются таким образом, чтобы не допустить загрязнения окружающей среды, перекрестного заражения другой птицы или других животных, чтобы не мешать соседям и выполнять требования местного законодательства.
Снижение риска заболеваний
Предупреждение переноса возбудителей заболеваний людьми
- Ограничить число посетителей и число транспортных средств, въезжающих в хозяйство.
- Все посетители хозяйства должны выполнять программу биозащиты, включая принятие душа и смену одежды.
- Вести контроль посетителей, записывая имя, компанию, цель посещения, предыдущие и следующие посещения.
- При входе и выходе в каждый птичник рабочие и посетители обязаны вымыть и продезинфицировать руки и обувь. В некоторых случаях применятся спрей-обработка посетителей.
- Инструменты и оборудование, вносимые в птичник, являются потенциальным источником инфекции. Только необходимый инвентарь должен вноситься в птичник, и только после его мытья и дезинфекции.
- Если персоналу необходимо посетить более одного хозяйства в день, хозяйство с более молодой птицей должно быть первым.

Предупреждение переноса возбудителей заболеваний животными
- При возможности применять принцип «пусто/занято» в хозяйстве.
- Санразрыв между бройлерными турами сократит риск заражения хозяйства. Период санразрыва определяется как «время между окончанием мытья хозяйства и посадкой следующего стада». Решение о продолжительности санразрыва диктуется экономическими предпосылками, но чем дольше разрыв между турами, тем меньше риск заражения следующего поголовья.
- Не оставлять оборудование, строительные материалы или подстилку на площадке. Это снизит возможность укрытия для грызунов и диких животных.
- Убирать просыпанный корм с земли как можно быстрее.
- Хранить подстилочный материал в мешках, бункере или помещении.
- Не позволять проникновение дикой птицы в птичники с помощью изоляции проемов птичника. Все проемы и отверстия в здании должны быть закрыты.
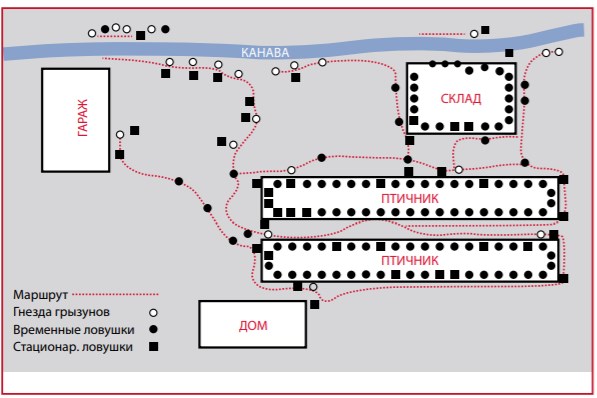
- Применять эффективную программу контроля грызунов, включающую механический, биологический и химический контроль. Наиболее эффективна программа применения отлова с наживкой, если применять ее непрерывно.
- Эффективная программа контроля грызунов приводится на Рис
Вакцинация
Вакцинация создает поголовью защиту против специфических возбудителей инфекционных заболеваний путем введения в организм птицы безопасного количества инфекционных организмов (антигенов). В современном производстве эффективная технология вакцинации является неотъемлемой составляющей производства бройлерного поголовья.
Программу вакцинации следует составлять после консультации с ветеринарным врачом, принимая во внимание уровень давления полевых штаммов. Таблица ниже перечисляет основные факторы для составления эффективной программы вакцинации бройлерного поголовья.
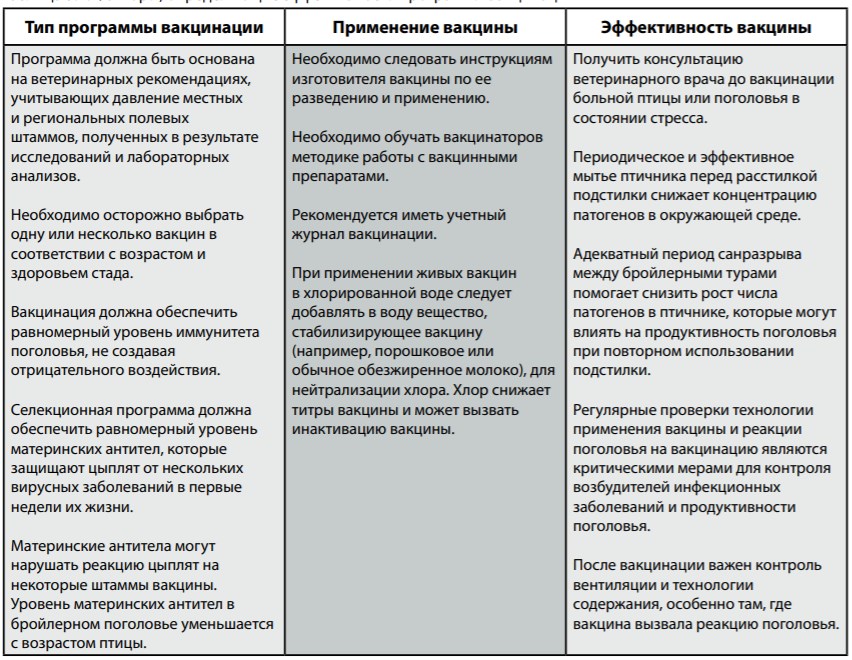
- Программа вакцинации для бройлерного поголовья должна составляться с участием квалифицированного ветеринарного врача и должна учитывать местные полевые штаммы и наличие вакцины.
- Вакцинация более эффективна, когда риск возникновения заболеваний сведен к минимуму с помощью эффективной программы биозащиты и содержания поголовья.
- С помощью одной вакцинации невозможно защитить поголовье при значительном контакте с источниками заражения и при неэффективной технологии содержания стада.
- Каждая птица в стаде должна получить запланированный объем вакцины.
- При составлении программы вакцинации бройлерного поголовья необходимо учитывать программу вакцинации родительского поголовья.
Исследование заболеваний
Исследование заболеваний требует знания состояния поголовья в каждом возрасте и умения определять признаки отклонения от нормы в поведении стада. Важно при этом знать нормативные параметры производства для данного кросса.
При появлении признаков заболевания в стаде требуется немедленно получить консультацию ветеринарного врача.
Также рекомендуется иметь хорошее представление о региональном или местном напряжении полевых штаммов, которые могут вызвать заболевание стада.
Для поддержания оптимального здоровья поголовья требуется систематичный подход. Вот список параметров, которые необходимо при этом всегда учитывать:
- Корм: доступность, потребление, раздача, вкусовые качества, питательность, вредные для здоровья и токсичные добавки.
- Освещение: достаточное для эффективного роста и развития, однородное распределение освещения и интенсивности.
- Подстилка: применяемый материал, глубина, равномерность толщины, уровень влажности, патогенная нагрузка, токсины и посторонние добавки.
- Воздух: скорость, доступность, влажность, температура, газы (аммиак и вредоносные газы) и препятствия для воздушного потока.
- Вода: доступность, потребление, раздача, источник, осадок и токсины, патогенная нагрузка, добавки и дезинфицирующие средства.
- Площадь: интенсивность содержания, препятствия, оборудование, ограничивающее передвижение птицы, наличие корма и воды.
- Дезинфекция: гигиена птичника, контроль вредителей и грызунов, эксплуатация, методика мытья и дезинфекции (птичника и территории, кормушек, поилок и кормовых бункеров).
- Защита: риски для системы биозащиты (планировка птичников и программа биозащиты).
Таблицы ниже демонстрируют параметры отхода, связанные либо с качеством птицы, либо со здоровьем поголовья. В таблицах также предлагается метод оценки ситуации, используя подход, упоминавшийся ранее.
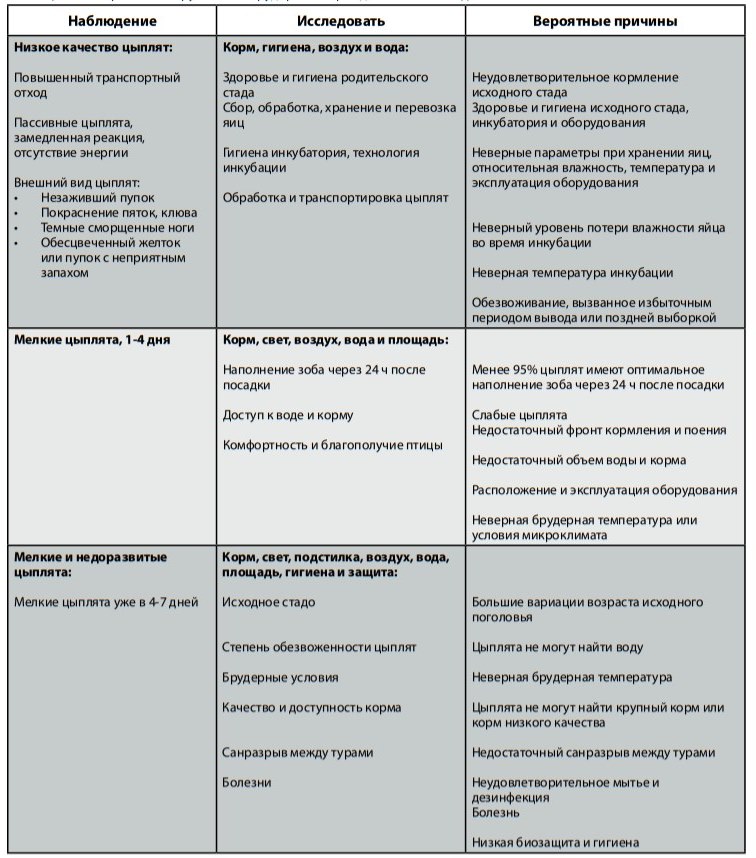
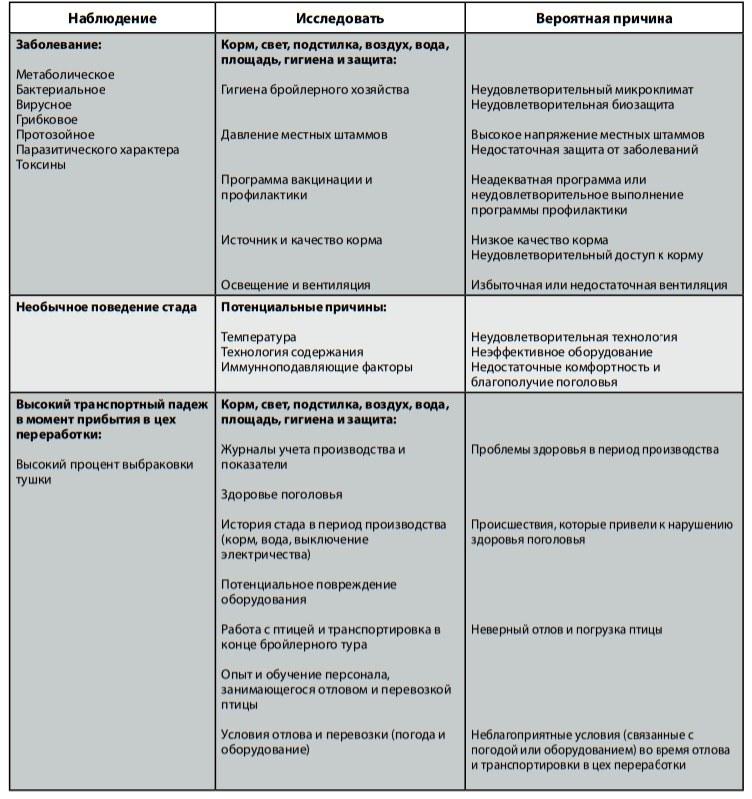
- Следует знать оптимальное состояние стада и принимать меры при замеченных изменениях.
- Наблюдать. Исследовать. Выявлять. Действовать
- Применять систематический подход. Выявлять в первую очередь очевидные нарушения.
Диагностика заболеваний
Выявление проблем в состоянии здоровья птицы состоит из нескольких этапов.
При диагностике заболевания, планировании и применении стратегического контроля важно помнить, что более тщательное исследование заболевания ведет к более точному диагнозу и более эффективному его лечению.
Раннее распознавание заболеваний в стаде является критическим. Изменения в потреблении корма, и, особенно в потреблении воды, являются первыми признаками болезни, что объясняет важность контроля потребления корма и воды. Также необходимо ежедневно наблюдать за птицей, ее поведением и любыми изменениями в поведении стада.
Таблица ниже демонстрирует несколько способов, помогающих определять признаки заболеваний.
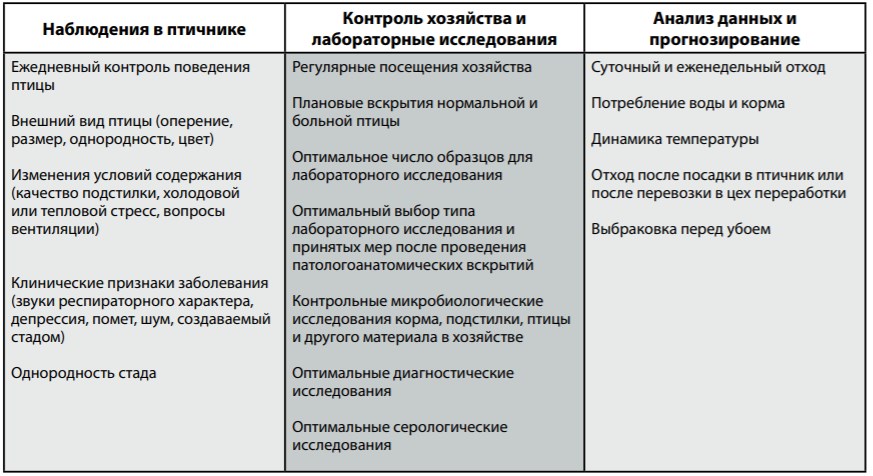
- Ежедневное наблюдение
- Точный учет
- Систематическое исследование заболеваний
Поделиться статьей в социальных сетях:
2. Санация птицеводческих помещений
В промышленном птицеводстве сохранение здоровья птицы, повышение ее продуктивности и получение доброкачественной продукции всегда были и будут наиболее важными задачами. А в связи с полной оторванностью выращиваемого поголовья от естественной среды обитания, из — за того, что птица постоянно содержится в помещениях птицефабрик возникает необходимость создания таких оптимальных условий содержания и кормления, при которых сохранялось бы и здоровье и продуктивность бройлеров и несушки.
Однако в последние годы сложное экономическое положение вынуждает многие птицеводческие предприятия длительно эксплуатировать одни и те же помещения для содержания птицы и ограничивать проведение санитарно — гигиенических мероприятий (Канифова Р.Р., 2003 г). Это ведет к росту обсемененности птичников условно-патогенной и патогенной микрофлорой, состав и многообразие которой регулярно меняется. Установлено, что высокая бактериальная загрязненность воздушной среды способствует возникновению инфекций и не только бактериальных, но и вирусных (Резник Н.К., 1990 г).
Взаимодействие макроорганизма птицы не с одним, а с целым рядом микроорганизмов различных таксономических групп, приводит к стрессовому состоянию, вследствие чего снижается общая и специфическая резистентность и на этом фоне развиваются инфекции различной этиологии.
Повышение бактериальной обсемененности птичников способствует также высокой контаминированности не только организма птицы, но и продукции птицеводства, что снижает ее качество и может стать причиной заболеваний людей.
В этой связи санация ветеринарных объектов птицеводства является актуальной проблемой в повышении эффективности производства и улучшении качества птицеводческой продукции.
Исследование микробного фона на птицефабриках проводятся регулярно многими научноисследовательскими институтами. В различных регионах России эти показатели разннятся и зависят от многих факторов: климатических условий региона, вида направления фабрики — бройлерное или яичное, года ввода в эксплуатацию производственных мощностей, оснащенности, удаленность друг от друга птицеводческих цехов или площадок (бройлерный, ремонтный молодняк, родительское стадо), профессионализмом управленческого аппарата, специалистов, обслуживающего аппарата и в самую последнюю очередь от эпизоотической обстановки.
Как ни парадоксально это покажется, но за последние 25 лет в сельском хозяйстве многое поменялось кардинально. Если в 70 — х — 80 — х годах в ветеринарном законодательстве и книгах по ветеринарии писали только об усилении контроля ветеринарными специалистами за объектами ветеринарного надзора, мониторингом эпизоотической обстановки на благо повышения продуктивности в виде среднесуточных привесов и количества яйца, то на сегодняшний день приходится говорить о том, что порой усилия ветеринарных врачей полностью невелируются безграмотным руководством фабрик и халатностью обслуживающего персонала цехов, который часто набирается из временных гастробайтеров.
На местах это приводит к тому, что самые очевидные вещи ветеринарным врачам птицефабрик приходится не просто объяснять руководству и персоналу, а повторять несколько раз в разных вариациях, словно мантру. Хотя еще нексколько лет назад распоряжения главного ветеринарного врача и врачей отделений выполнялись беспрекословно.
Так в среднем наибольшая бактериальная загрязненность и относительная влажность воздуха в птичниках наблюдается в зимний и весенний периоды года. Зачастую это связано с плохим, нерегулируемым воздухообменом. Это касается площадок и с новым оборудованием, и со старым. Встречаются фабрики, где на вопрос: «Какое у вас оборудование?» отвечают с энтузиазмом: «Новое, новейшее». А на вопрос: «Как дела с воздухообменом?» можешь услышать несколько вариантов ответов: «Оборудование — то новое купили, а данные для воздухообмена подсчитали неверно и в корпусе то холодно, то жарко, то скорость движения воздуха маленькая, то наоборот с ног сшибает», или «да, оборудование новое, но датчиков температуры установили мало, на весь зал не хватает и в узких проходах между батареями клеток несушка в летнее время дохнет по 200 штук в день в жаркую погоду, т.к. движения воздуха в этих местах нет совсем (0,1 м/с)» и т.д.
В корпусах, где нет электронного оборудования для контроля воздухообмена еще сложнее. Там температуру и влажность регулируют и зимой, и летом при помощи механизма «пойди — открой воздушный люк — пойди закрой воздушный люк!». И получается, что зимой, при открывании люка холод опускается на внизу расположенную птицу, снижается ее резистентность (а вы знаете, что здоровую курицу или цыпленка после 21 дней возраста с хорошими условиями кормления и содержания заразить ничем практически невозможно.
Как — то был случай в институте птицеводства. Один научный сотрудник должен был провести эксперимент по изучению вирулентных свойств одного из микроорганизмов на цыплятах, а в виварии были только 28 — суточные цыплята яичной породы, младше, т.е. суточных, не было. Делать нечего стали заражать таких. Вначале надо было найти LD50, а цыплята не только не дохнут, но даже нет клинических признаков заболевания.
Когда в очередной раз при увеличении дозы заражающей культуры никто из подопытных не погиб, — в отчаянии этот научный сотрудник решился сначала снизить естественную резистентность птиц методом охлаждения их холодной водой, а затем заразил минимальной дозой заражающей культуры. Эффект был потрясающим!
Наконец — то кончились его мытарства. Цыплята начали дохнуть и эксперимент вошел в свое рабочее русло) начинает активизироваться патогенная и условнопатогенная бактериальная микрофлора. Если учесть, что 1 бактериальная клетка E.сoli может делиться каждые 20 минут и в течение суток, то есть через 72 деления, она теоретически может дать 4 700 000 000 000 000 000 000 клетки. Можно представить, какое огромное количество микробных тел ежедневно выбрасывается в это время в воздух больными курами.
На одной из фабрик по производству яйца в осеннеезимний период обслуживающий персонал корпуса промышленного стада несушки ушел на длительный больничный лист по нетрудоспособности из — за того, что у них развились гнойные конъюнктивиты и они просто ничего не видели и не могли работать. Вот до такой степени был загрязнен воздух в помещении птичника.
По результатам исследования Канифовой Р.Р. (2003г) в корпусах по выращиванию ремонтного молодняка в зимний период концентрация микробных тел в 1 см3воздуха выше нормы в 4,1 раза; в птичнике по содержанию промышленного стада концентрация микробных тел в 1 см3воздуха выше нормы в 16,1 раза; в птичнике по содержанию родительского стада в 7,2 раза. Относительная влажность воздуха в зимнеевесеннее время варьировала от 69 до 92%.
Превышение норм по уровню микробной обсемененности воздуха помещений в весеннее время в птичниках по выращиванию ремонтного молодняка отмечалось в 3,1 раза, для родительского стада в 4,6 раза, для промышленного стада — в 14,2 раза.
В осенний период численность микроорганизмов не превышала допустимый уровень. В летнее время численность микроорганизмов в воздухе превышала незначительно допустимый уровень.
Справедливости ради надо сказать, что на этой птицефабрике так было не всегда, а только после того, как руководство побывало за рубежом, в американских птичниках. После этого обмена опытом было отдано распоряжение отменить еженедельные санитарные дни и ежедневную уборку помещений, где содержится птица (причем это распространялось и на стадо ремонтного молодняка и на цех промышленной несушки), мотивируя это тем, что «…в Америке и вообще за рубежом это не делается и вообще там даже не после каждого тура проводят санацию помещений, и там везде свисает паутина и падеж никто ежедневно не убирает, чтобы не тревожить птицу».
Все так и не так. Во — первых: там нет такой концентрации поголовья кур, а это очень важный момент. Во-вторых: именно потому, что в США птица действительно по нескольким (два — три) турам содержится на несменяемой подстилке, Америка имеет почти все вариантные штаммы вирусных болезней кур, идентифицированных в настоящее время. Именно оттуда к нам, в Россию и были завезены с инкубационным яйцом или суточным молодняком все многообразие вариантных штаммов вирусных болезней кур, не из Европы и не из Азии.
Все мы знаем, что ветеринарная служба в Советском союзе была организована на самом высоком уровне, дейтвовала эффективно и оперативно на всех этапах от производства до потребления, на границе, в военной обороне, в агропромышленном комплексе, в контроле за производством продуктов питания и т.д., а потому, несмотря на трудные условия сегодняшней работы ветеринарных специалистов, они все — таки выполняют необходимые ветеринарно — санитарные условия и требования, предъявляемые к птицефабрикам закрытого типа.
Важнейшим звеном в технологическом цикле птицеводческого предприятия является санация птицеводческих помещений, как ведущая составляющая в системе профилактических и противоэпизоотических мероприятий, обеспечивающих благополучие животных, включая птиц, по инфекционным, инвазионным болезням, а также в обеспечении безопасности человека в отношении зоонозов и соблюдении санитарного качества продуктов, сырья и кормов животного происхождения.
Под санацией определяют комплекс профилактических или вынужденных мероприятий, включающий механическую очистку, влажную обработку (мойку), дезинфекцию, дезинсекцию, дезинвазию, дератизацию объекта; при необходимости в этот процесс включают профилактический ремонт помещения. При благополучии по инфекционным болезням санацию птицеводческих помещений проводят в профилактические санитарные разрывы.
Механическая очистка это удаление механических и органических загрязнений, при котором видны структура и характер поверхности, цвет ее материала. Механическая очиска является первым подготовительным этапом к проведению дезинфекции. С помощью очистки создаются условия для лучшего доступа дезинфицирующих веществ к оставшимся на поверхности возбудителям инфекционных болезней.
Дезинсекция это мероприятия, направленные на уничтожение эктопаразитов сельскохозяйственных животных.
Дезинвазия это методы обеззараживания поверхностей оборудования, полов, почвы и др. при контаминации возбудителями инвазионных болезней (яиц и личинок гельминтов и ооцист кокцидий).
Дератизация это методы искоренения мышевидных грызунов на территории сельскохозяйственных предприятий, комплексов и птицефабрик.
Дезинфекция это способы и средства уничтожения патогенных и условно — патогенных микроорганизмов во внешней среде; одна из мер комплекса борьбы с инфекционными болезнями, воздействующая на возбудителей болезней. Дезинфекция слагается из двух взаимодополняющих приемов: очистки помещения и нанесения растворов дезинфицирующих средств.
Дезинфекция, дезинсекция, дезинвазия и дератизация являются важнейшим звеном в системе профилактических, противоэпизоотических мероприятий, обеспечивающих благополучие животных, включая птиц, по инфекционным, инвазионным болезням, безопасность человека в отношении зоонозов, санитарное качество продуктов, сырья и кормов животного происхождения. Основное назначение этих мероприятий — разорвать эпизоотическую цепь путем воздействия на ее важнейшее звено — факторы передачи возбудителя болезни от источника инфекции к восприимчивому организму.
Для эффективности проводимых мероприятий необходимо соблюдать условия, при которых дезинфицирующее средство может проявить максимальный бактерицидный эффект.Такими условиями, которые приходится учитывать при дезинфекции, являются:
а) среда, в которой происходит контакт между микроор-
ганизмом и дезинфицирующим средством;
б) температура раствора и обеззараживаемого объекта;
в) концентрация и норма расходования дезинфицирую-
щего раствора;
г) экспозиция;
д) способ обработки обеззараживаемого объекта.
Среда, в которой происходит контакт дезинфицирующего средства с микробной клеткой, может либо способствовать ее уничтожению, либо препятствовать этому. Например в жидкой среде, каковой является вода, химические вещества растворяясь способствуют более быстрому и тесному контакту с микробной клеткой. Непосредственно контактируя с клеткой дезинфектант проникает внутрь нее и ускоряет гибель патогена.
Обычная среда обитания микроорганизмов, состоящая из жиров (на перерабатывающих предприятиях) и белков (корма, перо, пух, помет) на птицефабриках сохраняет их жизнеспособность и затрудняет доступ дезинфектантов к бактериям. В этом случае обеззараживающий эффект не наступает. Это необходимо учитывать при проведении подготовительных работ для дезинфекции. Чем тщательнее объект будет очищен, тем эффективнее будет проведена дезинфекция.
Следует отметить, что органические вещества (помет, кровь, перо, пух), не только предохраняют микробную клетку от воздействия на неѐ дезинфектанта, но часто, вступая в химическое взаимодействие с дезинфектантом, инактивируют его и образуют новые соединения, не оказывающие губительного действия на микробную клетку.
Немаловажное значение имеет также способность органических веществ адсорбировать химическое средство из раствора, в результате чего последний становится неактивным.
Известно, что все микроорганизмы особым образом структурированы в ассоциации или, биопленки, в которых колонии бактерий защищены слоем защитного биополимерного матрикса, что позволяет им выживать в неблагоприятных условиях. (Lewis, 2001).
В таких биопленках (сообществах) устойчивость бактерий высока и очень отличается от устойчивости одиночных микроорганизмов. По данным (Brown et al., 1993), бактерии в сообществе в 20 — 1000 раз более устойчивы к антибактериальным препаратам, чем одиночные микроорганизмы в лабораторных условиях.
Основным фактором устойчивости микробных пленок является слизистый биополимерныйматрикс (БПМ), вырабатываемый клетками бактерий сразу после прикрепления их к субстрату. Основным контактным механизмом БПМ являются полисахариды клеток.
Являясь антигенами, они и во внешней среде работают по принципу: антиген — антитело, т.е. могут вступать в контакт с веществами окружающей среды и либо ассимилировать их для выполнения собственных функций, либо блокировать или нейтрализовывать их действие, оставаясь в безопасности от действия дезинфектантов. По данным Ronner et al (1993 г) устойчивость рода Salmonella к хлорсодержащим препаратам объясняется именно образованием микробной пленки этих бактерий.
Так, средства на основе четвертично-аммониевых соединений (ЧАС) оказались неэффективны против биопленок E. coli, Pseudomonas, Listeria и S. aureus даже в повышенныхконцентрациях (Campanac et al.,2002 г). Этот же механизм является причиной устойчивости микробных пленок к бигуанидам (Wright et al., 1987). Такие средства, как соли тяжѐлых металлов, кислоты, способные коагулировать белок и образовывать сгустки, оседают с коагулировавшими веществами и частично или полностью теряют свою дезинфекционную активность, так как присутствие в воде минеральных солей (особенно фосфатов и сульфатов) значительно повышает электроотрицательность биополимерного матрикса и тем самым снижает эффективность антимикробных обработок, а двухвалентные катионы кальция и магния увеличивают вязкость и эластичность биополимерного геля микробных пленок, что затрудняет процесс очистки поверхностей
(Sutherland, 1990).
Можно сделать вывод, что наносить дезинфектанты следует лишь на поверхности, освобождѐнные от механических загрязнений, особенно белковых и жировых.
2.1. Контроль качества проведенной санации помещений
При контроле качества проведенной дезинфекции учитывают три показателя:
1.Качество механической очистки. Для контроля качества проведенной механической очистки ветеринарный врач осматривает чистоту пола, стен и всего оборудования помещений. Критерием служит естественный цвет и фактура материала осматриваемых объектов.
2.Правильность применения дезинфицирующего средства. В этом случае врач определяет целесообразность выбора того или иного дезинфектанта в зависимости от вида возбудителя болезни, против которого проводится обработка, характеристики обрабатываемого объекта (птичник или объект убойноперерабатывающего предприятия), температурного режима при котором будет проводиться дезинфекция и т. д.
Врач также определяют концентрацию рабочего раствора дезинфектанта и соответствие температуры препарата его нормативным требованиям. Тоесть, если дезинфектант должен применяться при температуре рабочего раствора +60˚С, значит температура рабочего раствора должна этому соответствовать.
Еще одной важной составляющей контроля качества проведенной дезинфекции является количество израсходованного рабочего раствора на 1 м2 (при влажной дезинфекции) или на 1м3 (при аэрозольной дезинфекции). Расход рабочего раствора должен соответствовать рекомендациям нормативной документации дезинфектанта с поправкой на реальное качество механической очистки поверхностей.
Если расход рабочего раствора по нормам составляет 0,5 — 1,0 л на 1 м2, то соответственно при хорошем качестве механической очистки (видна структура материала) расход дезинфектанта может быть 0,5л., при удовлетворительном качестве подготовки — 1,0 л/1м2.
3.Бактериологический контроль дезинфекции — это контроль качества проведения дезинфекционных мероприятий путем обнаружения санитарно — показательных микроорганизмов на объектах окружающей среды. Такой контроль проводится бактериологическим методом с отобранных проб дезинфицируемых поверхностей. Методика отбора и методика определения качества дезинфекции приведены в соответствующем разделе книги.
Дезинфекцию, дезинсекцию, дезинвазию и дератизацию объектов птицефабрики ветеринарный врач включает в план противоэпизоотических мероприятий, который составляется на год с разбивкой на кварталы и месяцы.
В плане указывают сроки и методы проведения мероприятий, а также концентрацию и количество препарата, использованного на дезинвазию, дезинсекцию или дератизацию птичников, УПК или других помещений общего назначения, а также спецодежды, обуви, транспорта и прилегающей территории.
Потребность в препаратах для дезинфекции, дезинвазии, дезинсекции и дератизации, моечных машинах, дезинфекционных установках, и человеческих ресурсах главный ветеринарный врач планирует ежегодно и ежеквартально с учетом объема работ, расположения объектов обработки, технологии производства, эпизоотической ситуации и других особенностей хозяйства. Санацию птицеводческих помещений в благополучном по инфекционным заболеваниям хозяйстве проводят в каждом санитарном технологическом перерыве (санразрыв), согласно технологии движения поголовья.
Санитарный технологический перерыв предусматривается в период с момента отправки последней партии птицы из помещения до начала размещения в нем новой партии. Он должен быть достаточным для проведения санитарной обработки объекта в соответствии с ветеринарными требованиями, включающими механическую очистку помещения, дезинсекцию, влажную и аэрозольную дезинфекцию и дератизацию.
В Таблице 2 представлены нормативы по срокам профперерывов Росптицесоюза.
При напольном выращивании птицы санразрыв составляет: для цыплят — бройлеров — не менее 8 дней; для ремонтного молодняка свыше 60 — ти дней — 28 дней; для взрослой птицы — 30 дней.
При клеточном содержании и для бройлеров и для несушки — 28 дней. Сроки проведения санразрывов планируют на год в соответствии с технологической картой движения птицепологовья, которую разрабатывают технологи предприятия.

Непосредственные мероприятия по санации помещений ветеринарная служба планирует и осуществляет либо внутри своего структурного подразделения, если в него входит бригада по подготовке корпусов к посадке птицы, либо с клининговой компанией, которая предоставляет такие услуги для птицефабрик.
2.2. Порядок проведения санации помещений
1.За десять дней до выселения птицы из корпуса мастер производственной бригады составляет дефектовочную ведомость проведения ремонтных работ по корпусу (СМР, электрооборудования, систем поения, кормления, вентиляции, яйцесбора) и передаѐт еѐ мастеру по подготовке корпусов.
2.Мастер по подготовке корпуса перед началом сдачи птицы составляет график подготовки (санации) птицеводческих помещений (на основании дефектовочной ведомости от нач. цеха) с учетом технологического процесса, который согласован с главными специалистами (Приложение 1).
3.При напольном содержании за день до выселения птицы на убой в корпусе проводится демонтаж кормового оборудования и газовых теплогенераторов.
4.Утром в день выселения птицы из корпуса (при напольном содержании птицы) оператор-птицевод поднимает системы поения и кормления (для птиц с напольным содержанием) до необходимого технологического уровня.
5.После освобождения корпуса (птичника) от птицы (это может быть вследствие перевода птицы из ремонтного молодняка в родительское стадо, в цех промышленной несушки, либо на убой) в корпусе всегда остаются трупы птиц, которые после их сбора помещаются в специальные контейнеры с плотно закрывающейся крышкой находящиеся при корпусе. В течение цикла такие контейнеры, а это могут быть металлические или оцинкованные баки, другие емкости которые могут подвергаться дезинфекции, использутся для складирования трупов с момента их сбора в птичнике до отправки на утилизацию. Трупы птиц собираются и утилизируются ежедневно. Такие контейнеры для сбора трупов и биоотходов обеззараживают в обычном порядке каждый раз после вывоза трупов на утилизацию и освобождения контейнеров.
6.Операторы — птицеводы убирают из подсобных помещений посторонние предметы, инвентарь. После сдачи птицы рабочие по подготовке корпуса компрессором обдувают пыль со стен, оборудования. Мастер производственной бригады оформляет акт передачи оборудования бригаде по подготовке корпусов (Приложение 2).
7.Энергетик комплекса (цеха), слесарь по ремонту и обслуживанию газового оборудования сдают звену операторов электро — и газовое оборудование на период санитарного разрыва, оформляя это актом приема — сдачи оборудования (Приложение 3).
8.Дезинфекцию транспорта, используемого для перевозки птицы, проводят на дезинфекционно — моечной площадке после полного освобождения зала от птицы, но не реже одного раза в день в конце смены, т.е. если зал в птичнике за один день по какой-то причине вывезти не удалось, то вечером автотранспорт, который использовался для перевозки птицы подвергается мойке дезинфицирующими растворами после предварительной механической очистки. Особенно это касается времени, когда переводится ремонтный молодняк из своего цеха в цех родительского стада.
9.Запрещается пропускать на территорию стада реммолодняка грязный транспорт.
10.После полного освобождения корпуса ветеринарные санитары проводят дезинсекцию помещений «по-грязному». Это особенно актуально для несушки, т.к. за то время, что несушка находится на промышленном стаде, а это примерно от 265 до 465 дней (в зависимости от кросса, и целей фабрики.
Если кур запускают в принудительную линьку, то птицу содержат до 465 дней). За это время в корпусах, где содержится птица накапливается очень большое количество эктопаразитов.
11.На следующий день начинается механическая очистка корпуса. Механическая очистка — первый этап в санации птицеводческих помещений, при ее проведении осуществляют механическое удаление подстилочного материала, помета, перьев, пуха. Бригада по подготовке птичников проводит тщательную механическую очистку всех внутренних и наружных поверхностей помещения, находящегося в нем оборудования.
12.Для напольников — буртование начинают с «чистой» стороны зала и заканчивают «грязной» с последующей погрузкой и вывозом через пометные ворота на территорию пометохранилища, при этом тележки с пометом должны быть плотно закрыты пологами.
13.Для птиц с клеточным содержанием механическую очистку помещения начинают также с чистой стороны с помощью метел и производственных пылесосов. Затем удаляют помет с лент или пометных каналов. Порядок проведения, требования, контроль качества механической очистки помещений проводят в соответствии с рабочей инструкцией «Инструкция по механической очистке помещений в период санитарного разрыва».
14.Остатки помета после буртовки (для напольников) удаляются метлами.
15.Очистка дезматов и канализационных колодцев от опилок проводит также бригада по подготовке корпусов.
16.Чистка бункеров, разборка кормушек и калориферных установок бригадой эксплуатации и трудоемких процессов.
17.Качество механической очистки визуально оценивает ветеринарный врач комплекса (цеха), при этом должны учитываться остаточные количества загрязнений (подстилочный материал, помет, пух, перья). При неудовлетворительном качестве механической уборки проводят дополнительную очистку помещения. Качество работы отображают в акте приема — сдачи при санобработке зала (Приложение 4).
18.Мойку помещения и оборудования проводят с целью удаления механических остатков и физического удаления патогенной и условно — патогенной микрофлоры. Гидроочистку помещения и оборудования проводят струей воды, получаемой при помощи моечной установки или запениванием, используя аппараты высокого давления. Аппараты высокого давления следует выбирать производительностью не менее 90 л/час.
19.Мойку зала начинают с «чистой» стороны и заканчивают «грязной» в следующей последовательности: система приточной вентиляции, бункера, потолки, стены, клетка, система поения, полы, канализационные каналы, в летнее время — отмостки, наружные стены, задняя и передняя площадки.
20.Параллельно проводят мойку вручную калориферов, кормушек, каплеуловителей. После проведения мойки помещения и оборудования поверхности не должны содержать остатков механических загрязнений. После окончания мойки корпуса санитарным ветврачом совместно с мастером по подготовке оценивается ее качество (Приложение 5). При наличии замечаний проводится повторная мойка.
22.В некоторых случаях (зависит от дезсредства фирмыпроизводителя) после мойки и просушки клеток и помещения проводится дополнительная пенная дезинфекция, но как правило пенная дезинфекци проводится после механической очистки с последующей гидроочисткой.
23.Бункера — накопители кормопродуктов, которые находятся непосредственно у производственных помещений (птичников) механически очищают сразу после освобождения корпуса от птицы и ветеринарные санитары проводят фумигацию (газацию) аппаратным, с привлечением специального оборудования или безаппаратным способом (возгонкой). В теплое время года фумигацию проводят после гидроочистки бункеров-накопителей.
24.После мойки и сушки помещения слесари — ремонтных бригад проводят ремонт и регулировку технологического оборудования. При необходимости ремонт стен и полов.
25.С целью проведения дезинвазии при напольном содер-жании птицы оператор компрессорных установок проводит обжиг, полов, стен на высоту 0,5 м., перегородок, гнезд (кроме деревянных и пластиковых конструкций), при клеточном содержании проводится обжиг металлических клеток. Обжиг (или фламбирование) проводят до полного удаления остатков пера, пуха, ооцист кокцидий, яиц гельминтов. Порядок проведения обжига, требования, контроль описаны в рабочей инструкции по обжигу помещений в период санитарного разрыва.
26.Дезинсекцию «по-чистому» ветеринарные санитары осуществляют перед влажной дезинфекцией. Затем ветеринарные санитары проводят влажную дезинфекцию помещений и оборудования.
27.Дезинфекцию системы поения проводят ветеринарные санитары под контролем ветеринарного врача. Вода в системе поения при посадке птицы не должна содержать механических примесей, органических включений, патогенной и условно-патогенной микрофлоры, грибов. Для этого до проведения влажной дезинфекции корпуса закачивается в систему поения один из дезрастворов: 0,5% р-р Виркон С (экспозиция 50 минут), 3%-ный раствор молочной кислоты; 3% р-р формалина;
10% раствором однохлористого йода; 3% уксусной кислоты; 2% р-р «Сал — Карб» — экспозиция 6 — 12 часов с последующим промыванием проточной водой в течение 30 минут. Порядок проведения работ по дезинфекции и контролю качества подготовки системы поения к приему птицы проводят в соответствии инструкцией по дезинфекции системы поения в период санитарного разрыва.
28.Влажную дезинфекцию помещения проводят с целью обеззараживания поверхностей и оборудования от патогенной и условно — патогенной микрофлоры. Для влажной дезинфекции используют растворы химических веществ: 3%-ный раствор каустической соды; 1%-ный раствор бромосепта из расчета 1 л/м2, начиная с «чистой» стороны зала, заканчивая «грязной» В летнее время проводится дополнительная дезинфекция отмостков и площадок.
29.После 3-6-12 часовой экспозиции, в зависимости от используемого дезинфектанта, лаборант в присутствии ветврача осуществляет отбор смывов на качество дезинфекции.
30.Ветврач заполняет акт в 3 — х экземплярах и передает лаборанту, проводившему отбор проб, для внесения данных в акт (Приложение 8). Порядок проведения и контроль качества влажной дезинфекции установлен в инструкции по влажной дезинфекции помещений в период санитарного разрыва.
31.Ветврач цеха, дезинфектор составляют акт проведения контроля качества дезинфекции (Приложение 8).
32.Врач бактериолог проводит исследование и вносит результаты в акт по проведению влажной дезинфекции. Акт выдается ветврачу комплекса под подпись. Дезинфекция считается удовлетворительной, если нет роста тест — микробов в 80% проб.
Побелка. Перед побелкой корпуса проводится укрытие электрического оборудования пленкой. Бригада по подготовке корпусов проводит побелку пола, потолка, стен, подсобных помещений 10% взвесью свежегашеной извести (с добавлением медного купороса). В летнее время проводится побелка наружных стен корпуса.
Сразу после проведения влажной дезинфекции и побелки слесарь — оператор и оператор по выращиванию птицы заполняют дезматы, пропитывая их 3% раствором едкого натра, 1% раствором Виркона, 0,25-0,5% р — ром Делеголь Pro и др. до полного увлажнения 1 раз в 4 дня или по мере загрязнения.
Дезматы и дезковрики должны быть оборудованы внутри здания у входа из специально подобранного пористого эластичного материала, обильно смоченным дезраствором.
Дератизационные мероприятия осуществляют перед аэрозольной дезинфекцией, сразу после загрузки кормовых бункеров.
Бригада слесарей механической службы проводит ТО и ППР технологического оборудования (систем поения, кормления, вентиляции), работники энергослужбы проводят ТО и ППР электрооборудования, сантехоборудования, газового и теплотехнического оборудования.
Устанавливаются газовые генераторы и вытяжные вентиляторы.
Проходит просушка корпуса при t = + 370С.
На следующий день при отрицательных результатах лабораторных исследований (Приложение 10) завозят опилки или другой подстилочный материал (при напольном содержании). На сухой пол птичника засыпают подстилочный материал (опилки) и равномерно распределяеют по залу. Глубина подстилки для бройлеров в летний период должна составлять
5 см, в зимний — 6 см; для ремонтного молодняка — 10 см, для взрослой птицы — 15 см. Влажность подстилочного материала должна быть не более 40%.
Качество опилочного материала должно быть подтвер-ждено заключением лаборатории о безопасности в микробиологическом и микологическом отношении в соответствии с инструкцией по входному контролю подстилочного материала (Приложение 6).
Не допускается наличие условнопатогенной, патоген-ной микрофлоры, а также спор грибов рода Aspergillus.
Бригадой слесарей проводится монтаж оборудования (подлетной части гнезд).
Операторы — птицеводы проводят заключительные ра-боты. Обтирают оборудование.
Бригада трудоемких процессов и слесарь — оператор по выращиванию птицы регулируют систему поения и кормления, проверяя их работоспособность и целостность. Проводят сборку системы вентиляции. При необходимости проводят ремонт.
Аэрозольная дезинфекция является заключительным этапом в санации птицеводческих помещений и проводится только после приемки корпуса под посадку: суточного молодняка за 3 — 7 дней до посадки, молодки за 4 — 5 дней. В комиссии по приемке корпуса принимают участие все главные специалисты хозяйства (главный ветеринарный врач, главный зоотехник (или главный технолог или начальник по производству), главный инженер, главный энергетик, мастер цеха или начальник цеха, работники корпуса (птичница и слесарь)). Аэрозольную дезинфекцию проводят 38 — 40% — ным раствором формальдегида, при расходе 20 мл/м3. Температура в зале должна быть не ниже 20°С. При недостаточной температуре в помещении проводят подогрев воздуха при помощи калориферных установок, газогенераторов и газодинамической установки. Обработанное помещение выдерживают в течение 12 (если контроль качества дезинфекции проводят только по E.coli) и 24 часов (если контроль качества дезинфекции проводят по Staphylococcus). Затем помещение проветривают в течение 12 часов при включенной вытяжной вентиляции.
В летнее время открывают приточные шахты. Порядок проведения, требования, контроль качества выполненных работ проводится в соответствии с «Инструкцией по аэрозольной дезинфекции в период санитарного разрыва». Ветеринарный врач, дезинфектор оформляют акт контроля качества проведенной аэрозольной дезинфекции (Приложение 
На следующий день (по окончанию экспозиции) лабо-рант ветеринарной лаборатории проводит отбор проб для определения качества дезинфекции поверхностей по залам на ОМЧ, БГКП и стафилококк (Приложение 8).
Сразу после проведения аэрозольной дезинфекции в корпусе вводится санитарно — пропускной режим. Все входящие должны переодеваться в санитарную одежду и обувь. Для этого шкафчики для персонала заполняют санитарной одеждой и обувью (халаты, шапочки, медицинские повязки, бахилы или маркированные резиновые калоши).
Размещение санитарных шкафчиков, укомплектованных санитарными халатами, шапочками, медицинскими масками на резинке и бахилами или сменной обувью (резиновыми калошами) для персонала и посетителей проводится работниками цеха под контролем ветеринарного врача перед аэрозольной дезинфекцией птичника.
Бригада трудоемких процессов проводит подготовку к заселению птицы: раздает корма, устанавливает перегородки и другое технологическое оборудование. Заполняет системы поения полным объемом воды для проверки целостности системы на всем ее протяжении.
За день до посадки птицы ветеринарный лаборант в корпусе проводит отбор проб воды из системы поения для бактериологического исследования. Результаты исследования проб воды из системы поения оформляются врачом бактериологом в виде протокола и выдаются врачу цеха под подпись.
После получения удовлетворительного результата аэро-зольной дезинфекции птичник опечатывают на период не менее 3 дней для бройлеров и несушки и на период не менее 7 дней — при содержании ремонтного молодняка и родительского стада.
Посадка птицы в помещение разрешают только при проведении всего комплекса дезинфекционных мероприятий, качество проведения которых фиксируют в акте приема корпуса для посадки птицы и акте приема — сдачи помещения (Приложение 9, 10).
При выполнении работ по санации птицеводческих помещений необходимо строго соблюдать меры по охране труда и технике безопасности. К работам по санации помещений могут допускаться лица, достигшие 18 лет, прошедшие инструктаж по охране труда и противопожарной безопасности.
О проведенной работе по дезинфекции, дезинсекции, дезинвазии и дератизации составляют акт по единому образцу (Приложение 7 А).
Для дезинфекции, дезинсекции и дератизации должны использоваться средства, зарегистрированные Департаментом ветеринарии Российской Федерации и имеющие сертификаты качества завода-изготовителя, удостоверяющие их соответствие требованиям государственных (отраслевых) стандартов или технических условий и разрешенные к применению Департаментом ветеринарии Министерства сельского хозяйства Российской Федерации.
Опыт работы с птицеводческими предприятиями свидетельствует о том, что показатели сохранности, и продуктивности птицы очень высокие только в первые годы эксплуатации помещений. Наблюдая такой эффект руководители предприятий начинают увеличивать плотность посадки птицы, сокращать санитарные разрывы, увеличивать количество производственных циклов в год, пренебрегать необходимыми мероприятиями для выполнения санации помещений (например, проведение некачественной механической очистки помещений и оборудования, снижать дозы дезинфектантов, сокращать время экспозиции, отменять принцип «все пусто — все занято» и т. д.). Это особенно характерно для крупных агропромышленных холдингов, т.к. в условиях рынка идет постоянный поиск новых способов уменьшения затрат и повышению производства мяса и яйца, но на вновь введенных в эксплуатацию корпусах только в первые годы выращивания птицы наблюдаются высокие показатели по сохранности, привесам и яичной продуктивности, а поскольку птицеводство самая интенсивная подотрасль сельского хозяйства, то пренебрежение к основным ветеринарно — санитарным нормам и правилам приводит к результатам обратным желаемым.
В этом случае происходит более интенсивное накопление инфекционного начала, чем обычно. А при сокращении профилактических санитарных разрывов даже массированные вливания антибиотиков, вакцин и дезинфектантов не приводят и не приведут к сколько — нибудь значимому эффекту.
Напротив, происходит усиление резистентности микроорганизмов к антибиотикам и дезинфектантам (Бирман Б.Я., 2008 г). Это связано с тем, что обилие ферментов и способов адаптации у бактерий, в том числе к нехватке легкоусваиваемого углерода колоссально и наряду с усилением невосприимчивости к химическому воздействию различных групп препаратов может иметь совершенно неожиданный исход, в том числе и для человека.
Так Джордж Черч и его сотрудники из Гарвардского университета (США) выяснили, что среди почвенных бактерий можно найти много видов, родственников возбудителей инфекционных болезней человека и животных, способных использовать антибиотики в качестве единственного источника углерода, хотя наиболее доступными источниками углерода для бактерий являются углеводы и аминокислоты. Ученые проверили 18 тысяч различных соединений, представляющих все восемь классов известных антибиотиков.
Они выяснили, что исследуемые бактерии не просто усваивают антибиотики, а могут использовать их как единственный источник углерода в среде. Это может привести к тому, что эти бактерии путем горизонтального переноса генов разделят устойчивость со своими патогенными родственниками. Тем самым, эта работа еще раз показывает, что нет оснований надеяться на магические антибиотики широкого спектра действия и дезинфектанты «последнего поколения», к которым не возникнет устойчивости микроорганизмов. При сокращении сроков профразрывов происходит такая же адаптация микроорганизмов к дезсредствам. Возникает и так называемая «усталость помещений». В этих условиях в самые первые часы после посадки на суточных цыплят в буквальном смысле обрушивается ассоциированная инфекция из эктопаразитов, микроорганизмов и вирусов.
Такая массированная атака приводит к иммуносупресии у цыплят, начиная с первых дней жизни, а по продолжению и к недостаточной выработке антител на введение вакцин и как следствие снижение всех производственных показателей.
Справедливости ради надо также сказать, что на некоторых птицефабриках сокращение профилактических санитарных разрывов происходит незапланировано, в авральном режиме. Так, например, на одной из птицефабрик профилактические разрывы на бройлерной площадке в разное время сокращались до 3-4-х дней только из-за того, что служба реализации птицефабрики не смогла вовремя реализовать продукцию и холодильные камеры были переполнены.
В этих условиях убойный цех не работал из-за невозможности складировать продукцию, в результате передерживалась птица в корпусах на 3 — 6 дней, соответственно санразрыв также сокращался на такое же количество дней.
Далее как замкнутый кгруг: бригада по подготовке корпусов не успевала провести работы по санации птичников в срок и три партии суточных цыплят сажались в один корпус.
По мере подготовки птичников, цыплята в разном возрасте перевозилась на подготовленные корпуса. Сами понимаете, поддерживать спокойную эпизоотическую обстановку в таких условиях главному ветеринарному врачу очень не просто, большое значение здесь играет также взаимодействие главных специалистов всех структурных подразделений хозяйства.
В этом случае результат такой же как и при запланированном снижении количества дней санитарного разрыва, снижение производственных показателей.
По поводу сроков санитарных разрывов среди руководителей и специалистов птицефабрик очень часто ведутся жаркие споры. Практика показала, что оптимальным сроком санитарного разрыва для бройлеров является не менее 16 дней, для рем.молодняка, родительского стада и несушки не менее 28 дней.
При соблюдении таких нормативов достигается снижение затрат на вакцины и медикаменты, дополнительные затраты на оплату труда санитарам, разнорабочим и т.д. которые привлекаются для ветеринарно — санитарных обработок, аэрозольной дезинфекции воздуха в присутствии птицы, дополнительного сбора санбрака и т.д.
В конечном итоге достигается снижение конверсии корма, увеличение среднесуточного привеса или яичной продуктивности.
2.2.1. Дезинсекция
Дезинсекция в птицеводстве это комплекс организационных, санитарно — технических, санитарно — гигиенических и истребительных мероприятий, направленных на уничтожение не только насекомых, но и членистоногих, которые являются переносчиками инфекционных заболеваний человека и животных, вызывают аллергии, кожные заболевания, наносят экономический ущерб, вызывают дискомфорт, создают неблагоприятные условия для жизни животных, с целью обеспечения санитарно-эпизоотологического благополучия хозяйства.
Далее в тексте под термином «Дезинсекция» подразумевается мероприятия против клещей и насекомых, если это не указывается особо.
Термин «дезинсекция» был впервые введѐн Н.Ф. Гамалея в 1910 году и означает от франц. des — приставка, что толкуется как уничтожение, и лат. insectum — насекомое), уничтожение вредоносных членистоногих (насекомых, клещей и др.) во внешней среде. Возможно, такое определение было связано с принятой в то время классификацией. И хотя в настоящее время насекомые и клещи относятся к разным классам, но все таки эти оба класса входят в тип Членистоногие.
В ветеринарии термин «дезинсекция» является до сих пор общеупотребительным и по-прежнему означает уничтожение и насекомых, и клещей, хотя все чаще встречаются такие узкоспецифичные определения как «дезакаризация».
Вредоносное воздействие зоотропных членистоногих, нападающих на сельскохозяйственных животных состоит из: механического воздействия; гематофагии (кровососания); токсического воздействия; переноса возбудителей трансмиссивных болезней, и, кроме того, около 200 видов насекомых являются промежуточными хозяевами гельминтов.
Дезинсекция и дезакаризация проводится на всех птицеводческих предприятиях. Технология санации помещений, в которых содержалась птица, начинается с дезинсекции «погрязному».
Понятие «Дезинсекция» включает в себя не только обработку помещения птичника изнутри. Это целый комплекс мероприятий направленных на уничтожение клещей и мух на всех стадиях их развития. После высадки птицы проводится дезинсекция и дезакаризация «по — грязному» в корпусе, скашивание травы вокруг корпуса, обработка почвы средствами против мух и клещей по периметру птичника на расстояние 1,5 — 2 м., а также обработка пометной ямы и мест постоянного обитания и выплода мух.
Это касается не только корпусов, где выращивался ремонтный молодняк, родительское стадо и помещений, где содержалась несушка. Есть фабрики, где в корпусах нет куриных клещей, но огромное количество мух буквально преследует персонал по территории всей фабрики, — от въезда на территорию до выезда с нее.
Это связано в первую очередь с нарушениями правил вывоза и обеззараживания помета. Помет на таких фабриках, как правило, вывозится нерегулярно, пометные ямы до конца не вычищаются, а помет складируетют на расстоянии не более 100 метров от фабрики. Нарушаются также правила проведения дезинсекции в период санитарного разрыва. Так при подготовке птичников к посадке новой партии в таких хозяйствах, как правило, проводится только дезинсекция «по — чистому», т.е. после механической очистки, и как правило только аэрозольным методом внутри помещения, без влажной дезинсекции пометных ям и почвы по периметру корпуса снаружи.
Дезинсекцию и дезакаризацию внутри корпуса можно проводить аэрозольно и методом увлажнения. Аэрозольную дезинсекцию проводят аппаратным и безаппаратным методом. Для проведения аппаратной дезинсекции используют генераторы горячего и холодного тумана. Для безаппаратной обработки применяют шашки с инсектицидами. Дезинсекция методом увлажнения проводится с помощью дезинфекционной установки Комарова (ДУК). Дезинсекция, как и все остальные мероприятия по санации планируются заранее ветеринарным врачом в соответствии с технологической картой движения поголовья.
Дезакаризация, как один из элементов дезинсекции, является обязательной составной частью ветеринарно — санитарных мероприятий, проводимых на птицефабриках, для профилактики инфекционных и инвазионных болезней и предупреждения снижения продуктивности птицы.
Различают механические, физические, химические, биологические и смешанные методы дезакаризации (дезинсекции).
Механические методы включают очистку территории и помещений от субстратов, являющихся местами обитания и размножения членистоногих, применение защитных сеток, различных ограждений, липких лент и ловушек для отлова насекомых. Сюда нужно отнести контроль за уборкой помета из птичников, чтобы во-первых он убирался ежедневно; во — вторых: не разливался по отмосткам и земле; в третьих: если помет разлили или рассыпали по территории, то его необходимо сразу убрать.
На одной из фабрик при уборке помета с торцевого пометного транспортера (снаружи корпуса), его постоянно разливали по земле вокруг пометной ленты. Мух было видимо — невидимо! Как-то однажды приехал главный ветеринарный врач из головного офиса и приказал все убрать. Сказано — сделано. Приезжает снова главный врач холдинга, смотрит, — и все чисто у пометного транспортера снаружи корпуса, а мухи все-равно летают! Дотошный попался врач. Обошел все вокруг и видит: помет-то смыли водой из шлангов, да недалеко, в соседние сточные канавы! Так что уборку помета с земли проводите механически, без применения воды, при необходимости пользуйтесь дезинфектантами.
К физическим методам относятся низкие и высокие температуры, электричество, гамма — лучи. Паром и горячей водой обрабатывают различные субстраты, тару, места обитания личинок мух и клещей. Специальные устройства, к которым подключѐн ток высокого напряжения, используются в помещениях против имаго мух. Гамма — лучи в птицеводстве не применяются. Физические методы борьбы с клещами в птичниках проводят еженедельно в санитарные дни, когда проводят очистку пола и стен помещения от пыли, пера, пуха, белковых и жировых загрязнений. Это относится конечно в основном к птицефабрикам яичного направления.
Химические методы предусматривают применение инсектицидов против насекомых (против клещей акарицидов). Они могут быть растительного происхождения перитрины, алкалоиды (никотин и анабазин), неорганического (мышьяк, медь, фтор), хлорорганического (ГХЦГ и др.), фосфорорганического (БайМайт, винилфосфат, хлорофос, ДДВФ, карбофос, циодрин и др.), карбаматные (Флай Байт, севин, дикрезил, пропоксур, байгон, мекарбенил), микробного происхождения — авермектин и ивермектин и др. Естественные и синтетические перитрины (неопинамин, сумитрин и др.) применяют против различных членистоногих (мух, клещей и др.). Неорганические и многие хлорорганические соединения используются ограниченно из-за их высокой токсичности.
Фосфорорганические инсектициды эффективны для борьбы с членистоногими в биотопах и животноводческих помещениях. Например, против преимагинальных фаз мух высокоэффективна 0,1% — ная водная эмульсия трихлорметафоса — 3, против имагинальной стадии мух с успехом применяют препарат Флай Байт. Для уничтожения куриных клещей и клопов в птичниках в присутствии птицы применяют 0,4% водную эмульсию БайМайт (Байер), 0,5 — 1% — ные эмульсии карбофоса, 1% — ный хлорофос. Карбаматы: севин 0,75% — ный, дикрезил 1% — ный, пропоксур 0,1 — 0,2% — ный эффективны также эктопаразитов птиц. Химическую дезакаризацию проводят с помощью специальных ветеринарно — санитарных технических средств, например ДУК.
Биологические методы основаны на использовании естественных врагов членистоногих — птиц, рыб, микроорганизмов, грибов, хищных насекомых. Чаще применяют естественных врагов личинок комаров (рыбы гамбузии) в водоѐмах. Естественными враги эктопаразитов кур некоторые виды грибков, в промышленном птицеводстве не применяются.
Из почвенного гриба — актиномицета Streptomyces avermitilis выделены продукты его деятельности — авермектины, которые представляют собой макроциклические лактоны, обладающие энтомопатогенным свойством. Авермектины блокируют передачу нервных сигналов в синапсах, осуществляемую гамма-аминомасляной кислотой, что приводит к параличу и смерти насекомых.
Несмотря на такое многообразие методов борьбы с вредными насекомыми химический метод до сих пор применяется наиболее широко. В основу этого метода положено применение ядохимикатов, которые называются инсектицидами (от латинских слов insectos — насекомое и caedo — убиваю) и акарицидами (acaris — клещ) в настоящее время акарициды часто называют инсектоакарицидами, которые входят в большую группу пестицидов (от латинских слов pestis — зараза и caedo — убиваю).
Пестициды это химические вещества, предназначенные для уничтожения любых вредителей, включая переносчиков болезней человека и животных, нежелательных видов растений или животных, причиняющих вред в процессе производства, обработки, хранения, транспортировки или продажи пищевых продуктов, сельскохозяйственных продуктов, древесины, кормов для животных и т.д.
По отношению к объектам применения пестициды подразделяются на инсектициды (для уничтожения членистоногих), гербициды и арбоциды (для уничтожения сорной растительности), фунгициды (для уничтожения грибов), бактерициды (для уничтожения бактерий, возбудителей болезней человека, животных и растений) и т.д.
Использование химических средств известно давно. Например, Гомер упоминал об отравляющем действии на насекомых горящей серы, а Аристотель рекомендовал применение серы для уничтожения вшей человека.
В 1874 году в Германии был синтезирован дихлордифенилтрихлорэтан (ДДТ), но о его инсектицидных свойствах стало известно только в 1939 году, а в 1942 году Мюллер, Мартин и Лаугер предложили его в качестве инсектицида и запатентовали от имени фирмы Гейги (Швейцария) которая стала, затем называться Сиба-Гейги, а сейчас Новартис. Впоследствии Мюллер получил за создание этого инсектицида Нобелевскую премию. В России препараты на основе ДДТ запрещены. Во время второй мировой войны в Германии впервые были разработаны фосфорорганические соединения, обладающие инсектицидной активностью, а в 1949г. Шехтером, Грином и Ла Форжем был осуществлен синтез первого пиретроида, который получил название аллетрин.
Классификация инсектицидов
В зависимости от фазы развития членистоногих, против которых применяются инсектициды, последние подразделяются на овоциды (эффективно убивающие яйца насекомых), ларвициды (препаративные формы, эффективно уничтожающие личинок членистоногих) и имагоциды (инсектициды против взрослых членистоногих). Многие инсектициды действуют на все фазы развития членистоногих.
В зависимости от пути проникновения в организм членистоногих инсектициды делятся на контактные, кишечные, фумигантные и системные.
Контактные инсектициды наносятся на различные поверхности и проявляют свою токсичность при попадании на покровы тела членистоногого, проникая в его организм через кожные покровы (кутикулу). К таким препаратам относится Бай Майт (Байер), хлорофос, Вуран, Флай Байт (метомил, входящий в состав Флай Байта в качестве действующего вещества обладает иконтактным и кишечным действием). Большинство из них обладает длительным остаточным действием. Действие кишечных ядов проявляется при попадании в органы пищеварения, т.е. членистоногое должно его съесть. К ним относят Флай Байт, хлорофос, Москина.
Фумиганты проникают в организм членистоногих через органы дыхания насекомых, т.е. через их трахейную систему.
В промышленном птицеводстве не применяются.
Системные яды попадают в организм вредителей при питании кровью животного или человека, которому предварительно было введено данное вещество. К ним относят Имидаклоприд и Севин (токсичность: ЛД50 310 — 350 мг/кг) в настоящее время Севин не применяется из-за того, что обладает цитогенетической активностью, гонадотоксическими свойствами и выраженным кумулятивным действием.
В основу санитарно — гигиенической классификация пестицидов положены три характеристики: степень их токсичности для биологических объектов, кумулятивные свойства и стойкость во внешней среде.
Обязательным требованием к пестицидам является их низкая токсичность для теплокровных: человека и животных.
За единицу токсичности принята ЛД50 (мг/кг), т.е. доза, вызывающая 50% смертность подопытных организмов. Эта доза выражается в миллиграммах токсичного вещества на 1 кг живого веса организма при однократном введении тем или иным методом (орально, накожно или ингаляционно).
Гигиеническая классификация пестицидов действующая на 2011г
(согласно ГОСТ 12.1.007-76)
I. По токсичности при введении в желудок:В зависимости от токсичности при введении в желудок для теплокровных животных и человека все вещества делятся на 4 группы
1 группа: чрезвычайно опасные (особо токсичные)
— ЛД50 ˂ 50 мг/кг;
2 группа: высоко опасные (высоко токсичные)
— ЛД50 = 50 — 200 мг/кг;
3 группа: умеренно опасные (средне токсичные)
— ЛД50 = 200 — 1000 мг/кг;
4 группа: мало опасные (мало токсичные)
— ЛД50 ˃ 1000 мг/кг
К группе чрезвычайно опасных (особо токсичных) веществ относятся наиболее сильнодействующие токсичные соединения, у которых ЛД50 составляет менее 50 мг/кг. Запрещены для применения в чистом виде в медицинской дезинсекции (возможно использование в тех препаративных формах, токсичность которых снижена до умеренно опасных).
Группа высоко опасных (высокотоксичных) веществ, их ЛД50 лежит в интервале от 50 до 200 мг/кг. Запрещается использовать в детских, лечебных учреждениях, на предприятиях общественного питания и в быту. На других объектах допускается их применение только обученным персоналом в отсутствии людей, с последующим обязательным проветриванием и уборкой.
Умеренно опасные (среднетоксичные) вещества, составляющие третью группу, имеют ЛД50 в диапазоне от 200 до 1000 мг/кг. Допускаются для использования как обученным персоналом в помещениях любого типа, так и населением в быту.
Малоопасные (малотоксичных) веществ ЛД50 превышает 1000 мг/кг. Разрешаются для использования без ограничения сфер применения.
II. По кожно-резорбтивной токсичности:
1.Резко выраженная — ЛД50 — меньше 300 мг/кг,
Кожно — оральный коэффициент — меньше 1
2.Выраженная — ЛД50 — 300 — 1000 мг/кг, Кожно — оральный коэффициент — 1 — 3
3.Слабо выраженная — ЛД50 — более 1000 мг/кг, Кожно — оральный коэффициент — больше 3.
III. По степени летучести:
1.Очень опасное вещество — насыщающая концентрация больше или равна токсической
2.Опасное — насыщающая концентрация больше пороговой
3.Малоопасное — насыщающая концентрация не оказывает порогового действия.
Токсичность инсектицида и препарата на его основе может различаться, иногда очень существенно. Некоторые препараты из-за вводимых в них добавок значительно более токсичны, чем лежащие в их основе чистые инсектицидные вещества.
Кумулятивные свойства пестицидов. Для токсикологической характеристики изучаемого вещества очень важным является выяснение вопроса — обладает ли данное соединение кумулятивным свойством.
При многократном поступлении через малые интервалы времени вещество может либо само накапливаться в организме (материальная кумуляция, кумуляция вещества), либо вызывать суммирование эффекта, т.е. суммирование изменений, связанных с длительным действием яда (функциональная кумуляция). Выяснение степени кумулятивного действия вещества позволяет с большой вероятностью предсказать возможность развития хронического отравления.
Кумуляция пестицидов определяется по коэффициенту кумуляции Ккум (отношение суммарной дозы препарата, вызывающей гибель 50% подопытных животных при многократном введении, к дозе, вызывающей гибель 50% животных при однократном введении).
По степени кумуляции пестициды делят на 4 группы:
1.группа: сверхкумуляция — Ккум ˂ 1;
2.группа: выраженная кумуляция — Ккум = 1 — 3; 3. группа: умеренная кумуляция — Ккум = 3 — 5;
4. группа: слабо выраженная кумуляция — Ккум ˃ 5
По стойкости (период распада пестицида на нетоксичные компоненты) пестициды делят на 4 группы:
1 группа: очень стойкие — время разложения более 2 лет; 2 группа — стойкие — от 6 мес. до 2 лет.
3
группа — умеренно стойкие
— до 6 мес.
4
группа — малостойкие
— в течение 1 мес.
Препаративные формы инсектицидов
В последние годы ведутся активные разработки и внедрение сложных композиционных средств, содержащих в своем составе несколько действующих веществ (ДВ). В этих препаратах эффективность достигается синергизмом действия ДВ, а не их суммой. Инсектициды редко применяются в чистом виде, обычно они бывают в виде различных препаративных форм.
Для успешного применения той или иной препаративной формы необходимо хорошо знать еѐ свойства, а также биологические особенности членистоногого, которые необходимо учитывать при выборе инсектицида.
Дусты. Дусты (от английского слова dust — пыль) представляют собой смесь чистого или технического инсектицида с инертным наполнителем. Содержание действующего вещества в дусте обычно не превышает 10%.
Дусты готовятся путем совместного размола токсиканта и наполнителя. В процессе размола происходит равномерное перемешивание активных и нейтральных частиц. Размер частиц дустов обычно не превышает 90 микрон. В качестве наполнителя используют различные минеральные вещества (тальк, силикагель, каолин, аэросил, пирофиллит, трепел) и их смеси, а также различные глины.
Инсектициды в виде дустов эффективно действуют на насекомых в связи с тем, что частицы дуста из-за малой величины активно притягиваются и прилипают к телу насекомого во время ползания по обработанной поверхности, чем создается постоянный и продолжительный контакт с токсикантом, приводящий к быстрой гибели членистоногого. Примером является дуст Вуран.
Положительные свойства: высокая эффективность, большой срок хранения (до 5 лет), способность выдерживать низкие и высокие температуры воздуха при хранении, сравнительно небольшой вес (по сравнению с жидкими формами инсектицидов), пожаронеопасны.
Отрицательные свойства: плохая удерживаемость на вертикальных поверхностях, возможность комкования при хранении в помещении с повышенной влажностью воздуха, маркость, наличие у некоторых дустов стойкого неприятного запаха, невозможность работать в открытой природе даже при слабом ветре, невозможность применения на некоторых категориях объектов.
Из-за того, что тальк имеет pH ~8.5, т.е. является слабощелочным наполнителем, многие дусты на тальке быстро теряют активность из-за гидролитического разложения действующих веществ, т.к. большинство инсектицидов имеют слабокислый показатель рН.
Пиретроиды гидролитически более стабильны, но и они через 3 — 6 месяцев претерпевают определѐнное разложение.
Поэтому дусты на тальке нельзя долго хранить, их желательно использовать в течение 1 — 2 недель. Более стойки дусты на белой саже, каолине и других кислых наполнителях.
Смачивающиеся порошки. К ним относятся порошковидные препараты, образующие при смешивании с водой стойкую суспензию, т.е. смесь жидкости и мелких частиц инсектицида (5-20 микрон), находящихся во взвешенном состоянии благодаря добавленным детергентам и другим специальным добавкам, обеспечивающим хорошую суспензируемость и предохраняющую частицы от слипания.
Положительные свойства: большой срок хранения
(обычно 2 — 3 года), стойкость к высоким и низким температурам воздуха при хранении, высокая эффективность на обработанных поверхностях. Твѐрдые частицы не проникают в глубину обработанной поверхности (не впитываются как эмульсии) и не проникают через кожу человека (более безопасны для дезинфекторов), имеют сравнительно небольшой вес, после просыхания суспензии на поверхностях запах не сохраняется, почти не оставляют следов из-за малых размеров твѐрдых частиц, пожаронеопасны.
Отрицательные свойства: возможность комкования при хранении в помещении с повышенной влажностью воздуха, незначительная маркость, более высокая цена (по сравнению с эмульсиями).
У некоторых ранее выпущенных смачивающихся порошков отмечалась слабая прилипаемость к поверхностям (частичное осыпание после высыхания жидкости). В современных смачивающихся порошках свойство прилипания усилено созданием так называемых текучих смачивающихся порошков (флоу), в состав которых добавлено небольшое количество растворителя, позволяющее твѐрдым частицам инсектицида крепче прилипать к обработанным поверхностям.
Это наиболее перспективная препаративная форма, применяемая в жидком виде.
Микрокапсулированные препараты (суспензии и эмульсии). Это суспензии или эмульсии, в которых инсектицид заключѐн в микрокапсулы, величиной от 10 до 50 микрометров. Основой для оболочки микрокапсул служат желатин, лигнин, крахмал, декстрин, некоторые липиды, полисахариды, а также синтетические полимеры (полиакриламид, поливиниловый спирт, поливинилацетат, полимочевина). Действующее вещество в таких эмульсиях медленно диффундирует через оболочки микрокапсул на их внешнюю поверхность. Микрокапсулы могут также раздавливаться лапками насекомых. Прилипшие к лапкам и усикам микрокапсулы съедаются насекомыми, действующее вещество проникает в внутрь макроорганизма и начинает проявлять свое действие.
Положительные свойства: более долгий срок действия, более безопасны для человека и домашних животных, остаются на поверхности впитывающих материалов, почти не отпугивают насекомых.
Отрицательные свойства: микрокапсулы быстро оседают в суспензиях (при работе необходимо часто встряхивать распыливающее устройство), небольшой срок хранения, оставляют слабо видимые следы, не выдерживают замораживания и высоких температур.
Гранулированные инсектициды. Гранулированные инсектициды получают путем пропитки жидкими инсектицидами гранул бентонита, каолина, перлита и других наполнителей. Величина гранул может колебаться от 0,2 до 1мм. Они могут содержать до 20 — 50% инсектицида. Преимуществом гранул является их хорошая оседаемость на поверхности земли при распылении. Удобны при обработках водоемов и в виде приманки для мух.
Эмульсии. Представляют собой системы из двух несмешивающихся жидкостей, стабилизированных прибавлением эмульгаторов и других вспомогательных веществ таким образом, что одна жидкость в виде мелких капель равномерно распределяется в другой. Выпускаются они в виде концентратов эмульсий, которые представляют собой коллоидные растворы действующих веществ в органических растворителях и содержат эмульгаторы.
Положительные свойства: высокий острый эффект, отсутствие маркости.
Отрицательные свойства: сравнительно сильный запах, впитываемость в некоторые обрабатываемые поверхности (штукатурка, глина, фанера и т.д.), возможная реакция с масляными и эмульсионными красками на обрабатываемых поверхностях (растворитель и эмульгатор), легкое проникновение через кожу дезинфектора (высокая токсичность для операторов), небольшой срок хранения, отсутствие морозостойкости и стойкости к высоким температурам, недостаточная продолжительность остаточного действия.
При смешивании эмульсий с водой образуется смесь белого или кремового цвета.
Аэрозоли. Представляют собой твѐрдые или жидкие частицы инсектицидов, находящиеся в воздухе во взвешенном состоянии. Аэрозоль, состоящий из капель жидкости, называется туманом, из твѐрдых частиц — дымом. Аэрозоли создаются с помощью дымовых шашек и аэрозольных генераторов.
Положительные свойства: быстрое и эффективное действие, лѐгкость применения.
Отрицательные свойства: отсутствие остаточного действия.
Классы (группы) инсектицидов по химическому составу
По своей химической структуре инсектициды относятся к различным классам соединений: хлорорганическим, фосфорорганическим, карбаматам, пиретроидам, фенилпиразолам, неоникотиноидам, пирролам и другим.
1.Хлорорганические соединения (ХОС).
Инсектициды класса хлорорганических соединений в настоящее время в России не применяются. Ранее широко использовались такие известные инсектициды, как ДДТ (дихлордифенилтрихлорэтан), Гексахлоран (гексахлорциклогексан, ГХЦГ), Диелдрин, Дилор и другие. Эти инсектициды обладают длительным остаточным действием (более 6 месяцев) и стойкостью к воздействию внешней среды. Имеют ярко выраженную способность накапливаться в тканях растений, животных и человека (кумулирующее действие). Инсектицид ДДТ является высоко токсичным для человека и животных.
Механизм действия инсектицидов этого класса заключается в подавлении активности ферментов оксидаз, подавлении активности гамма-аминомасляной кислоты, как медиатора нервных сигналов в синапсах, а также в нарушении работы так называемого «содового канала» передачи нервных импульсов в синапсах (через ионы К+ и Na+).
По причине длительного остаточного и высоко эффективного действия хлорорганических инсектицидов на членистоногих, внедрение в практику открытых вслед за ДДТ фосфорорганических инсектицидных соединений, а также карбаматов и пиретроидов было отложено на много лет.
Недостатки: хлорорганические пестициды стойки к воздействию высокой температуры, практически нерастворимы в воде, что делает невозможным полное освобождение пищевых продуктов от их остатков.
2.Фосфорорганические соединения (ФОС).
Инсектициды класса фосфорорганических соединений стали входить в практику дезинсекции в 50 — х годах прошлого века после того, как у многих вредных членистоногих появилась устойчивость к хлорорганическим инсектицидам, и возникла необходимость замены их на соединения из других классов, к которым насекомые и клещи оставались чувствительными. «Расцвет» применения фосфорорганических инсектицидов пришѐлся на 60 — 70 — е и первую половину 80 — х годов.
Фосфорорганические соединения представляют собой сложные эфиры ряда кислот (фосфорной, тиофосфорной, дитиофосфорной, фосфоновой и других). К ним относится Бай Mайт действующим веществом которого является фоксим (диэтил — α — цианобензил — диенамино — тиофосфат (Bayer), Хлорофос, Флай Клин (действующим веществом является Азаметифос, Винилфосфат (0,0 — диметил — 0, 1, 2, 4, 5 трихлорвинил (2 хлорвинил) фосфат). Препараты обладают разной степенью активности и токсичности. Например токсичность для кур винилфосфата или LD50 = 767 мг/кг, а хлорофоса 141 мг/кг, но инсектицидная активность винилфосфата против куриных клещей значительно ниже чем у хлорофоса, хотя овоцидная активность (уничтожение яиц клещей) винилфосфата превышает таковую у хлорофоса.
В основе механизма действия большинства фосфорорганических инсектицидов лежит угнетение активности ряда ферментов, относящихся к эстеразам, в частности, ацетилхолинэстеразы, регулирующей количество ацетилхолина (уксуснокислого эфира холина), образующегося в синапсах.
В норме ацетилхолин выполняет функцию передачи сигналов нервной системы через синапсы, в которых он образуется, при большом его количестве — блокирует их передачу, что приводит к параличу организма и смерти. При появлении избытка ацетилхолина начинает действовать ацетилхолинэстераза, которая разлагает его избыточное количество на составные части, выводимые из организма членистоногого через выделительную систему. Таким образом поддерживается требуемое равновесие. Подавляя активность ацетилхолинэстеразы, фосфорорганические инсектициды способствуют накоплению в синапсах ацетилхолина, что приводит организм к параличу и смерти.
Преимуществами фосфорорганических инсектицидов являются острое инсектицидное действие и малая стойкость в объектах внешней среды: они довольно быстро разлагаются на нетоксичные компоненты в воде, почве, на растительности, и накопления инсектицидов не происходит. Частично или полностью разрушаются при воздействии высоких температур. При случайном загрязнении мяса большими количествами фосфорорганических пестицидов (превышающих ДОК в 3 — 4 раза) оно не может быть реализовано через торговую сеть. Можно использовать его для изготовления вареных колбас, технология производства которых требует высокой температуры.
Недостатками многих фосфорорганических инсектицидов являются их высокая токсичность для млекопитающих, что влечѐт за собой необходимость соблюдения строгих мер предосторожности при их использовании, короткий срок остаточного действия и способность быстро проникать через неповреждѐнную кожу теплокровных животных и человека.
Наиболее применяемыми фосфорорганическими действующими веществами в птицеводстве является: Хлорофос.
3.Карбаматы.
Инсектициды класса карбаматов разработаны в 50 — х годах прошлого века и вошли в практику дезинсекции в то же время, что и фосфорорганические. Представляют собой производные карбаминовой, тио — и дитиокарбаминовых кислот. По своему действию карбаматы очень близки к фосфорорганическим соединениям, т.е. также ингибируют активность ацетилхолинэстеразы, но, в отличие от фосфорорганических инсектицидов, ингибируют ещѐ активность глутатион — S — трансферазы.
К ним относятся: Флай Байт (Байер, Нидерланды), Дикрезид, Байгон, Мекарбенил, Севин. Метомил, входящий в состав некоторых препаратов (из группы карбаматов) относится к I классу опасности высокопасных соединений, ЛД50 при введении в желудок 17 — 24 мг/кг.
По классификации рисков Европейской Комиссии относится к группе с очень высокой токсичностью, представляющей опасность для окружающей среды: R50, R53.
Недостатками являются относительно высокая токсичность, а также эмбриотропность, мутагенность и кумулятивность. Из пестицидов этого химического класса наибольшую опасность представляют севин, цирам, ТМТД (тетраметилтиурамдисульфид). Они отличаются значительной стойкостью к высокой температуре, обладают цитогенетической активностью, гонадотоксическими свойствами, выраженным кумулятивным действием.
4.Пиретрины и пиретроиды.
Пиретрины являются одними из старейших инсектицидов растительного происхождения. Представителем класса пиретринов является пиретрум, который отличается быстротой действия на насекомых и безвредностью для человека. Получают его из многолетних видов горных ромашек.
Действующим началом пиретрума являются 6 близких по химическому строению веществ: пиретрин — 1, пиретрин — 2, циперин — 1, циперин — 2, жасмолин — 1 и жасмолин — 2, объединенных под общим названием — пиретрины. Это сильнодействующие контактные яды для насекомых. В настоящее время они используются как добавки к пиретроидам для усиления их действия.
В отличие от пиретринов пиретроиды — это сложные эфиры хризантемовой, перметриновой, циклопропанкарбоновой, изовалериановой и других кислот.
Синтез первого пиретроида был осуществлен в 1949 г Шехтером, Грином и Ла Форжем и получил название аллетрин. В настоящее время пиретроиды доминируют на рынке производимых в мире инсектицидов.
Различают пиретроиды первого поколения (аллетрин, неопинамин (тетраметрин), ресметрин и др.) и второго поколения (перметрин (его отечественный аналог анометрин — Н), циперметрин (отечественный аналог — анометрин — Ц), дельтаметрин, цигалотрин и др.). Исследования Фролова Б.А. показали, что препараты на основе перметрина токсичнее для кур, чем анометрин — Н (в сопоставимых концентрациях по ДВ). По эффективности анометрин — Ц и циперметрин одинаковы, но они значительно токсичнее анометрина — Н и технического хлорофоса.
Инсектициды первого поколения пиретроидов имеют недостатки — слабую фотостабильность (чувствительны к солнечному свету) и краткосрочность остаточного действия на обработанных поверхностях, не превышающую 5 — 1 0 суток. Однако, острая инсектицидная активность пиретроидов этого поколения в 5 — 20 раз выше, чем у пиретринов.
Инсектициды второго поколения пиретроидов имеют длительное остаточное действие. Инсектицидная активность пиретроидов второго поколения превосходит фосфорорганические соединения и карбаматы в десятки — сотни раз.
По механизму действия на членистоногих пиретроиды относятся к нейротропным ядам, причем действие их более выражено при пониженных температурах. Подавление Nа+ и К+ проницаемости в синапсах при контакте с пиретроидами — одна из причин, которая приводит к последующей блокаде передачи нервных сигналов, параличу организма и его смерти. Другой причиной смерти является подавление активности ферментов — монооксигеназ. К ним относят Дюрасид С, Дракер 10.2.
Преимущества пиретроидов: эффективное инсектицидное действие на многие виды насекомых в сравнительно малых дозах. Быстрое и глубокое парализующее действие даже в сублетальных дозах. Высокая избирательность действия (высоко токсичны для насекомых и мало токсичны для животных и человека). Длительное остаточное действие на обработанных поверхностях.
Степень токсичности у представителей группы неодинакова. Имеются как малотоксичные соединения (неопинамин, перметрин и др.), так и высокотоксичные (дельтаметрин, цигалотрин и др.). Некоторые обладают раздражающими свойствами (дельтаметрин, фенвалерат, перметрин). В целом, более токсичны соединения, содержащие циан группу.
Наиболее применяемыми пиретроидами (по действующим веществам) и препаратами на их основе являются: Перметрин, Циперметрин.
Недостатком пиретроидов второго поколения является то, что у членистоногих выработалась способность обнаруживать инсектицид при контакте и покидать место его применения до получения летальной дозы, так называемая раздражимость. Раздражимость, также как и резистентность, наследуется, т.е. контролируется соответствующими генами и развивается через отбор раздражимых особей. Например, широко известный перметрин вызывает сильную раздражимость у многих насекомых, даже если применяется впервые.
5.Неоникотиноиды.
В 90 — е годы ХХ века в Японии был синтезирован хлоринированный дериватив никотина, но права на это действующее вещество были куплены фирмой «Байер», которая доработала соединение и выпустила на рынок под названием Имидаклоприд.
Механизм действия неоникотиноидов заключается в ингибировании никотин-ацетилхолиновых рецепторов насекомых, что выражается в блокировании ацетилхолиновых синапсов нервной системы.
6.Фенилпиразолы.
В России зарегистрировано единственное действующее вещество из этого класса — Фипронил. Механизм действия: фипронил блокирует передачу нервных сигналов в синапсах, осуществляемую гамма-аминомасляной кислотой, что приводит к параличу и смерти насекомых.
В сельском хозяйстве для борьбы с вредителями разрешены следующие инсектициды: Адонис 4% КЭ, Космос 25% КС, Регент 2.5% КЭ, Регент 80% ВРГ.
7.Сульфонамиды и гидразоны (аминогидразоны).
Механизм действия этих двух классов веществ заключается в подавлении работы митохондрий в клетках эпителия кишечника и нарушении процесса синтеза АТФ, т.е. эти вещества практически подавляют процесс выработки членистоногими энергии (синтез АТФ — главный источник энергии большинства биологических процессов). Сульфонамиды кроме этого подавляют синтез РНК. Оба класса веществ относятся к «чисто» кишечным инсектицидам, т.е. эти вещества действуют только при попадании в кишечник насекомых и не будут «работать» при нанесении их на различные поверхности.
Используются в различных отравленных приманках для уничтожения тараканов и муравьѐв. Оба класса веществ действуют медленно, и особенно подходят для борьбы с муравьями, так как муравьи — фуражиры успевают принести отравленную приманку в своѐ гнездо и накормить ей личинок, своих собратьев и, главное, матку (а также запасных маток), что приводит к быстрой гибели всех муравьѐв.
При использовании против муравьѐв отравленных приманок с инсектицидами контактного или контактно — кишечного действия муравьи — фуражиры, как правило, не успевают донести еѐ до гнезда из-за быстрого действия указанных инсектицидов.
8.Соли кислот.
Из этой группы веществ в дезинсекции для борьбы с тараканами и муравьями широко используется в отравленных приманках Бура (тетраборат натрия) — натриевая соль борной кислоты. Относится к «чисто» кишечным инсектицидам.
9.Пирролы.
Американская фирма Cyanamid разработала новый класс инсектицидов, названный пирролами (pyrroles). Помимо действия на насекомых, они эффективны и против клещей. Механизм действия пирролов — подавление выработки энергии в клеточных митохондриях членистоногих.
Пирролы безопасны для человека и млекопитающих, потому что в их организме проинсектицид не может конвертироваться в активные молекулы и, кроме того, быстро экскретируется в мочу. Зарегистрирован только один инсектицид — Хлорфенапир.
Резистентность (устойчивость) членистоногих к инсектицидам
Устойчивость или резистентность членистоногих к инсектицидам это их способность к нейтрализации действия ядов (обезвреживание).
Явление это врождѐнное, контролируемое одним или несколькими генами, и возникает под давлением отбора при использовании инсектицида.
Обычно в популяциях членистоногих имеются лишь единичные экземпляры с генами (геном) устойчивости к определенному инсектициду. Эти особи не погибают во время дезинсекции, как большинство их собратьев, и дают потомство, сохраняющее и закрепляющее признаки родителей.
С каждым туром обработок этим же инсектицидом на том же объекте таких особей будет становиться всѐ больше и больше. И наступает такой момент, когда применение инсектицида не дает желаемого эффекта.
Таким образом, чем больше происходит за год генераций насекомых, подвергающихся воздействию инсектицида, тем быстрее может развиваться у них устойчивость к инсектициду. Скорость развития резистентности также зависит от того, каким количеством генов она контролируется.
У членистоногих, имеющих один ген резистентности к определѐнному инсектициду (например, к фосфорорганическим инсектицидам), устойчивость развивается гораздо быстрее, чем у тех, которые имеют несколько таких генов (к ДДТ, многим пиретроидам).
При подозрении, на устойчивость насекомых (членистоногих) к инсектициду, прежде всего необходимо убедиться, что падение эффективности инсектицида произошло именно по этой причине. Зачастую эффективность проведения дезинсекции зависит от качества препарата и соблюдения технологии обработки. В таком случае целесообразно проверить:
а) сроки годности инсектицида (возможно вышел срок годности);
б) соблюдение условий его хранения;
в) правильность приготовления рабочей смеси;
г) качество обработки (равномерность нанесения препарата, полноту покрытия поверхностей, особенно если работают новые или малоопытные дезинфекторы). Если все эти условия соблюдены и, тем не менее, препарат не работает, только тогда можно говорить о появлении устойчивости.
В опытах по определению степени резистентности применяют такие количества яда и в течение столь длительного периода времени, чтобы наверняка убить всех чувствительных особей. Такая доза (концентрация), убивающая всех чувствительных особей при определѐнной (различной для разных инсектицидов) экспозиции (времени опыта), называется дискриминирующей или диагностической.
Резистентной считается популяция, у которой в опыте 50% и более особей не погибает под воздействием дискриминирующей дозы. В большинстве случаев такая ситуация требует немедленной замены инсектицида.
Существуют монорезистентность, когда членистоногое устойчиво к одному инсектициду и чувствительно к другим, мультирезистентность, когда членистоногое устойчиво к нескольким инсектицидам из разных химических классов веществ, имеющих одинаковый механизм действия, и перекрѐстная резистентность, когда в результате применения одного инсектицида возникает резистентность к другому, часто принадлежащего к иному классу инсектицидов.
Например, резистентные к ДДТ популяции насекомых часто являются также резистентными к некоторым пиретроидам. Или высоко резистентные к хлорофосу комнатные мухи оказываются устойчивыми к аналогу ювенильного гормона — метопрену, который вообще не применялся ранее в борьбе с мухами. Что делать, когда у насекомых появилась устойчивость к применяемому инсектициду?
В этом случае необходимо сменить применяемый инсектицид на другой и с иным механизмом действия, при этом придерживаясь следующей схемы замены инсектицидов:
–фосфорорганический инсектицид можно заменить инсектицидом из этого же класса только в том случае, если эти инсектициды сильно различаются по своей химической формуле. Его можно также заменить инсектицидом из карбаматов или ингибиторов развития насекомых. Но лучше всего сделать замену пиретроидом.
–инсектицид из класса карбаматов можно заменить инсектицидом из ингибиторов развития насекомых, но лучше пиретроидом.
–пиретроид можно заменить инсектицидами из всех представленных классов инсектицидов, но лучше всего фосфорорганическим инсектицидом, так как резистентность к пиретроиду при этом будет исчезать быстрее, чем при замене любым другим инсектицидом. Ротацию инсектицидов необходимо проводить ежегодно.
Как показала практика, лучше работать смесью двух инсектицидов из разных классов, например, фосфорорганичекого инсектицида и пиретроида. Даже при возникновении резистентности к одному из компонентов этой пары, во-первых, смесь будет высоко эффективна и, во-вторых, наличие в смеси другого компонента ведѐт к быстрому исчезновению уже возникшей резистентности к первому.
Замена фосфорорганических инсектицидов и пиретроидов карбаматами (пропоксур, бендиокарб) не ведѐт к исчезновению возникшей устойчивости к препаратам этих двух групп. То же наблюдается и при обратной последовательности в ротации (последовательной замене) инсектицидов: резистентность к карбаматам не исчезает при замене их на пиретроиды.
Раздражимость членистоногих к инсектицидам
Раздражимость это способность членистоногого обнаруживать инсектицид при контакте и покидать место его применения до получения летальной дозы.
Раздражимость, также как и резистентность, наследуется, т.е. контролируется соответствующими генами и развивается через отбор раздражимых особей. Например широко известный перметрин вызывает сильную раздражимость у многих насекомых, даже если применяется впервые.
Как правило, высоко резистентные популяции членистоногих почти не раздражимы и наоборот. К сожалению, механизм раздражимости членистоногих к инсектицидам мало изучен. Что же делать в случае появления раздражимости у насекомых? Как и в случае с появлением резистентности нужно провести замену инсектицида. Но во многих случаях нельзя заменять используемый инсектицид другим из того же класса химических соединений.
Нельзя также проводить замену инсектицида на многокомпонентную смесь, если в еѐ состав входит заменяемый инсектицид. Лучше всего проводить замену инсектицидом другого класса веществ.
Раздражимость часто бывает более значимой, чем устойчивость: резистентности к инсектициду нет, а он не работает, так как насекомые избегают контакта с ним (сидят на развешенной одежде, в необработанных местах), но если инсектицид обладает сильным репеллентным (фумигантным) действием, то раздражимые насекомые покидают помещения (перебираются в необработанные).
Расчет эффективности дезинсекции и концентрации рабочего раствора
1. Расчет эффективности дезинсекции ведут по формуле:
Эффективность (%) =, где:
N1 — численность членистоногих до обработки или на контрольном участке;
N2 — то же после обработки или на опытном участке.
Для более объективной оценки эффективности дезинсекции применяют модифицированную формулу, учитывающую естественную гибель членистоногих за период времени ожидания эффекта (между последовательными учетами обилия до и после обработки):
Эффективность (%) = 100 — , где:
N1 — среднее число членистоногих на опытных площадках до обработки;
N2 — то же после обработки;
n1 — среднее число членистоногих на контрольных участках до обработки n2 — то же после обработки на опытных участках.
2. Расчет концентрации рабочего раствора дезинфектантов для влажной дезинсекции. Рабочие растворы готовят путем разведения препаратов в воде до соответствующих концентраций. Расчет требуемого количества исходного препаратаведут по формуле: V, где:
V1 — количество исходного препарата (л);
Кр — эффективная концентрация ДВ в рабочей жидкости (%); Кп — концентрация ДВ в исходном препарате (%); V2 — необходимый объем рабочей жидкости (л).
К вычисленному таким образом количеству препаратив-
ной формы добавляют воду до необходимого объема рабочей жидкости.
Оценка эффективности истребительных мероприятий
Проверку эффективности дезинсекционных работ осуществляют, используя не менее двух следующих методов контроля: визуальный: осмотр мест возможного нахождения насекомых, с применением средств, активизирующих их выход из укрытий (провокантов, получаемых из инсектицидных аэрозольных баллонов, предназначенных для уничтожения нелетающих насекомых, просто постукиванием по поверхности объекта);
Объективный: обнаружение погибших и парализованных насекомых, отлов на липкие листы. При оценке эффективности используют липкие листы (20 х 30 см), которые раскладывают на полу под клетками из расчета 2 листа на 10 кв.м. площади помещения или в местах, подходящих для размножения, из расчѐта 2 листа на 40 — 50 кв.м.
Критерием оценки эффективности мероприятий против членистоногих является отсутствие насекомых на третий день после обработки объекта, подтверждѐнное контролем. Расчет эффективности дезинсекции необходимо провести по формуле:
Эффективность (%) =,где
N 1 — численность членистоногих до обработки или на контрольном участке;
N 2 — то же после обработки или на опытном участке.
Для более объективной оценки эффективности дезинсекции применяют модифицированную формулу, учитывающую естественную гибель членистоногих за период времени ожидания эффекта (между последовательными учетами обилия до и после обработки):
Эффективность (%) = 100 — , где:
N1 — среднее число членистоногих на опытных площадках до обработки;
N2 — то же после обработки;
n1 — среднее число членистоногих на контрольных участках до обработки n2 — то же после обработки на опытных участках.
*Если эффективность дезинсекции составляет 90%, то такая обработка считается эффективной.
*Если дезинсекция проведена технически правильно, а на листе бумаги вы видите 2 — 3 особи, — выясните, в чем причина.
*Если наступило привыкание (резистентность) к препарату, то после проведения обработки (на 1 — 3 день) на тестовом листе бумаги вы увидите некоторое количество особей (1 — 2) — меньшее по количеству чем было до обработки.
*А вот если наступила раздражимость и после того как клещи распознали инсектицид и сбежали, то сразу после обработки на тестовом листе вы не увидите клещей, зато через несколько дней (3 — 4) их будет столько же, что и до обработки.
Быстрый (экспресс — метод) определения эффективности проведенных мероприятий. Известно, что излюленным местом скопления куриных клещей являются места скрепления кормушек. Надо взять обычный белый лист бумаги, например формата А5, поднести его под шов кормушки и сверху постучать по кормушке карандашом или шариковой ручкой. Если там остались клещи, они обязательно посыплются на белый лист бумаги.
Инструкция по проведению дезинсекции
Дезинсекция «по — грязному» проводится до механической очистки помещения сразу после вытарки (вывоза) последней партии птицы из корпуса. Обработку против эктопаразитов проводят одним из разрешенных к применению инсектицидов.
1.Санитар — дезинфектор с утра, в 8 — 00 ч. должен приготовить маточный раствор, например хлорофоса. Делать это необходимо именно с утра, а не перед обработкой, потому что хлорофос растворяется очень медленно, а приготовить его необходимо правильно и нужной концентрации. В процессе подготовки корпуса для посадки следующей партии птицы задействовано очень много рабочих и специалистов.
Все работы рассчитаны по часам. И если начать приготовление раствора для обработки непосредственно за час до обработки очень может быть, что вы не успеете вовремя приступить к работе из — за того, что хлорофос еще не растворился. Некоторые в этом случае просто засыпают препарат в ДУК, заливают его водой прямо в цистерну ДУКа, рассчитывая на то, что пока ДУК едет, все растворится. Совершенно ясно, что качественной дезинсекции в таком случае не получится. Поэтому начинайте готовить маточный раствор с самого утра или даже внекоторых случаях с вечера.
Для приготовления маточного раствора необходимо взвесить хлорофос в необходимом количестве, предварительно рассчитав по формуле (п.2.3)
Например: препарат Хлорофос имеет 85% по АДВ. Необходимо приготовить 2% рабочий раствор (для дезинсекции в отсутствие птицы применяют 2% раствор хлорофоса, для дезинсекции в присутствии птицы применяется 1% раствор). Площадь птичника 18 х 96 м. (пустой) = 1728 м2. Расход рабочего раствора 0,5 л/1м2. Расчет проводим по формуле:
V =, где:
v — количество исходного препарата (л, кг.);
Кр — эффективная концентрация ДВ в рабочей жидкости (%); Кп — концентрация ДВ в исходном препарате (%); V — необходимый объем рабочей жидкости (л).
К вычисленному таким образом количеству препаративной формы добавляют воду до необходимого объема рабочей жидкости.
V =

= 20,329 кг
(необходимо исходного хлорофоса).
Необходимое количество рабочего раствора: 0,5 мл ×
1728 м2 = 864 л
Необходимое количество воды: 864 — 20,329 = 843,67 л
Итак, для приготовления 864 л рабочего 2% раствора необходимо 20,329 кг хлорофоса и 843,67л воды.
Приготовление маточного раствора производят в стационарно стоящей в помещении санпропускника емкости вместимостью около 200 л. Вносят сначала препарат, затем доливают воду и медленно размешивая, готовят маточный раствор. Хлорофос очень летучий препарат, поэтому хранить его нужно в плотно закрытом барабане.
После того как препарат полностью растворится необходимо его закачать в ДУК и долить воды до необходимого количества. Необходимо заранее знать какое количество рабочего раствора препарата вам понадобится для проведения дезинсекции из расчета 0,5 л на 1 м2. Если емкость ДУКа не позволяет закачать сразу весь раствор, то количество приготовленного раствора делят на два раза, например: Маточный раствор подготовили в 150 л воды, растворив 20,329 кг хлорофоса. 843,67/2 = 421,84 л воды можно закачать в ДУК. Таким образом, необходимо закачать в ДУК половину маточного раствора, — 75 л + 421,84 воды. Но тогда для обработки одного корпуса потребуется две заправки. Здесь приведены расчеты с точностью до сотых для того, чтобы врачи при вычислении не теряли нить расчетов.
2.Дезинфекцию «по грязному» необходимо начать сразу после вытарки (вывоза) последней партии птицы из корпуса. Это необходимо сделать для того, чтобы эктопаразиты (клещи), которые остались в корпусе не переместились на птицу соседнего птичника.
Автомашина ДУК с дезраствором подъезжает с торца обрабатываемого корпуса.
Электрик цеха перед проведением дезинфекции открывает входные двери и включает свет.
Ветсанитары через заднюю дверь зала растягивают шланги вдоль всего корпуса, предварительно надев средства индивидуальной защиты.
Водитель включает насос и подается в шланг рабочий раствор.
Перед началом обработки необходимо убедиться, что все рабочие вышли из помещения.
Дезинсекция проводится при выключенной вентиляции и начинается с обработки стен на высоту 1,5 м при напольном содержании и на высоту верхнего яруса клеточных батарей при клеточном содержании. Направление обработки предусматривает движение от «чистой » стороны к выходному пометному транспортеру при клеточном содержании или к тем воротам корпуса, через которые производится удаление подстилки при напольном.
При напольном содержании обрабатываются стены, оборудование для поения и кормления, несущие конструкции и подстилка. При клеточном содержании: стены, клетка, пометные ленты и если есть пометные каналы и пометные ямы, которые еще сохранились на некоторых фабриках со старым оборудованием. Особое внимание при обработке против эктопаразитов необходимо обращать на стыковочные креплениях кормушек, т.к. они являются излюбленными местами обитания клещей.
Также необходимо тщательно проливать дезраствором пометные каналы. Иногда на фабриках приходится сталкиваться с тем, что санитары — дезинфекторы обрабатывают стены, клетку, полы, а пометные каналы — игнорируют. И как следствие эти бесконтактные очаги сохранят популяцию эктопаразитов, которая в очень короткие сроки распространяется по всему корпусу. В корпусах, где имеются пометные ямы также необходимо проводить дезинсекцию этих ям в полном объеме, а именно обрабатывать раствором стены ям и затем дно ямы.
По завершению дезинфекции ветсанитары сворачивают шланги, укладывают вДУК и закрывают двери.
О пометных ямах хочется сказать несколько слов дополнительно. В некоторых хозяйствах пометные ямы (которые находятся вне корпуса и куда удаляется помет из пометных каналов корпуса) не санируют годами. Во время цикла выращивания птицы ямы освобождают от помета и на этом ставят точку.
Особенно в зимнее время. Конечно, замерзший помет тяжело вычистить, если он замерз на морозе. Тем более, что качественно это можно сделать только вручную, для этого два рабочих забираются в яму и лопатами или другими подсобными инструментами отскребают помет, а уже затем машиной выгружают помет из ямы и вывозят на пометное хранилище. И мало кто задумывается, что если не провести механическую очистку и затем дезинфекцию пометных ям, то как только суточный молодняк посадят в этот корпус, с температурой воздуха в первые дни в зависимости от кросса от 33˚С для Xy Line, Ross 388 и до 36˚С для Хайсекса, все то, что находится в пометной яме очень скоро будет у цыплят.
Другими словами все, что касается санации корпуса, относится и к пометным ямам. В ямах также проводят дезинсекцию «по грязному», механическую чистку, мойку, влажную дезинфекцию и забеливание10% молочком свежегашеной хлорной извести.
При работе с химическими веществами, которые используются для дезинфекции, дезинсекции и дератизации всегда необходимо пользоваться защитными средствами: резиновыми перчатками, сапогами и фартуком, а также использовать очки и респиратор. Так же защитные средства должен применять и помощник санитара — дезинфектора.
В настоящее время компании — производители предлагают широкий спектр химических препаратов для дезинсекции, но чаще всего применяют 2% раствор хлорофоса. Его можно менять на препараты из группы пиретроидов, такие как стомазан, неостомазан и др. Но через очень короткое время иногда обнаруживается, что они перестали действовать эффективно. Проверить это просто — через 3 дня после обработки (в зависимости от класса препарата) возьмите чистый лист бумаги (или липкую ленту) примерно размером А5 и карандаш. Лист бумаги подставьте под тот участок предмета, который вы хотите проверить. Например, под кормушку.
Особенно много клещей бывает в местах стыков и креплений. После того, как вы подставили чистый белый лист бумаги под участок исследуемого предмета, легко постучите по этому участку карандашом или любым другим предметом. Расчет эффективности проведенной дезинсекции произведите по формуле, которая указана в п. 2.7. Оценка эффективности истребительных мероприятий.
Как показала практика, для усиления эффекта хлорофоса его можно применять в смеси со стомазаном или неостомазаном (0,1%). Это практикуется на птицефабриках яичного направления в стадах промышленной несушки. Там, где птица содержится до 420 дней, а иногда и до 600 и более, после принудительной линьки. В этом случае в корпусах накапливается большое количество эктопаразитов и, исходя из сложившейся ситуации, приходится обрабатывать птичники 1% хлорофосом в присутствии птицы.
Для борьбы с красным куриным клещом применяют препарат Бай Mайт производства компании Байер. Обработку помещений проводят крупнокапельно двукратно с интервалом 7 — 10 дней, используя 0,4% водную эмульсию Бай Майта. Необходимый для обработки птичника объем рабочей эмульсии готовят из расчета 100 мл Бай Майта на 25 л воды непосредственно перед обработкой.
Конец ознакомительного фрагмента.
