Описание препарата ИЛСИРА® (раствор для подкожного введения, 180 мг/мл) основано на официальной инструкции, утверждено компанией-производителем в 2022 году
Дата согласования: 20.06.2022
Особые отметки:
Содержание
- Фотографии упаковок
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Состав
- Описание лекарственной формы
- Фармакологическое действие
- Фармакодинамика
- Фармакокинетика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Производитель
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Аналоги (синонимы) препарата ИЛСИРА®
Фотографии упаковок
20.06.2022
Действующее вещество
ATX
Фармакологическая группа
Состав
| Раствор для п/к введения | 1 мл/0,9 мл* |
| действующее вещество: | |
| левилимаб | 180,0/162,0 мг |
| вспомогательные вещества: натрия ацетата тригидрат — 0,436/0,392 мг; глицин — 7,5/6,8 мг; маннитол — 23,0/20,7 мг; кислота уксусная ледяная — до рН 5,0/5,0; вода для инъекций — до 1,0/0,9 мл | |
| * В предварительно наполненном шприце |
Описание лекарственной формы
Раствор для п/к введения: прозрачный, желто-коричневого цвета. Возможно наличие легкой опалесценции.
Фармакологическое действие
Фармакодинамика
Левилимаб — рекомбинантное моноклональное антитело к рецептору ИЛ-6 подкласса IgG1. Левилимаб связывается и блокирует как растворимые (рИЛ6Р), так и мембранные рецепторы ИЛ-6 (мИЛ6Р). Блокада обеих форм рецептора позволяет предотвратить реализацию ИЛ-6-ассоциированного провоспалительного каскада, препятствует активации антигенпрезентирующих клеток, В- и Т-лимфоцитов, моноцитов и макрофагов, эндотелиальных клеток и фибробластов, и избыточной продукции других провоспалительных цитокинов. ИЛ-6 является ключевым элементом синдрома массивного высвобождения цитокинов (синдром цитокинового шторма, гемофагоцитарный лимфогистиоцитоз или синдром активации макрофагов), который может привести к острому респираторному дистресс-синдрому, полиорганной недостаточности и являться причиной летального исхода. Массивное высвобождение цитокинов (цитокиновый шторм) наблюдается у пациентов, получающих иммуносупрессивную терапию, включая деплецирующие агенты (в частности моноклональные антитела к рецепторам Т- и В-лимфоцитов), а также при тяжелых инфекционных заболеваниях, в т.ч. у пациентов с COVID-19. Высокий уровень ИЛ-6 в крови ассоциирован с более тяжелым течением новой коронавирусной инфекции и выраженными изменениями легких, что обусловливает потребность в интенсивной терапии и увеличивает риск летального исхода при COVID-19. ИЛ-6 — единственный цитокин, непосредственно индуцирующий синтез острофазовых белков в гепатоцитах: С-реактивного белка (СРБ), фибриногена, сывороточного амилоидного белка А, гипсидина, лептина. Кроме того, ИЛ-6 участвует в активации и поддержании местных воспалительных реакций (образование паннуса в синовии, стимуляция остеокластогенеза — эрозия хрящевой ткани, остеопороз), что наблюдается в патогенезе ревматоидного артрита.
Специфическая противовоспалительная активность левилимаба продемонстрирована в тестах in vitro и in vivo. Левилимаб оказывает антипролиферативное действие на культуру клеток DS-1, вызывая дозозависимое ингибирование роста клеток. На модели коллагениндуцированного артрита у яванских макак (Macaca fascicularis) многократное (1 раз в нед в течение 7 нед) п/к введение левилимаба сопровождается снижением выраженности воспалительной реакции в суставах, что подтверждено при гистологическом исследовании (значимое снижение выраженности воспалительных и дегенеративных изменений хрящевой ткани).
Изменение параметров фармакодинамических маркеров (нарастание концентрации рИЛ6Р, насыщение мИЛ6Р, нарастание концентрации ИЛ-6) свидетельствует о высокоэффективной дозозависимой нейтрализации препаратом левилимаб обеих форм рецептора ИЛ-6, что, в свою очередь, сопровождается быстрым и выраженным снижением сывороточной концентрации СРБ, отражающим эффективное подавление воспалительного процесса. В клинических исследованиях левилимаба продемонстрировано блокирование до 90% мембранных рецепторов к ИЛ-6 в течение первых 2 ч от момента однократного п/к введения препарата в дозе 1,6 мг/кг и более.
Фармакокинетика
Всасывание/распределение. При однократном п/к введении левилимаба наблюдается дозозависимый рост его концентрации в сыворотке крови. После введения препарат начинает обнаруживаться в сыворотке крови пациентов через 2–12 ч, и его концентрация нарастает, достигая максимальных значений через 96 (72–168) ч. Дозы препарата, превышающие 2,0 мг/кг, продемонстрировали двухфазный характер увеличения концентрации: первый пик наблюдался в период 48–72 ч, второй — к 168 ч с последующим снижением до неопределяемых значений к 70-му дню.
После однократного п/к введения препарата в дозе 162 мг Cmax левилимаба в сыворотке крови составляла 17543 (10975; 28323) нг/мл, а значения показателя AUC, рассчитанной в период 0–168 ч (AUC0–168) — 1866231 (1297632; 3719014) нг·ч/мл.
При многократном введении левилимаба пациентам с ревматоидным артритом значения суммарной AUC, рассчитанной в период 0-2016 ч после введения (AUC0–2016), составили 189580779 (134794695; 230680771) нг·ч/мл при введении 1 раз в нед и 50763951 (34465213,5; 65810194,5) нг·ч/мл при введении 1 раз в 2 нед. Показатель Сmax-mult при повторных введениях нарастал и достигал значений 201024 (151563; 246408) нг/мл при еженедельном введении препарата и 51570 (37201; 71740) нг/мл при введении 1 раз в 2 нед. При этом Tmax составляло 1848 (1512; 2016) ч при еженедельном введении препарата и 1848 (1512; 1848) ч при введении 1 раз в 2 нед соответственно. Стационарный Vd составил 7871,029 (4226,795; 13363,547) мл при введении препарата 1 раз в нед и 7130,453 (5532,978; 11387,959) мл при введении 1 раз в 2 нед.
При повторных введениях отмечается накопление препарата, с ростом Cmax в 6,5–14,2 раза при еженедельном введении и в 1,9–4,2 раза при введении препарата 1 раз в 2 нед. Коэффициент кумуляции составил 10,932 (6,446; 14,178) для еженедельного введения препарата и 2,593 (1,902; 4,164) для введения 1 раз в 2 нед.
Таким образом у пациентов с ревматоидным артритом многократное п/к введение левилимаба 1 раз в нед обеспечивает более высокую сывороточную концентрацию и экспозицию по сравнению с введением 1 раз в 2 нед.
Выведение. Общий клиренс (Cl) левилимаба после однократного введения в дозе 2,2 мг/кг составил (35,288±11,7) мл/ч, а в дозе 2,9 мг/кг показатель Cl — (25,974±1,1) мл/ч. T1/2 однократной п/к дозы 2,9 мг/кг составил 133,683 (92,754; 197,197) ч. Значения показателей, характеризующих период элиминации, обладают дозозависимостью (показатели среднего времени пребывания препарата в организме и T1/2 нарастают с увеличением введенной дозы, а Cl — снижается), что говорит о нелинейной фармакокинетике препарата, обусловленной мишень-опосредованными распределением и элиминацией.
Особые группы пациентов
Почечная и печеночная недостаточность. Специальных исследований у данной категории пациентов не проводилось; фармакокинетические данные у больных с почечной и печеночной недостаточностью отсутствуют.
Возраст старше 65 лет. Фармакокинетические данные у лиц старше 65 лет отсутствуют.
Показания
- патогенетическая терапия синдрома высвобождения цитокинов при тяжелом течении новой коронавирусной инфекции (CОVID-19);
- ревматоидный артрит умеренной или высокой степени активности у взрослых с отсутствием адекватного ответа на терапию одним или несколькими болезньмодифицирующими противоревматическими препаратами, в т.ч. для торможения рентгенологической прогрессии (левилимаб применяется в комбинированной терапии с метотрексатом и/или другими синтетическими базисными противовоспалительными препаратами).
Противопоказания
- гиперчувствительность к левилимабу, а также к любому из вспомогательных веществ препарата;
- клинически значимые активные инфекции, включая туберкулез;
- сепсис, обусловленный патогенами, отличными от COVID-19;
- вирусный гепатит В;
- нейтропения менее 0,5·109/л;
- тромбоцитопения менее 50·109/л;
- повышение активности АСТ или АЛТ более чем в 5 раз;
- печеночная недостаточность тяжелой степени (класс С по классификации Чайлд-Пью);
- почечная недостаточность тяжелой и терминальной степени тяжести (СКФ <30 мл/мин);
- комбинированное применение с ингибиторами ФНО-α или применение в течение 1 мес после терапии моноклональными антителами к ФНО-α;
- беременность, грудное вскармливание;
- возраст до 18 лет.
С осторожностью: хронические и рецидивирующие инфекции или анамнестические указания на них; сопутствующие заболевания, предрасполагающие к развитию инфекций; период ранней реконвалесценции после тяжелых и среднетяжелых инфекционных заболеваний; недавно проведенная вакцинация живыми аттенуированными вакцинами; печеночная недостаточность легкой и средней степени тяжести (класс А и В по классификации Чайлд-Пью); почечная недостаточность средней степени тяжести (СКФ <60 и ≥30 мл/мин); дивертикулит, дивертикулез и язвенное поражение органов ЖКТ, в т.ч. в анамнезе (в связи с риском перфорации ЖКТ); демиелинизирующие заболевания; иммуносупрессивная терапия после трансплантации органов; раннее выявление инфекционных заболеваний на фоне терапии (в связи со способностью левилимаба подавлять реакции острой фазы воспаления); пожилой возраст (в связи с ограниченными данными клинических исследований).
Применение при беременности и кормлении грудью
Беременность. Исследований влияния на плод у беременных женщин не проводилось. Известно, что моноклональные антитела могут проникать через плацентарный барьер. Препарат ИЛСИРА® противопоказан к применению во время беременности. Женщины детородного возраста и их половые партнеры должны использовать эффективные средства контрацепции в период проведения терапии левилимабом.
Грудное вскармливание. Неизвестно, проникает ли левилимаб в грудное молоко. Учитывая, что IgG, к которым относится левилимаб, могут выделяться с грудным молоком, препарат ИЛСИРА® противопоказан к применению в период грудного вскармливания.
Фертильность. Данные о влиянии препарата на фертильность у людей отсутствуют.
Способ применения и дозы
П/к.
Препарат ИЛСИРА® предназначен для введения как в амбулаторно-поликлинических, так и в стационарных условиях.
Применение левилимаба должно осуществляться под контролем врача. В случае длительного применения препарата, в частности для терапии ревматоидного артрита, если врач считает это возможным, после соответствующего обучения технике п/к инъекций пациенты могут самостоятельно вводить себе препарат.
Препарат ИЛСИРА® вводится с помощью преднаполненного шприца в область передней брюшной стенки (отступая не менее 5 см от пупка), передней и боковой поверхности бедра или средней трети наружной поверхности плеча.
Не следует вводить препарат в места с поврежденной или измененной кожей (наличие уплотнений, покраснений, новообразований, гиперпигментаций или повышенной чувствительности).
Патогенетическая терапия синдрома высвобождения цитокинов при тяжелом течении новой коронавирусной инфекции (CОVID-19)
Рекомендуемая доза препарата ИЛСИРА® составляет 324 мг однократно в виде двух п/к инъекций по 162 мг каждая. В случае недостаточного эффекта первой дозы левилимаба возможно повторное введение препарата через 48–96 ч в дозе 324 мг в виде двух п/к инъекций по 162 мг каждая. Решение о необходимости повторного введения принимается исключительно врачом.
Ревматоидный артрит
Рекомендуемая доза препарата ИЛСИРА® составляет 162 мг/нед.
При развитии нежелательных явлений в ходе терапии ревматоидного артрита, связанных с изменением лабораторных показателей, следует провести коррекцию дозы и режима введения в соответствии с рекомендациями в таблицах 1, 2 и 3.
Таблица 1
Рекомендации по коррекции дозы при повышении активности печеночных ферментов АЛТ или АСТ
| Значение показателя АЛТ или АСТ | Рекомендации |
| Превышение ВГН в 1–3 раза | При необходимости провести коррекцию дозы одновременно принимаемых препаратов, обладающих гепатотоксическим эффектом (базисных противовоспалительных препаратов, антибактериальных средств, иммуномодулирующих препаратов). При устойчивом повышении активности трансаминаз в данном диапазоне снизить частоту инъекций препарата ИЛСИРА® до 1 раза в 2 нед или прервать терапию препаратом ИЛСИРА® до нормализации показателей АЛТ и АСТ. Возобновить терапию препаратом в дозе 162 мг с частотой введения 1 раз в 2 нед или 1 раз в нед в соответствии с клинической необходимостью |
| Превышение ВГН в 3–5 раз | Следует отменить лечение препаратом ИЛСИРА® до снижения уровня показателя, менее чем в 3 раза превышающего ВГН. Далее следовать вышеуказанным рекомендациям для превышения ВГН в 1–3 раза. При сохранении уровня показателя, более чем в 3 раза превышающего ВГН, отменить терапию препаратом ИЛСИРА® |
| Превышение ВГН более чем в 5 раз | Следует прекратить лечение препаратом ИЛСИРА® |
Таблица 2
Рекомендации по коррекции дозы при снижении абсолютного числа нейтрофилов (АЧН)
| Значение показателя (число клеток·109/л) | Рекомендации |
| АЧН >1 | Дозу препарата ИЛСИРА® оставить без изменений |
| АЧН 0,5–1 | Следует прервать лечение препаратом ИЛСИРА®. При повышении АЧН до 1·109/л и выше рассмотреть возобновление терапии препаратом в рекомендуемой дозе в соответствии с клинической необходимостью |
| АЧН <0,5 | Следует прекратить лечение препаратом ИЛСИРА® |
Таблица 3
Рекомендации по коррекции дозы при снижении количества тромбоцитов
| Значение показателя (число клеток·109/л) | Рекомендации |
| 50–100 | Следует прервать лечение препаратом ИЛСИРА®. При увеличении количества тромбоцитов до 100·109/л и выше рассмотреть возобновление терапии препаратом ИЛСИРА® в дозе 162 мг с частотой введения 1 раз в 2 нед и увеличить частоту введений до 1 раза в нед в соответствии с клинической необходимостью |
| <50 | Следует прекратить лечение препаратом ИЛСИРА® |
Пропуск дозы. При пропуске очередного введения по любой причине инъекция препарата ИЛСИРА® должна быть произведена как можно быстрее. Новый отсчет для даты следующего введения начинают с момента фактически проведенной инъекции препарата ИЛСИРА®.
Подготовка к проведению п/к инъекции (на данном этапе не следует снимать колпачок шприца)
1. Тщательно вымыть руки.
2. Извлечь упаковку со шприцем из холодильника. Затем извлечь шприц с лекарственным препаратом из картонной пачки. Осмотреть шприц, а также лекарственный препарат, находящийся в нем. Нельзя использовать шприц в случае: помутнения раствора, наличия в препарате посторонних видимых частиц; изменения цвета; повреждения любых частей шприца; истечения срока годности («годен до…»), указанного на картонной пачке, а также на этикетке шприца.
3.Оставить шприц при комнатной температуре приблизительно на 25–30 мин. Не следует согревать шприц с препаратом каким-либо другим способом.
4. Подготовить спиртовую салфетку/ватный тампон.
Техника выполнения п/к инъекции препарата ИЛСИРА® в преднаполненном шприце
1. Выбрать место инъекции (передняя брюшная стенка (отступая не менее 5 см от пупка), передняя и боковая поверхность бедра или средняя треть наружной части плеча (возможные места для инъекций закрашены на рисунке ниже).
2. Нельзя вводить препарат в место на коже, где имеется болезненность, покраснение, уплотнение или кровоподтек. Эти признаки могут указывать на наличие инфекции. Также не следует вводить препарат в места родинок, гиперпигментаций и шрамов.
3. Место укола необходимо обработать спиртовой салфеткой круговыми движениями.
4. Шприц не встряхивать.
5. Снять колпачок с иглы, не дотрагиваясь до иглы и избегая прикосновения к другим поверхностям.
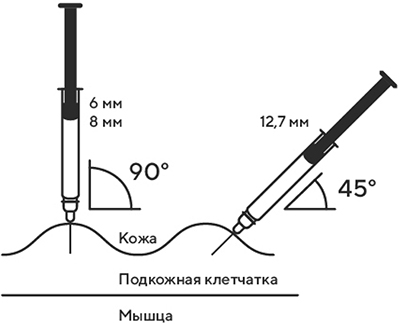
6. Одной рукой взять в складку обработанную кожу.
7. В другую руку взять шприц, держа его градуированной поверхностью вверх. Введение препарата необходимо осуществлять под углом 45 или 90° к поверхности кожи в зависимости от толщины кожи и выраженности подкожно-жирового слоя (у худощавых пациентов введение препарата осуществляется под углом 45°, у пациентов с толщиной кожной складки более 1,5 см допустимо введение под углом 90°).
8. Одним быстрым движением полностью ввести иглу в кожную складку.
9. После введения иглы отпустить складку кожи.
10. Ввести весь раствор медленным постоянным надавливанием на поршень шприца в течение 2–5 с.
11. Когда шприц будет пустым, вынуть иглу из кожи под тем же углом.
12. Кусочком марли слегка прижать область инъекции в течение 10 с, но ни в коем случае не тереть поверхность. Из места инъекции может выделиться небольшое количество крови. При желании можно воспользоваться пластырем.
13. После инъекции шприц повторно не использовать.
14. Вторую инъекцию препарата ИЛСИРА® для достижения общей дозы 324 мг выполнить аналогичным образом.
15. При последующих инъекциях следует менять место введения.
Утилизация расходного материала
Неиспользованный раствор препарата, использованные шприцы, салфетки/ватные тампоны и другие расходные материалы подлежат утилизации с применением закрывающегося контейнера, устойчивого к проколам для острых предметов из пластика или стекла. Не допускайть хранения использованных шприцев в местах, доступных для детей.
Побочные действия
Реклама: ООО «РЛС-Патент», ИНН 5044031277
В рамках проведенных клинических исследований у здоровых добровольцев, пациентов с ревматоидным артритом и тяжелым течением новой коронавирусной инфекции (COVID-19) препарат ИЛСИРА® показал благоприятный профиль безопасности. Наиболее частыми нежелательными реакциями в проведенных клинических исследованиях были повышение активности АЛТ и АСТ, нейтропения и повышение уровня липидов в крови. Спектр зарегистрированных нежелательных явлений, связанных с применением препарата ИЛСИРА®, был ожидаемым для класса ингибиторов рецепторов ИЛ-6. Летальных исходов, связанных с терапией препаратом ИЛСИРА®, в ходе клинических исследований не было.
В данной инструкции нежелательные реакции представлены в соответствии с международным словарем нежелательных реакций MedDRA. Ниже приведен перечень нежелательных реакций, зарегистрированных у пациентов, получавших левилимаб в рамках клинических исследований, и имеющих определенную, вероятную или возможную степень связи с приемом препарата. Частота указана с учетом следующих критериев: очень часто (≥1/10); часто (от ≥1/100 до <1/10); нечасто (от ≥1/1000 до <1/100); редко (от ≥1/10000 до <1/1000); очень редко (≤10000).
Таблица 4
| Системно-органный класс | Частота | Наименование реакции |
| Инфекции и инвазии | Нечасто | Вирусные инфекции дыхательных путей, пневмония, обострение хронического тонзиллита, латентный туберкулез, туберкулез легких |
| Со стороны крови и лимфатической системы | Часто | Нейтропения, лейкопения, лимфопения |
| Нечасто | Тромбоцитопения | |
| Общие нарушения и реакции в месте введения | Часто | Реакции в месте введения* |
| Нечасто | Гиперчувствительность в месте инъекции | |
| Со стороны печени и желчевыводящих путей | Нечасто | Токсический гепатит** |
| Со стороны сосудов | Нечасто | Повышение АД, в т.ч. изолированное повышение АД |
| Лабораторные и инструментальные данные | Очень часто | Повышение уровня АЛТ, АСТ |
| Часто | Повышение уровня Хс и триглицеридов в крови, билирубина, положительный результат анализа высвобождения γ-интерферона | |
| Нечасто | Положительный результат внутрикожного диагностического теста на туберкулез, увеличение веса |
* В клинических исследованиях регистрировались местные реакции в виде эритемы и кожного зуда.
** Данная нежелательная реакция проявлялась повышением АСТ и АЛТ и не сопровождалось другими симптомами токсического гепатита на фоне множественной лекарственной терапии.
Также в ходе клинических испытаний регистрировались единичные нежелательные явления, для которых в настоящее время связь с применением левилимаба не установлена достоверно: воспаление очага кожного поражения, анемия, лимфаденит, лимфоцитоз, повышение уровня глюкозы в крови, отклонение от нормы при процедуре визуализации легких, снижение уровня АСТ.
С учетом известного профиля безопасности препаратов класса ингибиторов рецепторов ИЛ-6, в качестве нарушений со стороны иммунной системы возможны реакции гиперчувствительности, несмотря на то что во время клинических исследований препарата левилимаб реакции гиперчувствительности зарегистрированы не были.
Взаимодействие
Сведений о наличии неблагоприятных лекарственных взаимодействий левилимаба с другими лекарственными препаратами до настоящего времени не получено.
Смешивание препарата с другими ЛС строго запрещено.
Передозировка
Симптомы: клинические данные о передозировке препарата ИЛСИРА® отсутствуют. Максимальная переносимая доза левилимаба для человека не установлена. В клинических исследованиях при п/к введении левилимаба в максимальной суточной дозе 324 мг двухкратно с интервалом 48–96 ч новых нежелательных реакций, изменяющих представление о профиле безопасности препарата, не зарегистрировано.
Лечение: симптоматическое. Специфический антидот отсутствует.
Особые указания
Серьезные инфекции
Наличие таких потенциально тяжелых инфекций, как ВИЧ, активный гепатит В, сифилис, туберкулез, относится к противопоказаниям для назначения левилимаба. Левилимаб не следует применять у пациентов с активным течением инфекционных заболеваний, включая локализованные инфекции. Учитывая иммуносупрессивное действие левилимаба, терапия этим препаратом потенциально может приводить к обострению хронических инфекций и повышению риска первичного инфицирования.
При реактивации гепатита В или развитии серьезных инфекций терапия левилимабом должна быть прекращена и назначена соответствующая этиотропная терапия.
Соблюдение осторожности требуется в отношении пациентов с рецидивирующими инфекционными заболеваниями в анамнезе, а также лиц, имеющих факторы риска развития инфекций в виде сопутствующих заболеваний или сопутствующей терапии.
С учетом подавления левилимабом реакций острой фазы воспаления, симптомы инфекционного заболевания могут быть стерты, что следует учитывать при раннем выявлении серьезных инфекций у пациентов, получающих препарат ИЛСИРА®. При появлении любых симптомов, свидетельствующих о развитии инфекционного заболевания на фоне применения левилимаба, пациенту следует немедленно обратиться к врачу для своевременной диагностики и назначения терапии.
Туберкулез
Пациентам с активным туберкулезом терапия препаратом ИЛСИРА® противопоказана. Перед назначением препарата ИЛСИРА® и в ходе терапии необходимо проводить стандартный скрининг на туберкулез. Пациентам с латентным туберкулезом рекомендуется пройти стандартный курс противотуберкулезной терапии перед началом терапии препаратом ИЛСИРА®.
Лабораторные показатели
Нейтропения. В клинических исследованиях препарата ИЛСИРА® отмечалось снижение числа нейтрофилов. При длительной терапии пациентов с ревматоидным артритом снижение АЧН не сопровождалось более высокой частотой развития инфекций, в т.ч. серьезных. Следует соблюдать осторожность при лечении препаратом ИЛСИРА® пациентов с АЧН <2·109/л. При снижении АЧН <0,5·109/л терапию препаратом ИЛСИРА® следует отменить. Следует оценивать число нейтрофилов через 4–8 нед после начала терапии, а в дальнейшем в соответствии с клинической практикой.
Тромбоцитопения. В клинических исследованиях препарата ИЛСИРА® отмечалось снижение числа тромбоцитов. При длительной терапии пациентов с ревматоидным артритом снижение числа тромбоцитов не сопровождалось развитием кровотечений. Следует соблюдать осторожность при назначении терапии препаратом ИЛСИРА® при числе тромбоцитов ниже 100·103/мкл. Лечение не рекомендуется при числе тромбоцитов <50·103/мкл. Следует оценивать число тромбоцитов через 4–8 нед после начала терапии, а в дальнейшем в соответствии с клинической практикой.
Ферменты печени. В клинических исследованиях препарата ИЛСИРА® отмечалось повышение активности печеночных трансаминаз без признаков печеночной недостаточности. Частота возникновения подобных изменений может возрастать при совместном использовании с препаратами, обладающими потенциальным гепатотоксическим действием (в т.ч. метотрексат, антибактериальные препараты). Следует соблюдать осторожность при назначении терапии препаратом ИЛСИРА® у пациентов с показателями АЛТ или АСТ, превышающими ВГН более чем в 1,5 раза. Следует оценивать показатели активности печеночных трансаминаз (АЛТ и АСТ) через 4–8 нед после начала терапии, а в дальнейшем в соответствии с клинической практикой.
Изменение показателей липидного обмена. В клинических исследованиях препарата ИЛСИРА® отмечалось повышение концентрации липидов (Хс общий и/или триглицериды). Следует оценивать показатели липидного обмена через 4–8 нед после начала терапии левилимабом, а в дальнейшем в соответствии с клинической практикой. При ведении пациентов с гиперлипидемией следует учитывать национальные рекомендации.
Реакции гиперчувствительности
При использовании левилимаба потенциально возможно развитие реакции гиперчувствительности. В рамках проведенных клинических исследований препарата ИЛСИРА® анафилактических реакций и реакций гиперчувствительности не зарегистрировано. Однако при использовании других ингибиторов рецепторов ИЛ-6 регистрировались крапивница и другие реакции гиперчувствительности, в т.ч. анафилаксия. При возникновении анафилактических или других серьезных аллергических реакций применение препарата ИЛСИРА® следует немедленно прекратить и начать соответствующую симптоматическую терапию.
Наличие алкогольной или наркотической зависимости
Наличие алкогольной или наркотической зависимости, а также психических расстройств может стать причиной несоблюдения пациентом графика лечения левилимабом, что, в свою очередь, может привести к снижению эффективности терапии. Необходимо более тщательное наблюдение за пациентами с указанными состояниями в связи с отсутствием результатов клинических исследований у данной категории пациентов и возможностью повышенного риска развития гепатотоксичности и других неблагоприятных последствий.
Иммуногенность
В ходе клинических исследований препарата ИЛСИРА®, в т.ч. при долгосрочном (в течение года) лечении ревматоидного артрита, выработки связывающих антител к левилимабу выявлено не было.
Особые группы пациентов
Возраст старше 65 лет. Данные об эффективности и безопасности препарата у пациентов старше 65 лет ограничены. Не предполагается наличия существенных возрастных различий в распределении и выведении препарата.
Нарушения функций почек и печени. Эффективность и безопасность препарата у данной категории пациентов не изучались.
Дети. Исследование эффективности и безопасности препарата у детей и лиц моложе 18 лет не проводилось.
Вакцинация
Не следует проводить иммунизацию живыми аттенуированными вакцинами в ходе лечения препаратом ИЛСИРА®, т.к. клиническая оценка безопасности данного взаимодействия в рамках клинических исследований не проводилась. Вакцинация живыми аттенуированными вакцинами до начала терапии препаратом ИЛСИРА®, а также интервал между вакцинацией и началом терапии должны соответствовать действующим клиническим рекомендациям.
Демиелинизирующие заболевания
С учетом данных по профилю безопасности препаратов класса ингибиторов рецепторов ИЛ-6 следует соблюдать осторожность при применении левилимаба у пациентов с демиелинизирующими заболеваниями. Необходимо тщательно контролировать появление симптомов, указывающих на развитие демиелинизирующего заболевания ЦНС, несмотря на то, что способность левилимаба вызывать демиелинизирующие заболевания ЦНС в настоящее время не установлена.
Влияние на способность управлять транспортными средствами и механизмами. Отсутствуют данные о влиянии препарата ИЛСИРА® на способность управлять транспортными средствами и работать с машинами и/или механизмами. Учитывая то, что при терапии другими ингибиторами рецептора ИЛ-6 отмечались эпизоды головокружения, пациентам, испытывающим головокружение при применении препарата ИЛСИРА®, не рекомендуется управлять транспортными средствами и механизмами до тех пор, пока головокружение не прекратится.
Форма выпуска
Раствор для п/к введения, 180 мг/мл. По 0,9 мл в трехкомпонентных стерильных шприцах из бесцветного нейтрального стекла I гидролитического класса. Шприц с одной стороны имеет впаянную иглу для инъекций из нержавеющей стали, которая защищена пластмассовым колпачком с бутилкаучуковым уплотнителем. Шприц укупорен эластичным уплотнителем на поршень и поршнем. На каждый шприц наклеивают самоклеящуюся этикетку. По 1 шприцу в контурной ячейковой упаковке из пленки ПВХ. По 2 и 4 контурных ячейковых упаковки вместе с инструкцией по применению помещают в пачку из картона.
Пачку дополнительно комплектуют спиртовыми салфетками в количестве 2 или 4 шт.
Производитель
АО «БИОКАД», Россия. 198515, Санкт-Петербург, п. Стрельна, ул. Связи, 34, лит. А.
Владелец регистрационного удостоверения. АО «БИОКАД», Россия. 198515, Санкт-Петербург, п. Стрельна, ул. Связи, 38, стр. 1.
Организация, принимающая претензии потребителей. АО «БИОКАД», Россия. 198515, Санкт-Петербург, п. Стрельна, ул. Связи, 34, лит. А.
Тел.: (812) 380-49-33; факс: (812) 380-49-34.
e-mail: biocad@biocad.ru
Информацию о развитии нежелательных реакций направлять по адресу: safety@biocad.ru
Условия отпуска из аптек
По рецепту.
Условия хранения
В защищенном от света месте, при температуре 2–8 °C (не замораживать).
Хранить в недоступном для детей месте.
Срок годности
2 года.
Не применять по истечении срока годности, указанного на упаковке.
Описание проверено
-
Крылов Юрий Федорович
(фармаколог, доктор медицинских наук, профессор, академик Международной академии информатизации)
Опыт работы: более 34 лет
Аналоги по действующему веществу не найдены.
Илсира® (Ilsira) инструкция по применению
📜 Инструкция по применению Илсира®
💊 Состав препарата Илсира®
✅ Применение препарата Илсира®
📅 Условия хранения Илсира®
⏳ Срок годности Илсира®
Препарат отпускается по рецепту
Входит в список «Жизненно необходимых и важнейших лекарственных
препаратов»
Температура хранения: от 2 до 8 °С
Описание лекарственного препарата
Илсира®
(Ilsira)
Основано на официальной инструкции по применению препарата, утверждено компанией-производителем
и подготовлено для электронного издания справочника Видаль 2024
года, дата обновления: 2023.09.24
Владелец регистрационного удостоверения:
Контакты для обращений:
БИОКАД АО
(Россия)
Код ATX:
L04AC
(Ингибиторы интерлейкина)
Лекарственная форма
|
Препарат отпускается по рецепту |
Илсира® |
Раствор для подкожного введения 180 мг/1 мл: шприцы 0.9 мл 2 или 4 шт. в компл. с салфетками рег. №: ЛП-006244 |
Форма выпуска, упаковка и состав
препарата Илсира®
Раствор для п/к введения прозрачный, желто-коричневого цвета; возможно наличие легкой опалесценции.
* предварительно наполненный шприц.
Вспомогательные вещества: натрия ацетата тригидрат — 0.392 мг, глицин — 6.8 мг, маннитол — 20.7 мг, кислота уксусная ледяная — до pH 5.0, вода д/и — до 0.9 мл.
0.9 мл — шприцы трехкомпонентные стерильные из бесцветного стекла (1) — упаковки ячейковые контурные (2) в комплекте с салфетками спиртовыми (2 шт.) — пачки картонные.
0.9 мл — шприцы трехкомпонентные стерильные из бесцветного стекла (1) — упаковки ячейковые контурные (4) в комплекте с салфетками спиртовыми (4 шт.) — пачки картонные.
На каждый шприц наклеивают самоклеящуюся этикетку.
Фармакологическое действие
Левилимаб — рекомбинантное моноклональное антитело подкласса IgG1, высокогомологичное нативным человеческим антителам, связывающееся с α-субъединицей рецептора к интерлейкину-6 (ИЛ-6). Молекула левилимаба содержит вариабельные фрагменты легких и тяжелых цепей глубокой оптимизации и константные домены с полностью человеческой последовательностью. Левилимаб связывается и блокирует как растворимые (рИЛР), так и мембранные рецепторы ИЛ-6 (мИЛ6Р). Блокада обеих форм рецептора позволяет предотвратить реализацию ИЛ-6-ассоциированного провоспалительного каскада, препятствует активации антиген-представляющих клеток, В- и Т-лимфоцитов, моноцитов и макрофагов, эндотелиальных клеток и фибробластов, и избыточной продукции других провоспалительных цитокинов. ИЛ-6 является ключевым элементом синдрома массивного высвобождения цитокинов (синдрома «цитокинового шторма», гемофагоцитарного лимфогистиоцитоза или синдрома активации макрофагов), который может привести к острому респираторному дистресс-синдрому, полиорганной недостаточности и являться причиной летального исхода. Массивное высвобождение цитокинов («цитокиновый шторм») наблюдается у пациентов, получающих иммуносупрессивную терапию, включая деплецирующие агенты (в частности моноклональные антитела к рецепторам Т- и В-лимфоцитов), а также при тяжелых инфекционных заболеваниях, в т.ч. у пациентов с COVID-19. Высокий уровень ИЛ-6 в крови ассоциирован с более тяжелым течением новой коронавирусной инфекции и выраженными изменениями легких, что обусловливает потребность в интенсивной терапии и увеличивает риск летального исхода при COVID-19. ИЛ-6 – единственный цитокин, непосредственно индуцирующий синтез острофазовых белков в гепатоцитах: С-реактивного белка (СРБ), фибриногена, сывороточного амилоидного белка А-SAA, гепсидина, лептина. Кроме того, ИЛ-6 участвует в активации и поддержании местных воспалительных реакций (образование паннуса в синовии, стимуляция остеокластогенеза — эрозии хрящевой ткани, остеопороз), что наблюдается в патогенезе ревматоидного артрита.
Специфическая противовоспалительная активность левилимаба продемонстрирована в тестах in vitro и in vivo. Левилимаб оказывает антипролиферативное действие на культуру клеток DS-1, вызывая дозозависимое ингибирование роста клеток. На модели коллаген-индуцированного артрита у яванских макак (Macaca fascicularis) многократное (1 раз в неделю в течение 7 недель) п/к введение левилимаба сопровождается снижением выраженности воспалительной реакции в суставах, что подтверждено при гистологическом исследовании (значимое снижение выраженности воспалительных и дегенеративных изменений хрящевой ткани).
Изменение параметров фармакодинамических маркеров (нарастание концентрации рИЛ6Р, насыщение мИЛ6Р, нарастание концентрации ИЛ-6) свидетельствует о высокоэффективной дозозависимой нейтрализации препаратом левилимаб обеих форм рецептора ИЛ-6, что в свою очередь сопровождается быстрым и выраженным снижением сывороточной концентрации СРБ, отражающим эффективное подавление воспалительного процесса. В клинических исследованиях левилимаба продемонстрировано блокирование до 90% мембранных рецепторов к ИЛ-6 в течение первых 2 часов от момента однократного п/к введения препарата в дозе 1.6 мг/кг и более.
Фармакокинетика
Всасывание и распределение
При однократном п/к введении левилимаба наблюдается дозозависимый рост его концентрации в сыворотке крови. После введения препарат начинает обнаруживаться в сыворотке крови пациентов через 2-12 ч, и его концентрация нарастает, достигая максимальных значений через 96 [72-168] ч. Дозы препарата, превышающие 2.0 мг/кг, продемонстрировали двухфазный характер увеличения концентрации: первый пик наблюдался в период 48-72 ч, второй – к 168 ч с последующим снижением до неопределяемых значений к 70 дню.
После однократного п/к введения препарата в дозе 162 мг Cmax левилимаба в сыворотке крови составляла 17543 [10975; 28323] нг/мл, а значения показателя AUC, рассчитанного в период 0-168 ч (AUC0-168) – 1866231 [1297632-3719014] нг/мл×ч.
При многократном введении левилимаба пациентам с ревматоидным артритом значения суммарной AUC, рассчитанной в период 0-2016 ч после введения (AUC0-2016), составили 189580779 [134794695; 230680771] нг/мл×ч при введении 1 раз в неделю и 50763951 [34465213.5; 65810194.5] нг/мл×ч при введении 1 раз в 2 недели. Показатель Сmax-mult при повторных введениях нарастал и достигал значений 201024 [151563-246408] нг/мл при еженедельном введении препарата и 51570 [37201-71740] нг/мл при введении 1 раз в 2 недели. При этом Tmax составляло 1848 [1512; 2016] ч при еженедельном введении препарата и 1848 [1512; 1848] ч при введении 1 раз в 2 недели соответственно. Стационарный Vd составил 7871.029 [4226.795; 13363.547] мл при введении препарата 1 раз в неделю и 7130.453 [5532.978; 11387.959] мл при введении 1 раз в 2 недели.
При повторных введениях отмечается накопление препарата, с ростом Cmax в 6.5-14.2 раза при еженедельном введении и в 1.9-4.2 раза при введении препарата 1 раз в 2 недели. Коэффициент кумуляции (AR) составил 10.932 [6.446; 14.178] для еженедельного введения препарата и 2.593 [1.902; 4.164] для введения 1 раз в 2 недели.
Таким образом, у пациентов с ревматоидным артритом многократное п/к введение левилимаба 1 раз в неделю обеспечивает более высокую сывороточную концентрацию и экспозицию по сравнению с введением 1 раз в 2 недели.
Выведение
Общий клиренс (Cl) левилимаба после однократного введения в дозе 2.2 мг/кг составил 35.288±11.7 мл/ч, а в дозе 2.9 мг/кг показатель Cl – 25.974±1.1 мл/ч. T1/2 однократной п/к дозы 2.9 мг/кг составил 133.683 [92.754; 197.197] ч. Значения показателей, характеризующих период элиминации, обладают дозозависимостью (показатели среднего времени пребывания препарата в организме (MRT) и T1/2 нарастают с увеличением введенной дозы, а Cl – снижается), что говорит о нелинейной фармакокинетике препарата, обусловленной мишень-опосредованными распределением и элиминацией.
Фармакокинетика у особых групп пациентов
Пациенты с почечной и печеночной недостаточностью: специальных исследований у данной категории пациентов не проводилось; фармакокинетические данные у больных с почечной и печеночной недостаточностью отсутствуют.
Пациенты в возрасте старше 65 лет: фармакокинетические данные у лиц в возрасте старше 65 лет отсутствуют.
Показания препарата
Илсира®
Новая коронавирусная инфекция (COVID-19)
- патогенетическая терапия синдрома высвобождения цитокинов при тяжелом течении новой коронавирусной инфекции (COVID-19).
Ревматоидный артрит
- ревматоидный артрит умеренной или высокой степени активности у взрослых с отсутствием адекватного ответа на терапию одним или несколькими болезнь-модифицирующими противоревматическими препаратами, в т.ч. для торможения рентгенологической прогрессии. Левилимаб применяется в комбинированной терапии с метотрексатом и/или другими синтетическими базисными противовоспалительными препаратами.
Режим дозирования
Для п/к введения.
Препарат Илсира® предназначен для введения как в амбулаторно-поликлинических, так и в стационарных условиях.
Применение левилимаба должно осуществляться под контролем врача. В случае длительного применения препарата, в частности для терапии ревматоидного артрита, если врач считает это возможным, после соответствующего обучения технике п/к инъекций пациенты могут самостоятельно вводить себе препарат.
Препарат Илсира® вводят п/к с помощью преднаполненного шприца в область передней брюшной стенки (отступая не менее 5 см от пупка), передней и боковой поверхности бедра или средней трети наружной части плеча.
Не следует вводить препарат в места с поврежденной или измененной кожей (с наличием уплотнений, покраснений, новообразований, гиперпигментаций или повышенной чувствительности).
С целью патогенетической терапии синдрома высвобождения цитокинов при тяжелом течении новой коронавирусной инфекции (COVID-19) рекомендуемая доза препарата Илсира® составляет 324 мг однократно в виде двух п/к инъекций по 162 мг каждая. В случае недостаточного эффекта первой дозы левилимаба возможно повторное введение препарата через 48–96 ч в дозе 324 мг в виде двух п/к инъекций по 162 мг каждая. Решение о необходимости повторного введения принимается исключительно врачом.
Для терапии ревматоидного артрита рекомендуемая доза препарата Илсира® составляет 162 мг п/к 1 раз в неделю.
При достижении ремиссии заболевания возможно применение в режиме 162 мг п/к 1 раз в 2 недели. Пациентам, не достигшим ремиссии, рекомендовано продолжить применение препарата в дозе 162 мг п/к 1 раз в неделю. Пациентам, имеющим нарастание активности заболевания после снижения кратности введений, рекомендовано возобновить применение препарата в дозе 162 мг п/к 1 раз в неделю.
При развитии нежелательных явлений в ходе терапии ревматоидного артрита, связанных с изменением лабораторных показателей, следует провести коррекцию дозы и режима введения в соответствии с рекомендациями в таблицах 1, 2 и 3.
Таблица 1. Рекомендации по коррекции дозы при повышении активности печеночных ферментов АЛТ или АСТ
Таблица 2. Рекомендации по коррекции дозы при снижении абсолютного числа нейтрофилов (АЧН)
Таблица 3. Рекомендации по коррекции дозы при снижении количества тромбоцитов
Пропуск дозы при терапии ревматоидного артрита
При пропуске очередного введения по любой причине инъекция препарата Илсира® должна быть произведена как можно быстрее. Новый отсчет для даты следующего введения начинают с момента фактически проведенной инъекции препарата Илсира®.
Указания по применению
Подготовка к проведению п/к инъекции
- Тщательно вымойте руки.
- Извлеките упаковку со шприцем из холодильника. Затем извлеките шприц с лекарственным препаратом из картонной пачки. Осмотрите шприц, а также лекарственный препарат, находящийся в нем. Нельзя использовать шприц в случае:
- помутнения раствора, наличия в препарате посторонних видимых частиц;
- изменения цвета;
- повреждения любых частей шприца;
- истечения срока годности (годен до …), указанного на картонной пачке, а также на этикетке шприца.
- Оставьте шприц при комнатной температуре приблизительно на 25-30 мин. Не следует согревать шприц с препаратом каким-либо другим способом.
- Подготовьте спиртовую салфетку/ватный тампон.
На данном этапе не следует снимать колпачок шприца.
Техника выполнения п/к инъекции препарата Илсира® в преднаполненном шприце
1. Выберите место инъекции (передняя брюшная стенка (отступая не менее 5 см от пупка), передняя и боковая поверхность бедра или средняя треть наружной части плеча (возможные места для инъекций закрашены на рисунке ниже)).
2. Нельзя вводить препарат в место на коже, где имеется болезненность, покраснение, уплотнение или кровоподтек. Эти признаки могут указывать на наличие инфекции. Также не следует вводить препарат в места родинок, гиперпигментаций и шрамов.
3. Место укола необходимо обработать спиртовой салфеткой круговыми движениями.
4. Шприц не встряхивать.
5. Снимите колпачок с иглы, не дотрагиваясь до иглы и избегая прикосновения к другим поверхностям.
6. Одной рукой возьмите в складку обработанную кожу.
7. В другую руку возьмите шприц, держа его градуированной поверхностью вверх. Введение препарата необходимо осуществлять под углом 45 или 90 градусов к поверхности кожи в зависимости от толщины кожи и выраженности подкожно-жирового слоя (у худощавых пациентов введение препарата осуществляется под углом 45 градусов, у пациентов с толщиной кожной складки более 1.5 см допустимо введение под углом 90 градусов).
8. Одним быстрым движением полностью введите иглу в кожную складку.
9. После введения иглы отпустите складку кожи.
10. Введите весь раствор медленным постоянным надавливанием на поршень шприца в течение 2-5 сек.
11. Когда шприц будет пустым, выньте иглу из кожи под тем же углом.
12. Кусочком марли слегка прижмите область инъекции в течение 10 сек, но ни в коем случае не трите поверхность. Из места инъекции может выделиться небольшое количество крови. При желании можно воспользоваться пластырем.
13. После инъекции шприц повторно не использовать.
14. Вторую инъекцию препарата Илсира® для достижения общей дозы 324 мг выполнить аналогичным образом.
15. При последующих инъекциях следует менять место введения.
Утилизация расходного материала
Неиспользованный раствор препарата, использованные шприцы, салфетки/ватные тампоны и другие расходные материалы подлежат утилизации с применением закрывающегося контейнера, устойчивого к проколам для острых предметов из пластика или стекла.
Не допускать хранения использованных шприцев в местах, доступных для детей.
Побочное действие
В рамках проведенных клинических исследований у здоровых добровольцев, пациентов с ревматоидным артритом и тяжелым течением новой коронавирусной инфекции (COVID-19) препарат Илсира® показал благоприятный профиль безопасности. Наиболее частыми нежелательными реакциями в проведенных клинических исследованиях были повышение активности АЛТ и АСТ, нейтропения и повышение уровня липидов в крови. Спектр зарегистрированных нежелательных явлений, связанных с применением препарата Илсира®, был ожидаемым для класса ингибиторов рецепторов ИЛ-6. Летальных исходов, связанных с терапией препаратом Илсира®, в ходе клинических исследований не было.
В данной инструкции нежелательные реакции представлены в соответствии с международным словарем нежелательных реакций MedDRA. Ниже приведен перечень нежелательных реакций, зарегистрированных у пациентов, получавших левилимаб в рамках клинических исследований, и имеющих определенную, вероятную или возможную степень связи с приемом препарата. Частота указана с учетом следующих критериев: очень часто (≥1/10), часто (от ≥1/100 до <1/10), нечасто (от ≥1/1000 до <1/100), редко (от ≥1/10000 до <1/1000), очень редко (≤10000).
* В клинических исследованиях регистрировались местные реакции в виде эритемы и кожного зуда.
** Данное НР проявлялось повышением АСТ и АЛТ и не сопровождалось другими симптомами токсического гепатита на фоне множественной лекарственной терапии.
Также в ходе клинической разработки регистрировались единичные нежелательные явления, для которых в настоящее время связь с применением левилимаба не установлена достоверно: воспаление очага кожного поражения, астения, анемия, лимфаденит, лимфоцитоз, отклонение от нормы процедуры визуализации легких, снижение активности АСТ.
В качестве нарушений со стороны иммунной системы в пострегистрационном периоде наблюдались единичные реакции гиперчувствительности (анафилактический шок, ангиоотек), что согласуется с известным профилем безопасности препаратов класса ингибиторов рецепторов ИЛ-6.
Противопоказания к применению
- гиперчувствительность к левилимабу, а также к любому из вспомогательных веществ препарата;
- клинически значимые активные инфекции, включая туберкулез;
- сепсис, обусловленный патогенами, отличными от COVID-19;
- вирусный гепатит В;
- нейтропения менее 0.5×109/л;
- тромбоцитопения менее 50×109/л;
- повышение активности АСТ или АЛТ более чем в 5 раз;
- печеночная недостаточность тяжелой степени (класс С по классификации Чайлд-Пью);
- почечная недостаточность тяжелой степени и в терминальной стадии (СКФ менее 30 мл/мин);
- детский и подростковый возраст до 18 лет;
- беременность;
- период грудного вскармливания;
- комбинированное применение с ингибиторами ФНОα или применение в течение 1 месяца после терапии моноклональными антителами к ФНОα.
С осторожностью
Следует соблюдать осторожность при назначении левилимаба следующим категориям пациентов:
- с хроническими и рецидивирующими инфекциями или с указаниями в анамнезе на них;
- с сопутствующими заболеваниями, предрасполагающими к развитию инфекций;
- в периоде ранней реконвалесценции после тяжелых и среднетяжелых инфекционных заболеваний;
- после недавно проведенной вакцинации живыми аттенуированными вакцинами;
- с печеночной недостаточностью легкой и средней степени тяжести (класс А и В по классификации Чайлд-Пью);
- с почечной недостаточностью средней степени тяжести (СКФ <60 мл/мин и ≥30 мл/мин);
- с дивертикулитом, дивертикулезом и язвенным поражением органов ЖКТ, в т.ч. в анамнезе, в связи с риском перфорации ЖКТ;
- с демиелинизирующими заболеваниями;
- у получающих иммуносупрессивную терапию после трансплантации органов.
В связи со способностью левилимаба подавлять реакции острой фазы воспаления следует проявлять особую осторожность в отношении раннего выявления инфекционных заболеваний на фоне терапии.
В связи с ограниченными данными клинических исследований о применении левилимаба у пациентов пожилого возраста следует соблюдать осторожность при назначении препарата пациентам этой возрастной группы.
Применение при беременности и кормлении грудью
Беременность
Исследований влияния на плод у беременных женщин не проводилось. Известно, что моноклональные антитела могут проникать через плацентарный барьер. Препарат Илсира® противопоказан к применению во время беременности. Женщины детородного возраста и их половые партнеры должны использовать эффективные средства контрацепции в период проведения терапии левилимабом.
Период грудного вскармливания
Неизвестно, проникает ли левилимаб в грудное молоко. Учитывая то, что иммуноглобулины класса G, к которым относится левилимаб, могут выделяться с грудным молоком, препарат Илсира® противопоказан к применению в период грудного вскармливания.
Фертильность
Данные о влиянии препарата на фертильность у людей отсутствуют.
Применение при нарушениях функции печени
Противопоказано применение препарата при печеночной недостаточности тяжелой степени (класс С по классификации Чайлд-Пью).
С осторожностью следует назначать препарат пациентам с печеночной недостаточностью легкой и средней степени тяжести (класс А и В по классификации Чайлд-Пью).
Применение при нарушениях функции почек
Противопоказано применение препарата при почечной недостаточности тяжелой степени и в терминальной стадии (СКФ менее 30 мл/мин).
С осторожностью следует назначать препарат пациентам с почечной недостаточностью средней степени тяжести (СКФ <60 мл/мин и ≥30 мл/мин).
Применение у детей
Противопоказано применение препарата в детском и подростковом возрасте до 18 лет.
Применение у пожилых пациентов
Следует соблюдать осторожность при назначении препарата пациентам пожилого возраста.
Особые указания
Прослеживаемость
В целях улучшения прослеживаемости биотехнологических лекарственных препаратов наименование и номер серии назначаемого лекарственного препарата левилимаб должны указываться в медицинской документации пациента.
Инфекции
Наличие таких потенциально тяжелых инфекций как ВИЧ, активный гепатит В, сифилис, туберкулез, относится к противопоказаниям для назначения левилимаба. Левилимаб не следует применять у пациентов с активным течением инфекционных заболеваний, включая локализованные инфекции. Учитывая иммуносупрессивное действие левилимаба, терапия этим препаратом потенциально может приводить к обострению хронических инфекций и повышению риска первичного инфицирования.
При реактивации гепатита В или развитии серьезных инфекций терапию левилимабом следует прекратить и назначить соответствующую этиотропную терапию.
Соблюдение осторожности требуется в отношении пациентов с рецидивирующими инфекционными заболеваниями в анамнезе, а также лиц, имеющих факторы риска развития инфекций в виде сопутствующих заболеваний или сопутствующей терапии.
С учетом подавления левилимабом реакций острой фазы воспаления симптомы инфекционного заболевания могут быть стерты, что следует учитывать при раннем выявлении серьезных инфекций у пациентов, получающих препарат Илсира®. При появлении любых симптомов, свидетельствующих о развитии инфекционного заболевания на фоне применения левилимаба, пациенту следует немедленно обратиться к врачу для своевременной диагностики и назначения терапии.
Туберкулез
Пациентам с активным туберкулезом терапия препаратом Илсира® противопоказана. Перед назначением препарата Илсира® и в ходе терапии необходимо проводить стандартный скрининг на туберкулез. Пациентам с латентным туберкулезом рекомендуется пройти стандартный курс противотуберкулезной терапии перед началом терапии препаратом Илсира®.
Лабораторные показатели
Нейтропения. В клинических исследованиях препарата Илсира® отмечалось снижение числа нейтрофилов. При длительной терапии пациентов с ревматоидным артритом снижение АЧН не сопровождалось более высокой частотой развития инфекций, в т.ч. серьезных. Следует соблюдать осторожность при лечении препаратом Илсира® пациентов с АЧН <2×109/л. При снижении АЧН <0.5×109/л терапию препаратом Илсира® следует отменить. Следует оценивать число нейтрофилов через 4-8 недель после начала терапии, а в дальнейшем в соответствии с клинической практикой.
Тромбоцитопения. В клинических исследованиях препарата Илсира® отмечалось снижение числа тромбоцитов. При длительной терапии пациентов с ревматоидным артритом снижение числа тромбоцитов не сопровождалось развитием кровотечений. Следует соблюдать осторожность при назначении терапии препаратом Илсира® при числе тромбоцитов ниже 100×103/мкл. Лечение не рекомендуется при числе тромбоцитов <50×103/мкл. Следует оценивать число тромбоцитов через 4-8 недель после начала терапии, а в дальнейшем в соответствии с клинической практикой.
Ферменты печени. В клинических исследованиях препарата Илсира® отмечалось повышение активности печеночных трансаминаз без признаков печеночной недостаточности. Частота возникновения подобных изменений может возрастать при совместном использовании с препаратами, обладающими потенциальным гепатотоксическим действием (например, метотрексатом, антибактериальными препаратами и другими). Следует соблюдать осторожность при назначении терапии препаратом Илсира® у пациентов с показателями АЛТ или АСТ, превышающими ВГН более чем в 1.5 раза. Следует оценивать показатели активности печеночных трансаминаз (АЛТ и АСТ) через 4-8 недель после начала терапии, а в дальнейшем в соответствии с клинической практикой.
Изменение показателей липидного обмена. В клинических исследованиях препарата Илсира® отмечалось повышение концентрации липидов (холестерин общий и/или ТГ). Следует оценивать показатели липидного обмена через 4-8 недель после начала терапии левилимабом, а в дальнейшем в соответствии с клинической практикой. При ведении пациентов с гиперлипидемией следует учитывать национальные рекомендации.
Реакции гиперчувствительности
При использовании левилимаба потенциально возможно развитие реакции гиперчувствительности. В рамках проведенных клинических исследований левилимаба реакций гиперчувствительности не зарегистрировано. В ходе пострегистрационного периода оценки препарата Илсира® описаны единичные случаи анафилактических реакций и реакций гиперчувствительности. При возникновении анафилактических или других серьезных аллергических реакций применение препарата Илсира® следует немедленно прекратить и начать соответствующую симптоматическую терапию.
Злокачественные новообразования
У пациентов с РА наблюдается повышенный риск злокачественных новообразований, который может усугубляться при длительном применении иммуносупрессивных лекарственных средств. Объем клинических данных по препаратам класса ингибиторов рецептора ИЛ-6 в целом и левилимабу в частности недостаточен для установления частоты развития злокачественных образований и подтверждение наличия причинно-следственной связи с терапией. Продолжается изучение безопасности левилимаба в ходе долгосрочного применения.
Наличие алкогольной или наркотической зависимости
Наличие алкогольной или наркотической зависимости, а также психических расстройств может стать причиной несоблюдения пациентом графика лечения левилимабом, что, в свою очередь может привести к снижению эффективности терапии. Необходимо более тщательное наблюдение за пациентами с указанными состояниями в связи с отсутствием результатов клинических исследований у данной категории пациентов и возможностью повышенного риска развития гепатотоксичности и других неблагоприятных последствий.
Иммуногенность
В ходе клинических исследований препарата Илсира®, в т.ч. при долгосрочном (в течение года) лечении ревматоидного артрита, выработки связывающих антител к левилимабу выявлено не было.
Пациенты в возрасте старше 65 лет
Данные об эффективности и безопасности препарата у пациентов в возрасте старше 65 лет ограничены. Не предполагается наличия существенных возрастных различий в распределении и выведении препарата.
Пациенты с нарушениями функции почек и печени
Эффективность и безопасность препарата у данной категории пациентов не изучались.
Использование в педиатрии
Исследование эффективности и безопасности препарата у детей и подростков в возрасте до 18 лет не проводилось.
Вакцинация
Не следует проводить иммунизацию живыми аттенуированными вакцинами в ходе лечения препаратом Илсира®, т.к. клиническая оценка безопасности данного взаимодействия в рамках клинических исследований не проводилась. Вакцинация живыми аттенуированными вакцинами до начала терапии препаратом Илсира®, а также интервал между вакцинацией и началом терапии должны соответствовать действующим клиническим рекомендациям.
Демиелинизирующие заболевания
С учетом данных по профилю безопасности препаратов класса ингибиторов рецепторов ИЛ-6 следует соблюдать осторожность при применении левилимаба у пациентов с демиелинизирующими заболеваниями. Необходимо тщательно контролировать появление симптомов, указывающих на развитие демиелинизирующего заболевания ЦНС, несмотря на то, что способность левилимаба вызывать демиелинизирующие заболевания ЦНС в настоящее время не установлена.
Влияние на способность к управлению транспортными средствами и механизмами
Отсутствуют данные о влиянии препарата Илсира® на способность управлять транспортными средствами и работать с машинами и/или механизмами. Учитывая то, что при терапии другими ингибиторами рецептора ИЛ-6 отмечались эпизоды головокружения, пациентам, испытывающим головокружение при применении препарата Илсира®, не рекомендуется управлять транспортными средствами и механизмами до тех пор, пока головокружение не прекратится.
Передозировка
Клинические данные о передозировке препарата Илсира® отсутствуют. Максимальная переносимая доза левилимаба для человека не установлена. В клинических исследованиях при п/к введении левилимаба в максимальной суточной дозе 324 мг двукратно с интервалом 48-96 ч новых нежелательных реакций, изменяющих представление о профиле безопасности препарата, не зарегистрировано.
Лечение: специфический антидот отсутствует. Проводят симптоматическую терапию.
Лекарственное взаимодействие
Сведений о наличии неблагоприятного лекарственного взаимодействия левилимаба с другими лекарственными препаратами до настоящего времени не получено.
Смешивание препарата с другими лекарственными средствами строго запрещено.
Условия хранения препарата Илсира®
Препарат следует хранить в защищенном от света, недоступном для детей месте при температуре от 2° до 8°С; не замораживать.
Срок годности препарата Илсира®
Срок годности — 3 года. Не применять по истечении срока годности.
Условия реализации
Препарат отпускают по рецепту.
БИОКАД АО
(Россия)
|
198515 Санкт-Петербург, |
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Илсира — инструкция по применению
Синонимы, аналоги
Статьи
Данный лекарственный препарат зарегистрирован по процедуре регистрации препаратов, предназначенных для применения в условиях угрозы возникновения, возникновения и ликвидации чрезвычайных ситуаций. Инструкция подготовлена на основании ограниченного объема клинических данных по применению препарата и будет дополняться по мере поступления новых данных. Применение препарата возможно только в условиях стационарной медицинской помощи.
Регистрационный номер:
ЛП-006244
Торговое наименование:
ИЛСИРА®
Международное непатентованное или группировочное наименование:
левилимаб
Лекарственная форма:
раствор для подкожного введения
Состав
| Ингредиент: | В 1,0 мл | В предварительно наполненном шприце 0,9 мл |
| Действующее вещество: | ||
| Левилимаб | 180,0 мг | 162,0 мг |
| Вспомогательные вещества: | ||
| Натрия ацетата тригидрат | 0,436 мг | 0,392 мг |
| Глицин | 7,5 мг | 6,8 мг |
| Маннитол | 23,0 мг | 20,7 мг |
| Уксусная кислота ледяная | до pH 5,0 | до pH 5,0 |
| Вода для инъекций | до 1,0 мл | до 0,9 мл |
Описание
Прозрачный, желто-коричневого цвета раствор. Возможно наличие лёгкой опалесценции.
Фармакотерапевтическая группа
Иммунодепрессанты, ингибиторы интерлейкина.
Код по ATX:
L04AC
Фармакологические свойства
Фармакодинамика
Левилимаб – рекомбинантное человеческое моноклональное антитело к рецептору интерлейкина-6 (ИЛ-6). Левилимаб связывается и блокирует как растворимые (рИЛР), так и мембранные рецепторы ИЛ-6 (мИЛ6Р). Блокада обеих форм рецептора позволяет предотвратить развитие ИЛ-6-ассоциированного провоспалительного каскада, в том числе препятствует активации антигенпрезентирующих клеток, В- и Т-лимфоцитов, моноцитов и макрофагов, эндотелиальных клеток и фибробластов, и избыточной продукции других провоспалительных цитокинов. ИЛ-6 участвует в активации и поддержании местных воспалительных реакций (образование паннуса в синовии, стимуляция остеокластогенеза – эрозии хрящевой ткани, остеопороз), кроме того ИЛ-6 – единственный цитокин, непосредственно индуцирующий синтез острофазовых белков в гепатоцитах: СРБ, фибриногена, сывороточного амилоидного белка А – SAA, гипсидина, лептина.
Специфическая противовоспалительная активность левилимаба продемонстрирована в тестах in vitro и in vivo. Левилимаб оказывает антипролиферативное действие на культуру клеток DS-1, вызывая дозозависимое ингибирование роста клеток. На модели коллаген-индуцированного артрита у яванских макак (Масаса fascicularis) многократное (один раз в неделю в течение 7-ми недель) подкожное введение левилимаба сопровождается снижением выраженности воспалительной реакции в суставах, что подтверждено при гистологическом исследовании (значимое снижение выраженности воспалительных и дегенеративных изменений хрящевой ткани). Кроме того ИЛ-6 является ключевым цитокином в развитии массивного высвобождения цитокинов («цитокинового шторма») у пациентов, получающих иммуносупрессивную терапию включая деплецирующие агенты (в частности моноклональные антитела к рецепторам Т- и В-лимфоцитов), а также в формировании острого респираторного дистресс-синдрома при тяжелых инфекционных заболеваниях, в том числе у пациентов с COVID-19.
Динамика фармакодинамических маркеров (нарастание концентрации рИЛ6Р, насыщение мИЛ6Р, нарастание ИЛ-6 и снижение концентрации СРБ) свидетельствует о высокоэффективной нейтрализации рецепторов ИЛ-6 препаратом левилимаб, что в свою очередь проявляется быстрым и выраженным снижением сывороточной концентрации СРБ, отражающим эффективное подавление воспалительного процесса у пациентов с активным ревматоидным артритом.
Фармакокинетика
Всасывание/распределение
При однократном подкожном введении левилимаба пациентам с ревматоидным артритом, препарат обнаруживается в сыворотке крови пациентов в течение 2-24 часов, и его концентрация нарастает, достигая максимальных значений через 96 часов, с последующим снижением. Максимальная концентрация левилимаба в сыворотке крови (Сmax) после первого введения при еженедельном ведении и введении 1 раз в 2 недели значимо не различалась и составляла 17543 [10975; 28323] нг/мл и 21168,5 [11248; 28338] нг/мл.
После первого введения левилимаба пациентам значения AUC(0-168) составляли 1866231 [1297632-3719014] (нг/мл)·ч, для группы пациентов с еженедельным введением препарата и 2152996,5 [1323711-3081436] (нг/мл)·ч, для группы с введением препарата 1 раз в 2 недели. При многократном введении левилимаба значения суммарной площади под кривой концентрация – время рассчитанной в период 0-2016 ч после введения (AUC (0-2016)) составили 189580779 [134794695; 230680771] (нг/мл)·ч при введении 1 раз в неделю и 50763951 [34465213,5; 65810194,5] (нг/мл)·ч при введении 1 раз в 2 недели.
При повторных введениях левилимаба пациентам с ревматоидным артритом, показатель максимальной концентрации (Cmax-mult) нарастал и достигал значений 201024 [151563-246408] нг/мл при еженедельном введении препарата и 51570 [37201-71740] нг/мл при введении 1 раз в 2 недели. При этом время достижения максимальной концентрации (Тmax) составляло 1848 [1512; 2016] часов и 1848 [1512; 1848] часов при еженедельном введении препарата и введении 1 раз в 2 недели соответственно.
Стационарный объем распределения составляя 7871,029 [4226,795; 13363,547] мл при введении препарата 1 раз в неделю и 7130,453 [5532,978; 11387,959] мл при введении 1 раз в 2 недели.
О накоплении препарата при многократном введении свидетельствовал коэффициент кумуляции (AR), который составлял 10,932 [6,446; 14,178] для еженедельного введения препарата, 2,593 [1,902; 4,164] для введения 1 раз в 2 недели.
При повторных введениях отмечается накопление препарата, с ростом максимальной концентрации в 6,5-14,2 раза при еженедельном введении и в 1,9-4,2 раза при выведении препарат 1 раз в 2 недели. Таким образом, подкожное введение левилимаба 1 раз в неделю обеспечивает более высокую сывороточную концентрацию и экспозицию у пациентов с активным ревматоидным артритом.
Выведение
Значения показателей, характеризующих период элиминации (Kel, С1 и период полувыведения препарата), зависели от дозы левилимаба, что говорит о нелинейной фармакокинетике препарата, обусловленной мишень-опосредованными распределением и элиминацией. Общий клиренс левилимаба после однократного введения в дозе 2,2 мг/кг составлял 35,288 мл/час.
Пациенты с почечной и печеночной недостаточностью: фармакокинетические данные у больных с почечной и печеночной недостаточностью отсутствуют.
Пациенты в возрасте старше 65 лет: фармакокинетические данные у лиц в возрасте старше 65 лет отсутствуют.
Показания к применению
Угрожающий жизни острый респираторный дистресс-синдром, сопровождающийся повышенным высвобождением цитокинов.
Противопоказания
- Гиперчувствительность к левилимабу, а также к любому из вспомогательных веществ препарата.
- Клинически значимые бактериальные инфекции в острой фазе, включая туберкулез.
- Детский и подростковый возраст до 18 лет.
- Беременность, грудное вскармливание.
- Печеночная недостаточность тяжелой степени тяжести (класс С по классификации Чайлд-Пью. Почечная недостаточность тяжелой и терминальной степени тяжести (СКФ <30 мл/мин).
С осторожностью
Следует соблюдать осторожность при назначении левилимаба пациентам с хроническими и рецидивирующими инфекциями или с анамнестическими указаниями на них; сопутствующими заболеваниями, предрасполагающими к развитию инфекций; в периоде ранней реконвалесценции после тяжелых и среднетяжелых инфекционных заболеваний; после недавно проведенной вакцинации живыми вакцинами; при назначении пациентам с печеночной недостаточностью легкой и средней степени тяжести (класс А и В по классификации Чайлд-Пью), пациентам с почечной недостаточностью средней степени тяжести (СКФ <60 мл/мин и ≥30 мл/мин). В связи со способностью левилимаба подавлять реакции острой фазы воспаления следует проявлять особую осторожность с целю раннего выявления инфекционных заболеваний на фоне терапии.
В связи с ограниченными данными клинических исследований о применении левилимаба у пациентов пожилого возраста следует соблюдать осторожность при назначении препарата пациентам этой возрастной группы.
Применение при беременности и в период грудного вскармливания
Применение при беременности
Исследований влияния на плод у беременных женщин не проводилось. Известно, что моноклональные антитела могут проникать через плацентарный барьер. Препарат ИЛСИРА® противопоказан к применению во время беременности. Женщины детородного возраста и их половые партнеры должны использовать эффективные средства контрацепции в период проведения терапии левилимабом.
Применение в период грудного вскармливания
Неизвестно, проникает ли левилимаб в грудное молоко. Учитывая то, что иммуноглобулины класса G, к которым относится левилимаб, могут выделяться с грудным молоком, препарат ИЛСИРА® противопоказан к применению в период грудного вскармливания.
Влияние на фертильность
Данные о влиянии препарата на фертильность у людей отсутствуют.
Способ применения и дозы
Применение препарата ИЛСИРА® должно осуществляться под наблюдением врачей. Рекомендуемая доза препарат ИЛСИРА® составляет 324 мг однократно в виде двух подкожных инъекций по 162 мг каждая.
Указания по применению
Подготовка к проведению подкожной инъекции
На данном этапе не следует снимать колпачок шприца
Техника выполнения подкожной инъекции препарата ИЛСИРА® в преднаполненном шприце
- Выберите место инъекции (передняя брюшная стенка (отступая не менее 5 см от пупка), передняя и боковая поверхность бедра или средняя треть наружной части плеча (возможные места для инъекций закрашены на рисунке ниже)).
- Места инъекций и стороны следует менять с каждой последующей процедурой инъекции.
- Нельзя вводить препарат в место на коже, где имеется болезненность, покраснение, уплотнение или кровоподтек. Эти признаки могут указывать на наличие инфекции.
- Место укола необходимо обработать спиртовой салфеткой круговыми движениями.
- Шприц не встряхивать.
- Снимите колпачок с иглы, не дотрагиваясь до иглы и избегая прикосновения к другим поверхностям;
- Одной рукой возьмите в складку обработанную кожу.
- В другую руку возьмите шприц, держа его градуированной поверхностью вверх. Введение препарата необходимо осуществлять под углом 45 или 90 градусов к поверхности кожи в зависимости от толщины кожи и выраженности подкожно-жирового слоя (у худощавых пациентов введение препарата осуществляется под углом 45 градусов, у пациентов с толщиной кожной складки более 1,5 см допустимо введение под углом 90 градусов).
- Одним быстрым движением полностью введите иглу в кожную складку.
- После введения иглы отпустите складку кожи.
- Введите весь раствор медленным постоянным надавливанием на поршень шприца в течение 2-5 секунд.
- Когда шприц будет пустым, выньте иглу из кожи под тем же углом.
- Кусочком марли слегка прижмите область инъекции в течение 10 секунд, но ни в коем случае не трите поверхность. Из места инъекции может выделиться небольшое количество крови. При желании можно воспользоваться пластырем.
- После инъекции шприц повторно не использовать.
Утилизация расходного материала
Неиспользованный раствор препарата, использованные шприцы, салфетки/ватные тампоны и другие расходные материалы подлежат утилизации с применением закрывающегося, устойчивого к проколам контейнера для острых предметов из пластика или стекла. Не допускайте хранения использованных шприцев в местах, доступных для детей.
Побочное действие
В рамках проведенных клинических исследований у пациентов с ревматоидным артритом препарат ИЛСИРА® показал благоприятный профиль безопасности. Наиболее частыми нежелательными реакциями в проведенных клинических исследованиях были нейтропения, повышение активности АЛТ и повышение уровня холестерина крови. Спектр зарегистрированных нежелательных явлений, связанных с применением препарата ИЛСИРА®, был ожидаемым для класса ингибиторов ИЛ6Р. Летальных исходов, связанных с терапией препаратом ИЛСИРА®, в ходе клинических исследований не было.
В данной инструкции нежелательные реакции представлены в соответствии с международным словарем нежелательных реакций MedDRA. Ниже приведен перечень нежелательных реакций, зарегистрированных у пациентов, получавших левилимаб в рамках клинических исследований, и имеющих определенную, вероятную или возможную степень связи с приемом препарата. Частота указана с учетом следующих критериев: очень часто (≥1/10), часто (от ≥1/100 до <1/10), нечасто (от ≥1/1000 до <1/100), редко (от ≥1/10000 до <1/1000), очень редко (≤10000).
| Системно-органный класс | Частота | Наименование реакции |
| Инфекции и инвазии | Нечасто | вирусные инфекции верхних дыхательных путей, пневмония, обострение хронического тонзиллита, латентный туберкулез. |
| Нарушения со стороны крови и лимфатической системы | Очень часто | нейтропения |
| Часто | лейкопения, лимфопения | |
| Нечасто | тромбоцитопения | |
| Нарушения со стороны сосудов | Нечасто | повышение артериального давления |
| Общие нарушения и реакции в месте введения | Часто | реакции в месте введения* |
| Лабораторные и инструментальные данные | Часто | повышение активности аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (ACT), повышение уровня холестерина и триглицеридов крови, повышение уровня билирубина крови, положительный результат анализа высвобождения интерферона гамма с антигеном Mycobacterium tuberculosis, положительный результат внутрикожного диагностического теста на туберкулез. |
| *В клинических исследованиях регистрировались местные реакции в виде эритемы и кожного зуда. |
Также в ходе клинической разработки регистрировались единичные нежелательные явления, для которых в настоящее время связь с применением левилимаба не установлена достоверно: воспаление очага кожного поражения, анемия, лимфаденит, лимфоцитоз, повышение уровня глюкозы крови, отклонение от нормы процедуры визуализации легких.
Передозировка
Клинические данные о передозировке отсутствуют. Максимальная переносимая доза для человека не установлена. В клинических исследованиях при подкожном введении левилимаба в максимальной дозе 2,9 мг/кг (около 217 мг при массе тела 75 килограммов) явлений дозолимитирующей токсичности не зарегистрировано.
Специфический антидот отсутствует. Лечение симптоматическое.
Взаимодействие с другими лекарственными препаратами
Сведений о наличии неблагоприятных лекарственных взаимодействий левилимаба с другими лекарственными препаратами до настоящего времени не получено.
Смешивание препарата с другими лекарственными средствами строго запрещено.
Особые указания
Применение препарата возможно только в условиях стационарной медицинской помощи.
При развитии побочного действия необходимо сообщать об этом в установленном порядке для осуществления мероприятии по фармаконадзору. До начала приема препарата ИЛСИРА® необходимо предоставить письменную информацию пациенту об эффективности препарата и рисках, связанных с его применением (в том числе о риске влияния на эмбрион и плод) и получить письменное согласие на применение препарата.
Серьезные инфекции
Наличие таких потенциально тяжелых инфекций как ВИЧ, активный гепатит В и (или) С, сифилис, туберкулез, относится к противопоказаниям для назначения левилимаба. Левилимаб не следует применять у пациентов с активным течением инфекционных заболеваний, включая локализованные инфекции. Учитывая иммуносупрессивное действие левилимаба, терапия этим препаратом потенциально может приводить к обострению хронических инфекций и повышению риска первичного инфицирования.
При реактивации гепатита В терапия левилимабом должна быть прекращена и назначена соответствующая противовирусная терапия.
Туберкулез
Пациентам с активным туберкулезом терапия препаратом ИЛСИРА® противопоказана. Перед назначением препарата ИЛСИРА® и в ходе терапии необходимо проводить стандартный скрининг на туберкулез. Пациентам с латентным туберкулезом рекомендуется пройти стандартный курс противотуберкулезной терапии перед началом терапии препаратом ИЛСИРА®.
Лабораторные показатели
Нейтропения
В клинических исследованиях препарата ИЛСИРА® отмечалось снижении числа нейтрофилов. Снижение абсолютного числа нейтрофилов (АЧН) не сопровождалось более высокой частотой развития инфекций, в том числе серьезных. Следует соблюдать осторожность при лечении препаратом ИЛСИРА® пациентов с АЧН <2×109/л. При снижении АЧН <0,5×109/л терапию препаратом ИЛСИРА® следует отменить. Следует оценивать число нейтрофилов через 4-8 недель после начала терапии, а в дальнейшем в соответствии с клинической практикой.
Тромбоцитопения
В клинических исследованиях препарата ИЛСИРА® отмечалось снижении числа тромбоцитов. Снижение числа тромбоцитов не сопровождалось развитием кровотечений. Следует соблюдать осторожность при назначении терапии препаратом ИЛСИРА® при числе тромбоцитов ниже 100×103/мкл. Лечение не рекомендуется при числе тромбоцитов <50×103/мкл. Следует оценивать число тромбоцитов через 4-8 недель после начала терапии, а в дальнейшем в соответствии с клинической практикой.
Ферменты печени
В клинических исследованиях препарата ИЛСИРА® отмечалось повышение активности «печеночных» трансаминаз без признаков печеночной недостаточности. Частота возникновения подобных изменений может возрастать при совместном использовании с препаратами, обладающими потенциальным гепатотоксическим действием (например, метотрексатом). Следует соблюдать осторожность при назначении терапии препаратом ИЛСИРА® у пациентов с показателями аланинаминотрансферазы (АЛТ) или аспартатаминотрансферазы (ACT), превышающими верхнюю границу нормы (ВГН) более чем в 1,5 раза. Следует оценивать показатели активности печеночных трансаминаз (АЛТ и ACT) через 4-8 недель после начала терапии, а в дальнейшем в соответствии с клинической практикой.
Изменение показателей липидного обмена
В клинических исследованиях препарата ИЛСИРА® отмечалось повышение концентрации липидов (холестерин и(или) триглицериды). Следует оценивать показатели липидного обмена через 4-8 недель после начала терапии, а в дальнейшем в соответствии с клинической практикой. При ведении пациентов с гиперлипидемией следует руководствоваться национальными рекомендациями по лечению гиперлипидемии.
Реакции гиперчувствительности
При использовании левилимаба потенциально возможно развитие реакции гиперчувствительности. В рамках проведенных клинических исследований препарата ИЛСИРА® анафилактических реакций и реакций гиперчувствительности не зарегистрировано. Однако при использовании других ингибиторов ИЛ6Р регистрировались крапивница и другие реакции гиперчувствительности, в том числе анафилаксия. При возникновении анафилактических или других серьёзных аллергических реакций применение препарата ИЛСИРА® следует немедленно прекратить и начать соответствующую симптоматическую терапию.
Наличие алкогольной или наркотической зависимости
Наличие алкогольной или наркотической зависимости, а также психических расстройств может стать причиной несоблюдения пациентом графика лечения левилимабом, что, в свою очередь может привести к снижению эффективности терапии. Необходим более тщательное наблюдение за пациентами с указанными состояниями в связи с отсутствием результатов клинических исследований у данной категории пациентов и возможностью повышенного риска развития гепатотоксичности и других неблагоприятных последствий.
Иммуногенность
В ходе клинических исследований препарата ИЛСИРА® при лечении ревматоидного артрита выработки связывающих антител к левилимабу выявлено не было.
Пациенты в возрасте старше 65 лет
Данные об эффективности и безопасности препарата у пациентов в возрасте старше 65 лет ограничены. Не предполагается наличия существенных возрастных различий в распределении и выведении препарата.
Пациенты с нарушениями функции почек и печени
Эффективность и безопасность препарата у данной категории пациентов не изучались.
Пациенты моложе 18 лет, дети
Исследование эффективности и безопасности препарата у детей и лиц моложе 18 лет не проводилось.
Вакцинация
Не следует проводить иммунизацию живыми вакцинами в ходе лечения препаратом ИЛСИРА®, так как клиническая оценка безопасности данного взаимодействия в рамках клинических исследований не проводилась. Вакцинация живыми вакцинами до начала терапии препаратом ИЛСИРА®, а также интервал между вакцинацией и началом терапии должны соответствовать действующим клиническим рекомендациям.
Влияние на способность управлять транспортными средствами и механизмами
Отсутствуют данные о влиянии препарата ИЛСИРА® на способность управлять транспортными средствами и работать с машинами и (или) механизмами. Учитывая то, что при терапии другими ингибиторами рецептора ИЛ-6 отмечались эпизоды головокружения, пациентам, испытывающим головокружение при применении препарата ИЛСИРА®, рекомендуется не управлять транспортными средствами и механизмами до тех пор, пока головокружение не прекратится.
Форма выпуска
Раствор для подкожного введения 180 мг/мл.
По 0,9 мл в трехкомпонентные стерильные шприцы из бесцветного нейтрального стекла I гидролитического класса. Шприц, с одной стороны, имеет впаянную иглу для инъекций из нержавеющей стали, которая защищена пластмассовым колпачком с бутил каучуковым уплотнителем. Шприц укупорен эластичным уплотнителем на поршень и поршнем.
На каждый шприц наклеивают самоклеящуюся этикетку.
По 1 шприцу помещают в контурную ячейковую упаковку из пленки ПВХ.
По 2 и 4 контурных ячейковых упаковок вместе с инструкцией по применению помещают в пачку из картона.
Пачку дополнительно комплектуют спиртовыми салфетками в количестве 2 или 4 шт.
Условия хранения
При температуре от 2 до 8 °С в защищенном от света месте. Не замораживать!
Хранить в недоступном для детей месте.
Срок годности
2 года.
Не применять по истечении срока годности.
Условия отпуска
Отпускают по рецепту.
Владелец регистрационного удостоверения
ЗАО «БИОКАД», Россия, 198515, г. Санкт-Петербург, Петродворцовый р-н, п. Стрельна, ул. Связи, д. 34, лит. А.
Производитель
ЗАО «БИОКАД», Россия, 198515, г. Санкт-Петербург, п. Стрельна, ул. Связи, д. 38, стр. 1.
Организация, принимающая претензии потребителей
ЗАО «БИОКАД», Россия, 198515, г. Санкт-Петербург, Петродворцовый р-н, п. Стрельна, ул. Связи, д. 34, лит. А.
Купить Илсира в megapteka.ru
*Цены в Москве. Точная цена в Вашем городе будет указана на сайте аптеки.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Инструкция по применению Илсира 180 мг/мл 0,9 мл 2 шт. раствор для инъекций
Форма выпуска, упаковка и состав
Раствор для п/к введения прозрачный, желто-коричневого цвета; возможно наличие легкой опалесценции.
1 мл |
1 шприц* (0.9 мл) |
|
левилимаб |
180 мг |
162 мг |
* предварительно наполненный шприц.
Вспомогательные вещества: натрия ацетата тригидрат — 0.392 мг, глицин — 6.8 мг, маннитол — 20.7 мг, кислота уксусная ледяная — до pH 5.0, вода д/и — до 0.9 мл.
0.9 мл — шприцы трехкомпонентные из бесцветного стекла (1) — упаковки ячейковые контурные (2) в комплекте с салфетками спиртовыми (2 шт.) — пачки картонные.
0.9 мл — шприцы трехкомпонентные из бесцветного стекла (1) — упаковки ячейковые контурные (4) в комплекте с салфетками спиртовыми (4 шт.) — пачки картонные.
На каждый шприц наклеивают самоклеящуюся этикетку.
Фармакологическое действие
Левилимаб — рекомбинантное моноклональное антитело подкласса IgG1, высокогомологичное нативным человеческим антителам, связывающееся с α-субъединицей рецептора к интерлейкину-6 (ИЛ-6). Молекула левилимаба содержит вариабельные фрагменты легких и тяжелых цепей глубокой оптимизации и константные домены с полностью человеческой последовательностью. Левилимаб связывается и блокирует как растворимые (рИЛ6Р), так и мембранные рецепторы ИЛ-6 (мИЛ6Р). Блокада обеих форм рецептора позволяет предотвратить реализацию ИЛ-6-ассоциированного провоспалительного каскада, препятствует активации антиген-представляющих клеток, В- и Т-лимфоцитов, моноцитов и макрофагов, эндотелиальных клеток и фибробластов, и избыточной продукции других провоспалительных цитокинов. ИЛ-6 является ключевым элементом синдрома массивного высвобождения цитокинов (синдрома «цитокинового шторма», гемофагоцитарного лимфогистиоцитоза или синдрома активации макрофагов), который может привести к острому респираторному дистресс-синдрому, полиорганной недостаточности и являться причиной летального исхода. Массивное высвобождение цитокинов («цитокиновый шторм») наблюдается у пациентов, получающих иммуносупрессивную терапию, включая деплецирующие агенты (в частности моноклональные антитела к рецепторам Т- и В-лимфоцитов), а также при тяжелых инфекционных заболеваниях, в т.ч. у пациентов с COVID-19. Высокий уровень ИЛ-6 в крови ассоциирован с более тяжелым течением новой коронавирусной инфекции и выраженными изменениями легких, что обусловливает потребность в интенсивной терапии и увеличивает риск летального исхода при COVID-19. ИЛ-6 – единственный цитокин, непосредственно индуцирующий синтез острофазовых белков в гепатоцитах: С-реактивного белка (СРБ), фибриногена, сывороточного амилоидного белка А-SAA, гепсидина, лептина. Кроме того, ИЛ-6 участвует в активации и поддержании местных воспалительных реакций (образование паннуса в синовии, стимуляция остеокластогенеза — эрозии хрящевой ткани, остеопороз), что наблюдается в патогенезе ревматоидного артрита.
Специфическая противовоспалительная активность левилимаба продемонстрирована в тестах in vitro и in vivo. Левилимаб оказывает антипролиферативное действие на культуру клеток DS-1, вызывая дозозависимое ингибирование роста клеток. На модели коллаген-индуцированного артрита у яванских макак (Macaca fascicularis) многократное (1 раз в неделю в течение 7 недель) п/к введение левилимаба сопровождается снижением выраженности воспалительной реакции в суставах, что подтверждено при гистологическом исследовании (значимое снижение выраженности воспалительных и дегенеративных изменений хрящевой ткани).
Изменение параметров фармакодинамических маркеров (нарастание концентрации рИЛ6Р, насыщение мИЛ6Р, нарастание концентрации ИЛ-6) свидетельствует о высокоэффективной дозозависимой нейтрализации препаратом левилимаб обеих форм рецептора ИЛ-6, что в свою очередь сопровождается быстрым и выраженным снижением сывороточной концентрации СРБ, отражающим эффективное подавление воспалительного процесса. В клинических исследованиях левилимаба продемонстрировано блокирование до 90% мембранных рецепторов к ИЛ-6 в течение первых 2 часов от момента однократного п/к введения препарата в дозе 1.6 мг/кг и более.
Фармакокинетика
Всасывание и распределение
При однократном п/к введении левилимаба наблюдается дозозависимый рост его концентрации в сыворотке крови. После введения препарат начинает обнаруживаться в сыворотке крови пациентов через 2-12 ч, и его концентрация нарастает, достигая максимальных значений через 96 [72-168] ч. Дозы препарата, превышающие 2.0 мг/кг, продемонстрировали двухфазный характер увеличения концентрации: первый пик наблюдался в период 48-72 ч, второй – к 168 ч с последующим снижением до неопределяемых значений к 70 дню.
После однократного п/к введения препарата в дозе 162 мг Cmax левилимаба в сыворотке крови составляла 17543 [10975; 28323] нг/мл, а значения показателя AUC, рассчитанного в период 0-168 ч (AUC0-168) – 1866231 [1297632-3719014] нг/мл×ч.
При многократном введении левилимаба пациентам с ревматоидным артритом значения суммарной AUC, рассчитанной в период 0-2016 ч после введения (AUC0-2016), составили 189580779 [134794695; 230680771] нг/мл×ч при введении 1 раз в неделю и 50763951 [34465213.5; 65810194.5] нг/мл×ч при введении 1 раз в 2 недели. Показатель Сmax-mult при повторных введениях нарастал и достигал значений 201024 [151563-246408] нг/мл при еженедельном введении препарата и 51570 [37201-71740] нг/мл при введении 1 раз в 2 недели. При этом Tmax составляло 1848 [1512; 2016] ч при еженедельном введении препарата и 1848 [1512; 1848] ч при введении 1 раз в 2 недели соответственно. Стационарный Vd составил 7871.029 [4226.795; 13363.547] мл при введении препарата 1 раз в неделю и 7130.453 [5532.978; 11387.959] мл при введении 1 раз в 2 недели.
При повторных введениях отмечается накопление препарата, с ростом Cmax в 6.5-14.2 раза при еженедельном введении и в 1.9-4.2 раза при введении препарата 1 раз в 2 недели. Коэффициент кумуляции (AR) составил 10.932 [6.446; 14.178] для еженедельного введения препарата и 2.593 [1.902; 4.164] для введения 1 раз в 2 недели.
Таким образом, у пациентов с ревматоидным артритом многократное п/к введение левилимаба 1 раз в неделю обеспечивает более высокую сывороточную концентрацию и экспозицию по сравнению с введением 1 раз в 2 недели.
Выведение
Общий клиренс (Cl) левилимаба после однократного введения в дозе 2.2 мг/кг составил 35.288±11.7 мл/ч, а в дозе 2.9 мг/кг показатель Cl – 25.974±1.1 мл/ч. T1/2 однократной п/к дозы 2.9 мг/кг составил 133.683 [92.754; 197.197] ч. Значения показателей, характеризующих период элиминации, обладают дозозависимостью (показатели среднего времени пребывания препарата в организме (MRT) и T1/2 нарастают с увеличением введенной дозы, а Cl – снижается), что говорит о нелинейной фармакокинетике препарата, обусловленной мишень-опосредованными распределением и элиминацией.
Фармакокинетика у особых групп пациентов
Пациенты с почечной и печеночной недостаточностью: специальных исследований у данной категории пациентов не проводилось; фармакокинетические данные у больных с почечной и печеночной недостаточностью отсутствуют.
Пациенты в возрасте старше 65 лет: фармакокинетические данные у лиц в возрасте старше 65 лет отсутствуют.
Показания препарата
Новая коронавирусная инфекция (COVID-19)
патогенетическая терапия синдрома высвобождения цитокинов при тяжелом течении новой коронавирусной инфекции (CОVID-19).
Ревматоидный артрит
ревматоидный артрит умеренной или высокой степени активности у взрослых с отсутствием адекватного ответа на терапию одним или несколькими болезнь-модифицирующими противоревматическими препаратами, в т.ч. для торможения рентгенологической прогрессии. Левилимаб применяется в комбинированной терапии с метотрексатом и/или другими синтетическими базисными противовоспалительными препаратами.
Режим дозирования
Для п/к введения.
Препарат Илсира® предназначен для введения как в амбулаторно-поликлинических, так и в стационарных условиях.
Применение левилимаба должно осуществляться под контролем врача. В случае длительного применения препарата, в частности для терапии ревматоидного артрита, если врач считает это возможным, после соответствующего обучения технике п/к инъекций пациенты могут самостоятельно вводить себе препарат.
Препарат Илсира® вводят п/к с помощью преднаполненного шприца в область передней брюшной стенки (отступая не менее 5 см от пупка), передней и боковой поверхности бедра или средней трети наружной части плеча.
Не следует вводить препарат в места с поврежденной или измененной кожей (с наличием уплотнений, покраснений, новообразований, гиперпигментаций или повышенной чувствительности).
С целью патогенетической терапии синдрома высвобождения цитокинов при тяжелом течении новой коронавирусной инфекции (CОVID-19) рекомендуемая доза препарата Илсира® составляет 324 мг однократно в виде двух п/к инъекций по 162 мг каждая. В случае недостаточного эффекта первой дозы левилимаба возможно повторное введение препарата через 48–96 ч в дозе 324 мг в виде двух п/к инъекций по 162 мг каждая. Решение о необходимости повторного введения принимается исключительно врачом.
Для терапии ревматоидного артрита рекомендуемая доза препарата Илсира® составляет 162 мг 1 раз в неделю.
При достижении ремиссии заболевания возможно применение в режиме 162 мг п/к 1 раз в 2 недели. Пациентам, не достигшим ремиссии, рекомендовано продолжить применение препарата в дозе 162 мг п/к 1 раз в неделю. Пациентам, имеющим нарастание активности заболевания после снижения кратности введений, рекомендовано возобновить применение препарата в дозе 162 мг п/к 1 раз в неделю.
При развитии нежелательных явлений в ходе терапии ревматоидного артрита, связанных с изменением лабораторных показателей, следует провести коррекцию дозы и режима введения в соответствии с рекомендациями в таблицах 1, 2 и 3.
Таблица 1. Рекомендации по коррекции дозы при повышении активности печеночных ферментов АЛТ или АСТ
Значение показателя АЛТ или АСТ |
Рекомендации |
Превышение ВГН в 1-3 раза |
При необходимости провести коррекцию дозы одновременно принимаемых препаратов, обладающих гепатотоксическим эффектом (базисных противовоспалительных препаратов, антибактериальных средств, иммуномодулирующих препаратов). При устойчивом повышении активности трансаминаз в данном диапазоне снизить частоту инъекций препарата Илсира® до 1 раза в 2 недели или прервать терапию препаратом Илсира® до нормализации показателей АЛТ и АСТ. Возобновить терапию препаратом в дозе 162 мг с частотой введения 1 раз в 2 недели или 1 раз в неделю в соответствии с клинической необходимостью. |
Превышение ВГН в 3-5 раз |
Следует отменить лечение препаратом Илсира® до снижения уровня показателя менее чем в 3 раза превышающего ВГН. Далее следовать вышеуказанным рекомендациям для превышения ВГН в 1-3 раза. При сохранении уровня показателя более чем в 3 раза превышающего ВГН, отменить терапию препаратом Илсира®. |
Превышение более чем в 5 раз |
Следует прекратить лечение препаратом Илсира®. |
Таблица 2. Рекомендации по коррекции дозы при снижении абсолютного числа нейтрофилов (АЧН)
Значение показателя (число клеток × 109/л) |
Рекомендации |
АЧН >1 |
Дозу препарата Илсира® оставить без изменений. |
АЧН 0.5–1 |
Следует прервать лечение препаратом Илсира®. При повышении АЧН до 1×109/л и выше рассмотреть возобновление терапии препаратом в рекомендуемой дозе в соответствии с клинической необходимостью. |
АЧН <0.5 |
Следует прекратить лечение препаратом Илсира®. |
Таблица 3. Рекомендации по коррекции дозы при снижении количества тромбоцитов
Значение показателя (число клеток × 109/л) |
Рекомендации |
50-100 |
Следует прервать лечение препаратом Илсира®. При увеличении количества тромбоцитов до 100×109/л и выше рассмотреть возобновление терапии препаратом Илсира® в дозе 162 мг с частотой введения 1 раз в 2 недели и увеличить частоту введений до 1 раза в неделю в соответствии с клинической необходимостью. |
<50 |
Следует прекратить лечение препаратом Илсира®. |
Пропуск дозы при терапии ревматоидного артрита
При пропуске очередного введения по любой причине инъекция препарата Илсира® должна быть произведена как можно быстрее. Новый отсчет для даты следующего введения начинают с момента фактически проведенной инъекции препарата Илсира®.
Указания по применению
Подготовка к проведению п/к инъекции
Тщательно вымойте руки.
Извлеките упаковку со шприцем из холодильника. Затем извлеките шприц с лекарственным препаратом из картонной пачки. Осмотрите шприц, а также лекарственный препарат, находящийся в нем. Нельзя использовать шприц в случае:
помутнения раствора, наличия в препарате посторонних видимых частиц;
изменения цвета;
повреждения любых частей шприца;
истечения срока годности (годен до …), указанного на картонной пачке, а также на этикетке шприца.
Оставьте шприц при комнатной температуре приблизительно на 25-30 мин. Не следует согревать шприц с препаратом каким-либо другим способом.
Подготовьте спиртовую салфетку/ватный тампон.
На данном этапе не следует снимать колпачок шприца.
Техника выполнения п/к инъекции препарата Илсира® в преднаполненном шприце
1. Выберите место инъекции (передняя брюшная стенка (отступая не менее 5 см от пупка), передняя и боковая поверхность бедра или средняя треть наружной части плеча (возможные места для инъекций закрашены на рисунке ниже)).
2. Нельзя вводить препарат в место на коже, где имеется болезненность, покраснение, уплотнение или кровоподтек. Эти признаки могут указывать на наличие инфекции. Также не следует вводить препарат в места родинок, гиперпигментаций и шрамов.
3. Место укола необходимо обработать спиртовой салфеткой круговыми движениями.
4. Шприц не встряхивать.
5. Снимите колпачок с иглы, не дотрагиваясь до иглы и избегая прикосновения к другим поверхностям.
6. Одной рукой возьмите в складку обработанную кожу.
7. В другую руку возьмите шприц, держа его градуированной поверхностью вверх. Введение препарата необходимо осуществлять под углом 45 или 90 градусов к поверхности кожи в зависимости от толщины кожи и выраженности подкожно-жирового слоя (у худощавых пациентов введение препарата осуществляется под углом 45 градусов, у пациентов с толщиной кожной складки более 1.5 см допустимо введение под углом 90 градусов).
8. Одним быстрым движением полностью введите иглу в кожную складку.
9. После введения иглы отпустите складку кожи.
10. Введите весь раствор медленным постоянным надавливанием на поршень шприца в течение 2-5 сек.
11. Когда шприц будет пустым, выньте иглу из кожи под тем же углом.
12. Кусочком марли слегка прижмите область инъекции в течение 10 сек, но ни в коем случае не трите поверхность. Из места инъекции может выделиться небольшое количество крови. При желании можно воспользоваться пластырем.
13. После инъекции шприц повторно не использовать.
14. Вторую инъекцию препарата Илсира® для достижения общей дозы 324 мг выполнить аналогичным образом.
15. При последующих инъекциях следует менять место введения.
Утилизация расходного материала
Неиспользованный раствор препарата, использованные шприцы, салфетки/ватные тампоны и другие расходные материалы подлежат утилизации с применением закрывающегося контейнера, устойчивого к проколам для острых предметов из пластика или стекла.
Не допускать хранения использованных шприцев в местах, доступных для детей.
Побочное действие
В рамках проведенных клинических исследований у здоровых добровольцев, пациентов с ревматоидным артритом и тяжелым течением новой коронавирусной инфекции (COVID-19) препарат Илсира® показал благоприятный профиль безопасности. Наиболее частыми нежелательными реакциями в проведенных клинических исследованиях были повышение активности АЛТ и АСТ, нейтропения и повышение уровня липидов в крови. Спектр зарегистрированных нежелательных явлений, связанных с применением препарата Илсира®, был ожидаемым для класса ингибиторов рецепторов ИЛ-6. Летальных исходов, связанных с терапией препаратом Илсира®, в ходе клинических исследований не было.
В данной инструкции нежелательные реакции представлены в соответствии с международным словарем нежелательных реакций MedDRA. Ниже приведен перечень нежелательных реакций, зарегистрированных у пациентов, получавших левилимаб в рамках клинических исследований, и имеющих определенную, вероятную или возможную степень связи с приемом препарата. Частота указана с учетом следующих критериев: очень часто (≥1/10), часто (от ≥1/100 до <1/10), нечасто (от ≥1/1000 до <1/100), редко (от ≥1/10000 до <1/1000), очень редко (≤10000).
Частота |
Наименование реакции |
Инфекции и инвазии |
|
Нечасто |
Инфекции верхних дыхательных путей, пневмония, латентный туберкулез, туберкулез легких, опоясывающий герпес (Herpes Zoster) |
Со стороны крови и лимфатической системы |
|
Часто |
Нейтропения, лейкопения, лимфопения |
Нечасто |
Тромбоцитопения |
Общие нарушения и реакции в месте введения |
|
Часто |
Реакции в месте введения* |
Нечасто |
Гиперчувствительность в месте инъекции |
Со стороны печени и желчевыводящих путей |
|
Нечасто |
Токсический гепатит** |
Со стороны кожи и подкожной клетчатки |
|
Нечасто |
Крапивница |
Со стороны сосудов |
|
Часто |
Повышение АД, в т.ч. изолированное повышение систолического и диастолического АД |
Лабораторные и инструментальные данные |
|
Очень часто |
Повышение активности АЛТ, АСТ |
Часто |
Повышение концентрации холестерина и ТГ крови, повышение содержания билирубина крови, положительный результат исследования высвобождения интерферона гамма |
Нечасто |
Положительный результат внутрикожного диагностического теста на туберкулез, увеличение массы тела, повышение уровня глюкозы крови |
* В клинических исследованиях регистрировались местные реакции в виде эритемы и кожного зуда.
** Данное НР проявлялось повышением АСТ и АЛТ и не сопровождалось другими симптомами токсического гепатита на фоне множественной лекарственной терапии.
Также в ходе клинической разработки регистрировались единичные нежелательные явления, для которых в настоящее время связь с применением левилимаба не установлена достоверно: воспаление очага кожного поражения, астения, анемия, лимфаденит, лимфоцитоз, отклонение от нормы процедуры визуализации легких, снижение активности АСТ.
В качестве нарушений со стороны иммунной системы в пострегистрационном периоде наблюдались единичные реакции гиперчувствительности (анафилактический шок, ангиоотек), что согласуется с известным профилем безопасности препаратов класса ингибиторов рецепторов ИЛ-6.
Противопоказания к применению
гиперчувствительность к левилимабу, а также к любому из вспомогательных веществ препарата;
клинически значимые активные инфекции, включая туберкулез;
сепсис, обусловленный патогенами, отличными от COVID-19;
вирусный гепатит В;
нейтропения менее 0.5×109/л;
тромбоцитопения менее 50×109/л;
повышение активности АСТ или АЛТ более чем в 5 раз;
печеночная недостаточность тяжелой степени (класс С по классификации Чайлд-Пью);
почечная недостаточность тяжелой степени и в терминальной стадии (СКФ менее 30 мл/мин);
детский и подростковый возраст до 18 лет;
беременность;
период грудного вскармливания;
комбинированное применение с ингибиторами ФНОα или применение в течение 1 месяца после терапии моноклональными антителами к ФНОα.
С осторожностью
Следует соблюдать осторожность при назначении левилимаба следующим категориям пациентов:
с хроническими и рецидивирующими инфекциями или с указаниями в анамнезе на них;
с сопутствующими заболеваниями, предрасполагающими к развитию инфекций;
в периоде ранней реконвалесценции после тяжелых и среднетяжелых инфекционных заболеваний;
после недавно проведенной вакцинации живыми аттенуированными вакцинами;
с печеночной недостаточностью легкой и средней степени тяжести (класс А и В по классификации Чайлд-Пью);
с почечной недостаточностью средней степени тяжести (СКФ <60 мл/мин и ≥30 мл/мин);
с дивертикулитом, дивертикулезом и язвенным поражением органов ЖКТ, в т.ч. в анамнезе, в связи с риском перфорации ЖКТ;
с демиелинизирующими заболеваниями;
у получающих иммуносупрессивную терапию после трансплантации органов.
В связи со способностью левилимаба подавлять реакции острой фазы воспаления следует проявлять особую осторожность в отношении раннего выявления инфекционных заболеваний на фоне терапии.
В связи с ограниченными данными клинических исследований о применении левилимаба у пациентов пожилого возраста следует соблюдать осторожность при назначении препарата пациентам этой возрастной группы.
Применение при беременности и кормлении грудью
Беременность
Исследований влияния на плод у беременных женщин не проводилось. Известно, что моноклональные антитела могут проникать через плацентарный барьер. Препарат Илсира® противопоказан к применению во время беременности. Женщины детородного возраста и их половые партнеры должны использовать эффективные средства контрацепции в период проведения терапии левилимабом.
Период грудного вскармливания
Неизвестно, проникает ли левилимаб в грудное молоко. Учитывая то, что иммуноглобулины класса G, к которым относится левилимаб, могут выделяться с грудным молоком, препарат Илсира® противопоказан к применению в период грудного вскармливания.
Фертильность
Данные о влиянии препарата на фертильность у людей отсутствуют.
Применение при нарушениях функции печени
Противопоказано применение препарата при печеночной недостаточности тяжелой степени (класс С по классификации Чайлд-Пью).
С осторожностью следует назначать препарат пациентам с печеночной недостаточностью легкой и средней степени тяжести (класс А и В по классификации Чайлд-Пью).
Применение при нарушениях функции почек
Противопоказано применение препарата при почечной недостаточности тяжелой степени и в терминальной стадии (СКФ менее 30 мл/мин).
С осторожностью следует назначать препарат пациентам с почечной недостаточностью средней степени тяжести (СКФ <60 мл/мин и ≥30 мл/мин).
Применение у детей
Противопоказано применение препарата в детском и подростковом возрасте до 18 лет.
Применение у пожилых пациентов
Следует соблюдать осторожность при назначении препарата пациентам пожилого возраста.
Особые указания
Прослеживаемость
В целях улучшения прослеживаемости биотехнологических лекарственных препаратов наименование и номер серии назначаемого лекарственного препарата левилимаб должны указываться в медицинской документации пациента.
Инфекции
Наличие таких потенциально тяжелых инфекций как ВИЧ, активный гепатит В, сифилис, туберкулез, относится к противопоказаниям для назначения левилимаба. Левилимаб не следует применять у пациентов с активным течением инфекционных заболеваний, включая локализованные инфекции. Учитывая иммуносупрессивное действие левилимаба, терапия этим препаратом потенциально может приводить к обострению хронических инфекций и повышению риска первичного инфицирования.
При реактивации гепатита В или развитии серьезных инфекций терапию левилимабом следует прекратить и назначить соответствующую этиотропную терапию.
Соблюдение осторожности требуется в отношении пациентов с рецидивирующими инфекционными заболеваниями в анамнезе, а также лиц, имеющих факторы риска развития инфекций в виде сопутствующих заболеваний или сопутствующей терапии.
С учетом подавления левилимабом реакций острой фазы воспаления симптомы инфекционного заболевания могут быть стерты, что следует учитывать при раннем выявлении серьезных инфекций у пациентов, получающих препарат Илсира®. При появлении любых симптомов, свидетельствующих о развитии инфекционного заболевания на фоне применения левилимаба, пациенту следует немедленно обратиться к врачу для своевременной диагностики и назначения терапии.
Туберкулез
Пациентам с активным туберкулезом терапия препаратом Илсира® противопоказана. Перед назначением препарата Илсира® и в ходе терапии необходимо проводить стандартный скрининг на туберкулез. Пациентам с латентным туберкулезом рекомендуется пройти стандартный курс противотуберкулезной терапии перед началом терапии препаратом Илсира®.
Лабораторные показатели
Нейтропения. В клинических исследованиях препарата Илсира® отмечалось снижение числа нейтрофилов. При длительной терапии пациентов с ревматоидным артритом снижение АЧН не сопровождалось более высокой частотой развития инфекций, в т.ч. серьезных. Следует соблюдать осторожность при лечении препаратом Илсира® пациентов с АЧН <2×109/л. При снижении АЧН <0.5×109/л терапию препаратом Илсира® следует отменить. Следует оценивать число нейтрофилов через 4-8 недель после начала терапии, а в дальнейшем в соответствии с клинической практикой.
Тромбоцитопения. В клинических исследованиях препарата Илсира® отмечалось снижение числа тромбоцитов. При длительной терапии пациентов с ревматоидным артритом снижение числа тромбоцитов не сопровождалось развитием кровотечений. Следует соблюдать осторожность при назначении терапии препаратом Илсира® при числе тромбоцитов ниже 100×103/мкл. Лечение не рекомендуется при числе тромбоцитов <50×103/мкл. Следует оценивать число тромбоцитов через 4-8 недель после начала терапии, а в дальнейшем в соответствии с клинической практикой.
Ферменты печени. В клинических исследованиях препарата Илсира® отмечалось повышение активности печеночных трансаминаз без признаков печеночной недостаточности. Частота возникновения подобных изменений может возрастать при совместном использовании с препаратами, обладающими потенциальным гепатотоксическим действием (например, метотрексатом, антибактериальными препаратами и другими). Следует соблюдать осторожность при назначении терапии препаратом Илсира® у пациентов с показателями АЛТ или АСТ, превышающими ВГН более чем в 1.5 раза. Следует оценивать показатели активности печеночных трансаминаз (АЛТ и АСТ) через 4-8 недель после начала терапии, а в дальнейшем в соответствии с клинической практикой.
Изменение показателей липидного обмена. В клинических исследованиях препарата Илсира® отмечалось повышение концентрации липидов (холестерин общий и/или ТГ). Следует оценивать показатели липидного обмена через 4-8 недель после начала терапии левилимабом, а в дальнейшем в соответствии с клинической практикой. При ведении пациентов с гиперлипидемией следует учитывать национальные рекомендации.
Реакции гиперчувствительности
При использовании левилимаба потенциально возможно развитие реакции гиперчувствительности. В рамках проведенных клинических исследований левилимаба реакций гиперчувствительности не зарегистрировано. В ходе пострегистрационного периода оценки препарата Илсира® описаны единичные случаи анафилактических реакций и реакций гиперчувствительности. При возникновении анафилактических или других серьезных аллергических реакций применение препарата Илсира® следует немедленно прекратить и начать соответствующую симптоматическую терапию.
Злокачественные новообразования
У пациентов с РА наблюдается повышенный риск злокачественных новообразований, который может усугубляться при длительном применении иммуносупрессивных лекарственных средств. Объем клинических данных по препаратам класса ингибиторов рецептора ИЛ-6 в целом и левилимабу в частности недостаточен для установления частоты развития злокачественных образований и подтверждение наличия причинно-следственной связи с терапией. Продолжается изучение безопасности левилимаба в ходе долгосрочного применения.
Наличие алкогольной или наркотической зависимости
Наличие алкогольной или наркотической зависимости, а также психических расстройств может стать причиной несоблюдения пациентом графика лечения левилимабом, что, в свою очередь может привести к снижению эффективности терапии. Необходимо более тщательное наблюдение за пациентами с указанными состояниями в связи с отсутствием результатов клинических исследований у данной категории пациентов и возможностью повышенного риска развития гепатотоксичности и других неблагоприятных последствий.
Иммуногенность
В ходе клинических исследований препарата Илсира®, в т.ч. при долгосрочном (в течение года) лечении ревматоидного артрита, выработки связывающих антител к левилимабу выявлено не было.
Пациенты в возрасте старше 65 лет
Данные об эффективности и безопасности препарата у пациентов в возрасте старше 65 лет ограничены. Не предполагается наличия существенных возрастных различий в распределении и выведении препарата.
Пациенты с нарушениями функции почек и печени
Эффективность и безопасность препарата у данной категории пациентов не изучались.
Использование в педиатрии
Исследование эффективности и безопасности препарата у детей и подростков в возрасте до 18 лет не проводилось.
Вакцинация
Не следует проводить иммунизацию живыми аттенуированными вакцинами в ходе лечения препаратом Илсира®, т.к. клиническая оценка безопасности данного взаимодействия в рамках клинических исследований не проводилась. Вакцинация живыми аттенуированными вакцинами до начала терапии препаратом Илсира®, а также интервал между вакцинацией и началом терапии должны соответствовать действующим клиническим рекомендациям.
Демиелинизирующие заболевания
С учетом данных по профилю безопасности препаратов класса ингибиторов рецепторов ИЛ-6 следует соблюдать осторожность при применении левилимаба у пациентов с демиелинизирующими заболеваниями. Необходимо тщательно контролировать появление симптомов, указывающих на развитие демиелинизирующего заболевания ЦНС, несмотря на то, что способность левилимаба вызывать демиелинизирующие заболевания ЦНС в настоящее время не установлена.
Влияние на способность к управлению транспортными средствами и механизмами
Отсутствуют данные о влиянии препарата Илсира® на способность управлять транспортными средствами и работать с машинами и/или механизмами. Учитывая то, что при терапии другими ингибиторами рецептора ИЛ-6 отмечались эпизоды головокружения, пациентам, испытывающим головокружение при применении препарата Илсира®, не рекомендуется управлять транспортными средствами и механизмами до тех пор, пока головокружение не прекратится.
Передозировка
Клинические данные о передозировке препарата Илсира® отсутствуют. Максимальная переносимая доза левилимаба для человека не установлена. В клинических исследованиях при п/к введении левилимаба в максимальной суточной дозе 324 мг двукратно с интервалом 48-96 ч новых нежелательных реакций, изменяющих представление о профиле безопасности препарата, не зарегистрировано.
Лечение: специфический антидот отсутствует; проводят симптоматическую терапию.
Лекарственное взаимодействие
Сведений о наличии неблагоприятного лекарственного взаимодействия левилимаба с другими лекарственными препаратами до настоящего времени не получено.
Смешивание препарата с другими лекарственными средствами строго запрещено.
Условия хранения препарата
Препарат следует хранить в защищенном от света, недоступном для детей месте при температуре от 2° до 8°С; не замораживать.
Срок годности препарата
Срок годности — 2 года. Не применять по истечении срока годности.
Условия реализации
Препарат отпускают по рецепту.
Общая информация
Устаревшее наименование
—
Владелец
Номер регистрационного удостоверения РФ
ЛП-№(006641)-(РГ-RU)
Действующее вещество (МНН)
Форма выпуска / дозировка
Раствор для подкожного введения
Лекарственная форма ГРЛС
Раствор п/к
Состав
Препарат Илсира® содержит:
Действующим веществом является левилимаб.
Каждый шприц содержит 162 мг левилимаба в 0,9 мл раствора для подкожного введения.
1 мл раствора для подкожного введения содержит 180 мг левилимаба.
Прочими ингредиентами (вспомогательными веществами) являются натрия ацетата тригидрат, глицин, маннитол, кислота уксусная ледяная и вода для инъекций.
Препарат Илсира® содержит натрий (см. раздел «Особые указания»).
Описание препарата
Прозрачный, желто-коричневого цвета раствор. Возможно наличие легкой опалесценции.
Фармако-терапевтическая группа
Иммунодепрессанты, ингибиторы интерлейкина









