Ипигрикс® (Ipigrix) инструкция по применению
📜 Инструкция по применению Ипигрикс®
💊 Состав препарата Ипигрикс®
✅ Применение препарата Ипигрикс®
📅 Условия хранения Ипигрикс®
⏳ Срок годности Ипигрикс®
Препарат отпускается по рецепту
Температура хранения: от 2 до 25 °С
Описание лекарственного препарата
Ипигрикс®
(Ipigrix)
Основано на официальной инструкции по применению препарата, утверждено компанией-производителем
и подготовлено для печатного издания справочника Видаль 2020 года.
Дата обновления: 2019.12.10
Владелец регистрационного удостоверения:
Контакты для обращений:
ГРИНДЕКС АО
(Латвия)
Код ATX:
N07AA
(Антихолинэстеразные средства)
Лекарственные формы
|
Препарат отпускается по рецепту |
Ипигрикс® |
Раствор для внутримышечного и подкожного введения 5 мг/1 мл: амп. 10 шт. рег. №: ЛП-(004923)-(РГ-RU) |
|
Раствор для внутримышечного и подкожного введения 15 мг/1 мл: амп. 10 шт. рег. №: ЛП-(004923)-(РГ-RU) |
Форма выпуска, упаковка и состав
препарата Ипигрикс®
Раствор для в/м и п/к введения прозрачный, бесцветный.
Вспомогательные вещества: 1М раствор хлористоводородной кислоты — до рН 2.8-4.0, вода д/и — до 1 мл.
1 мл — ампулы бесцветного стекла (5) — упаковки ячейковые пластиковые (2) — пачки картонные.
Раствор для в/м и п/к введения прозрачный, бесцветный.
Вспомогательные вещества: 1М раствор хлористоводородной кислоты — до рН 2.8-4.0, вода д/и — до 1 мл.
1 мл — ампулы бесцветного стекла (5) — упаковки ячейковые пластиковые (2) — пачки картонные.
Фармакологическое действие
Ипидакрин – обратимый ингибитор холинэстеразы. Непосредственно стимулирует проведение импульсов в ЦНС и нервно-мышечных синапсах, блокируя калиевые каналы мембран. Усиливает действие на гладкую мускулатуру не только медиатора ацетилхолина, но и адреналина, серотонина, гистамина и окситоцина.
Главные фармакологические эффекты ипидакрина:
- восстановление и стимуляция нервно-мышечного проведения;
- восстановление проведения импульса в периферической нервной системе после блокады, вызванной некоторыми факторами (например, травма, воспаление, действие местных анестетиков, антибиотиков, токсинов и калия хлорида);
- усиление сократимости и тонуса гладкой мускулатуры внутренних органов;
- специфическая умеренная стимуляция ЦНС в комбинации с отдельными проявлениями седативного действия;
- улучшение памяти.
Терапевтический эффект проявляется через 15-20 мин после парентерального введения. Продолжительность действия препарата составляет 3-5 ч.
При доклиническом изучении ипидакрин не оказывал тератогенного, эмбриотоксического, мутагенного, канцерогенного и иммунотоксического действия, не влиял на эндокринную систему.
Фармакокинетика
Всасывание и распределение
После применения внутрь ипидакрин быстро всасывается из ЖКТ. Cmax в плазме после п/к или в/м введения достигается в течение 25-30 мин. Около 40-55% активного вещества связывается с белками плазмы.
Препарат проникает через ГЭБ. Ипидакрин быстро поступает в ткани, в равновесном состоянии в плазме находят только 2% препарата.
Метаболизм и выведение
Препарат метаболизируется в печени. Выведение ипидакрина осуществляется почками и через кишечник, преобладает выведение с мочой. Т1/2 ипидакрина составляет 40 мин. После парентерального введения 34.8% введенной дозы ипидакрина выводится в неизмененном виде с мочой. Это свидетельствует о быстром метаболизме препарата в организме.
Показания препарата
Ипигрикс®
- заболевания периферической нервной системы (неврит, полиневрит, полиневропатия, полирадикулопатия, миастения и миастенический синдром различной этиологии);
- заболевания ЦНС (бульбарные параличи и парезы);
- период реконвалесценции после органических поражений ЦНС, сопровождающихся двигательными нарушениями.
Режим дозирования
Препарат применяют в/м или п/к.
Дозы и продолжительность лечения определяют индивидуально в зависимости от степени тяжести заболевания.
Заболевания периферической нервной системы
При моно- и полиневропатии различного генеза: п/к и в/м 5-15 мг 1-2 раза/сут; курс 10-15 дней (в тяжелых случаях – до 30 дней); далее переходят на прием ипидакрина в таблетках.
При миастении и миастеническом синдроме: п/к и в/м 5-30 мг 1-3 раза/сут; далее переходят на прием ипидакрина в таблетках. Общий курс лечения составляет 1-2 месяца. При необходимости лечение можно повторить несколько раз с перерывом между курсами в 1-2 месяца.
Заболевания ЦНС
При бульбарных параличах и парезах: п/к и в/м 5-15 мг 1-2 раза/сут, курс 10-15 дней; далее переходят на прием ипидакрина в таблетках.
В период реабилитации при органических поражениях ЦНС: в/м 10-15 мг 1-2 раза/сут, курс до 15 дней; далее переходят на прием ипидакрина в таблетках.
Побочное действие
Обычно ипидакрин хорошо переносится. Побочные эффекты главным образом связаны со стимуляцией м-холинорецепторов.
Перечисленные ниже побочные эффекты ипидакрина классифицированы по группам систем и органов с указанием частоты встречаемости: часто (от ≥1/100 до <1/10), нечасто (от ≥1/1000 до <1/100), редко (от ≥1/10 000 до <1/1000).
Со стороны пищеварительной системы: часто — гиперсаливация, тошнота; нечасто — рвота; редко — диарея, боли в эпигастрии; частота неизвестна — диспепсия.
Со стороны нервной системы: нечасто — головокружение, головные боли, сонливость, мышечный спазм, слабость.
Со стороны сердечно-сосудистой системы: часто — сердцебиение, брадикардия.
Со стороны органа зрения: частота неизвестна — миоз.
Со стороны дыхательной системы: нечасто — увеличение бронхиальной секреции, бронхоспазм.
Со стороны костно-мышечной системы: частота неизвестна — тремор, судороги.
Со стороны кожи и подкожной клетчатки: часто — потливость; нечасто — аллергические реакции (зуд, высыпания), обычно при применении больших доз препарата.
Прочие: частота неизвестна — гипотермия, боли в грудной клетке, желтуха, повышение тонуса матки.
При появлении перечисленных побочных эффектов, а также при появлении побочного эффекта, не упомянутого в инструкции, пациенту необходимо обратиться к врачу.
Противопоказания к применению
- эпилепсия;
- экстрапирамидные нарушения с гиперкинезами;
- стенокардия;
- выраженная брадикардия;
- бронхиальная астма;
- вестибулярные нарушения;
- обострение язвы желудка или двенадцатиперстной кишки;
- механическая непроходимость кишечника или мочевыводящих путей;
- беременность;
- период грудного вскармливания;
- детский и подростковый возраст до 18 лет (отсутствуют систематизированные данные о безопасности применения);
- повышенная чувствительность к ипидакрину и/или любому из вспомогательных веществ препарата.
С осторожностью следует назначать препарат при язвенной болезни желудка и двенадцатиперстной кишки, тиреотоксикозе, заболеваниях сердечно-сосудистой системы, а также пациентам с обструктивными заболеваниями дыхательной системы в анамнезе или при острых заболеваниях дыхательных путей.
Применение при беременности и кормлении грудью
Ипидакрин усиливает тонус матки и может вызвать преждевременную родовую деятельность, поэтому препарат противопоказан во время беременности.
Применение ипидакрина в период грудного вскармливания противопоказано.
Применение при нарушениях функции почек
Противопоказано применение препарата при механической непроходимости мочевыводящих путей.
Применение у детей
Противопоказано применение препарата в детском и подростковом возрасте до 18 лет (отсутствуют систематизированные данные о безопасности применения).
Особые указания
На время лечения следует исключить алкоголь, который усиливает побочные эффекты ипидакрина.
Ипидакрин может обострить течение эпилепсии, а также усилить отрицательное воздействие алкоголя на организм.
У пациентов с депрессиями ипидакрин может усилить проявление симптомов депрессии.
В связи с возможным риском брадикардии при применении ипидакрина следует контролировать деятельность сердца.
Использование в педиатрии
Отсутствуют систематизированные данные о применении у детей.
Влияние на способность к управлению транспортными средствами и механизмами
Ипидакрин может оказывать седативное действие, поэтому пациентам, подверженным данному воздействию при применении препарата, следует соблюдать осторожность при управлении транспортными средствами и работе с механизмами.
Передозировка
Симптомы: при тяжелой передозировке возможно развитие холинергического криза (снижение аппетита, бронхоспазм, слезотечение, усиленное потоотделение, сужение зрачков, нистагм, усиленная перистальтика ЖКТ, спонтанная дефекация и мочеиспускание, рвота, желтуха, брадикардия, нарушение внутрисердечной проводимости, аритмии, артериальная гипотензия, беспокойство, тревога, возбуждение, чувство страха, атаксия, судороги, кома, нарушение речи, сонливость, общая слабость).
Лечение: проводят симптоматическую терапию, применяют м-холинолитические вещества (в т.ч. атропин, циклодол, метацин).
Лекарственное взаимодействие
Ипидакрин ослабляет угнетающее действие на нервно-мышечную передачу и проведение возбуждения по периферическим нервам местных анестетиков, аминогликозидов и калия хлорида.
Седативный эффект лекарственных средств, угнетающих ЦНС, в т.ч. этанола, а также действие других ингибиторов холинэстеразы и м-холиномиметиков под влиянием ипидакрина усиливаются.
При одновременном применении других холинергических лекарственных средств ипидакрин увеличивает риск развития холинергического криза у больных миастенией.
Бета-адреноблокаторы усиливают выраженность брадикардии, вызываемой ипидакрином.
Церебролизин потенцирует действие ипидакрина.
Этанол усиливает нежелательные побочные эффекты ипидакрина.
Ипидакрин можно применять в комбинации с ноотропными препаратами.
Условия хранения препарата Ипигрикс®
Препарат следует хранить в недоступном для детей месте при температуре не выше 25°С; не замораживать.
Срок годности препарата Ипигрикс®
Срок годности — 2 года. Не применять по истечении срока годности, указанного на упаковке.
Условия реализации
Препарат отпускается по рецепту.
ГРИНДЕКС АО
(Латвия)
|
Организация, уполномоченная принимать претензии потребителей в России: |
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Описание препарата Алфлутоп (раствор для инъекций, 0.1 мл/мл) основано на официальной инструкции, утверждено компанией-производителем в 2021 году
Дата согласования: 19.03.2021
Особые отметки:
Содержание
- Фотографии упаковок
- ATX
- Фармакологическая группа
- Состав
- Описание лекарственной формы
- Фармакологическое действие
- Фармакодинамика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Производитель
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Заказ в аптеках Москвы
Фотографии упаковок
19.03.2021
ATX
Фармакологическая группа
Состав
| Раствор для инъекций | 1 амп. (1 мл) |
| действующее вещество: | |
| биоактивный концентрат из мелких морских рыб | 0,1 мл |
| состав биоактивного концентрата: мелкая морская рыба — шпрот североморский (Sprattus sprattus sprattus), семейство сельдевых (Clupeidae); мерланг черноморский (Odontogadus merlangus euxinus), семейство тресковых (Gadidae); пузанок черноморский (Alosa tanaica nordmanni), семейство сельдевых (Clupeidae); анчоус черноморский (Engraulis encrassicholus ponticus)), семейство анчоусовых (Engraulidae). Получен путем экстракции с последующей депротеинизацией и делипидизацией | |
| вспомогательные вещества: фенол — не более 0,005 г; вода для инъекций — до 1 мл |
Описание лекарственной формы
Бесцветная или слегка коричневато-желтого цвета, или слегка желтого цвета, прозрачная жидкость.
Фармакологическое действие
Фармакодинамика
Алфлутоп — хондропротектор, активным компонентом которого является биоактивный концентрат из мелкой морской рыбы. Концентрат содержит мукополисахариды (хондроитин сульфат), аминокислоты, пептиды, ионы натрия, калия, кальция, магния, железа, меди и цинка.
Алфлутоп предотвращает разрушение макромолекулярных структур нормальных тканей, стимулирует процессы восстановления в интерстициальной ткани и ткани суставного хряща, что объясняет его обезболивающее действие.
Противовоспалительное действие и регенерация тканей основаны на угнетении активности гиалуронидазы и нормализации биосинтеза гиалуроновой кислоты.
Оба эти эффекта синергичны и обусловливают активацию восстановительных процессов в тканях (в частности, восстановление структуры хряща).
Показания
Алфлутоп применяют у взрослых при следующих состояниях и заболеваниях:
- первичный и вторичный остеоартроз различной локализации (коксартроз, гонартроз, артроз мелких суставов);
- остеохондроз;
- спондилез.
Противопоказания
- повышенная чувствительность к компонентам препарата;
- беременность;
- период грудного вскармливания;
- детский возраст до 18 лет (из-за отсутствия клинических данных у данной категории пациентов).
Применение при беременности и кормлении грудью
Противопоказано применение препарата при беременности и в период грудного вскармливания.
Способ применения и дозы
При полиостеоартрозе и остеохондрозе препарат вводят глубоко внутримышечно (в/м) — по 1 мл в день, курс лечения составляет 20 инъекций (по 1 инъекции в день в течение 20 дней) или по 2 мл через день, курс лечения составляет 10 инъекций (по 1 инъекции через день в течение 20 дней).
При преимущественном поражении крупных суставов — по 1–2 мл в каждый сустав с интервалом 3–4 дня, внутрисуставно. Всего на курс — 5–6 инъекций в каждый сустав.
Возможно сочетание внутрисуставного и в/м методов введения.
Курс лечения целесообразно повторить через 6 месяцев после консультации врача.
Побочные действия
Реклама: ООО «РЛС-Патент», ИНН 5044031277
Побочные эффекты сгруппированы в соответствии с классификацией частоты развития нежелательных реакций ВОЗ: очень часто (≥1/10), часто (≥1/100 до <1/10), нечасто (≥1/1000 до <1/100), редко (≥1/10000 до <1/1000), очень редко (<1/10000), частота неизвестна (частота не может быть определена на основе имеющихся данных).
Редко — зудящий дерматит, покраснение кожи и ощущение жжения в месте введения препарата, кратковременные миалгии; очень редко — развитие анафилактических реакций; частота неизвестна — при внутрисуставных инъекциях возможно преходящее усиление болевого синдрома.
Взаимодействие
До настоящего времени не выявлено.
Передозировка
При передозировке усиливаются дозозависимые нежелательные лекарственные реакции.
Особые указания
В случае индивидуальной непереносимости морепродуктов (морская рыба) возрастает риск развития аллергических реакций.
Влияние на способность управлять транспортными средствами и механизмами. Применение препарата не оказывает влияния на способность к выполнению потенциально опасных видов деятельности, требующих повышенной концентрации внимания и быстроты психомоторных реакций (управление транспортными средствами, работа с движущимися механизмами, работа диспетчера и оператора).
Форма выпуска
Раствор для инъекций. По 1 мл или 2 мл в ампулах из темного стекла с белым кольцом излома.
На каждую ампулу наклеивают этикетку.
По 5 ампул в ячейковой полимерной упаковке с покрытием из алюминиевой фольги.
По 2 ячейковые упаковки (ампулы 1 мл или 2 мл) или 1 ячейковая упаковка (ампулы 2 мл) вместе с инструкцией по применению в пачке из картона.
Производитель
Производитель и первичная упаковка С.К. ЗЕНТИВА С.А. Бульвар Теодор Паллади № 50, округ 3, Бухарест, 032266, Румыния.
Юридическое лицо, на имя которого выдано регистрационное удостоверение. К.О. Биотехнос С.А. ул. Горунулуй № 3–5, город Отопень, уезд Илфов, 075100, Румыния.
Вторичная упаковка и выпускающий контроль качества К.О. Биотехнос С.А., ул. Горунулуй № 3–5, город Отопень, уезд Илфов, 075100 Румыния.
Организация, принимающая претензии потребителей. ООО«БИОТЕХНОС», 115432, Москва, пр-т Андропова, 18, корп. 6, пом. XI, комн. 7 (офис 6-07).
Тел.: 8-800-333-24-71.
Условия отпуска из аптек
По рецепту.
Условия хранения
В защищенном от света месте, при температуре 15–25 °C.
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не применять по истечении срока годности, указанного на упаковке.
Описание проверено
-
Крылов Юрий Федорович
(фармаколог, доктор медицинских наук, профессор, академик Международной академии информатизации)
Опыт работы: более 34 лет
Аналоги по действующему веществу не найдены.
Представленная информация о ценах на препараты не является предложением о продаже или покупке товара.
Информация предназначена исключительно для сравнения цен в стационарных аптеках, осуществляющих деятельность в
соответствии со статьей 55 Федерального закона «Об обращении лекарственных средств» от 12.04.2010 № 61-ФЗ.

ИМЕЮТСЯ ПРОТИВОПОКАЗАНИЯ. ВОЗМОЖНЫ ПОБОЧНЫЕ ЭФФЕКТЫ. НЕОБХОДИМА КОНСУЛЬТАЦИЯ СПЕЦИАЛИСТА.
Автор статьи
Подойницына Алёна Андреевна
,
Профессия: провизор
Название вуза: Пермская государственная фармацевтическая академия (ПГФА)
Специальность: фармация
Стаж работы: 5 лет
Диплом о фармацевтическом образовании: 105924 3510722 рег. номер 31917
Места работы: провизор в аптеке, преподаватель ПГФА на кафедре Управления и экономики фармации, провизор сервиса Мегаптека
Все авторы
Содержание
- Состав
- РЛС
- МНН
- Как принимать таблетки
- Противопоказания
- Совместимость с алкоголем
- Побочные действия
- Передозировка
- Дона или Терафлекс: что лучше?
- Мукосат или Дона: что лучше?
- Дона или Алфлутоп: что эффективнее
- Краткое содержание
По данным Всемирной организации здравоохранения (ВОЗ) каждый второй человек в мире в возрасте от 50 до 60 лет болеет артрозом. Болезнь связана с разрушением суставного хряща и деформацией костей суставов.
Согласно X Международной классификации болезней синонимами артроза являются такие заболевания, как остеоартроз, остеоартрит, деформирующий артроз. Так как главное звено в развитии болезни — деформация хряща, то действие группы препаратов против артроза направлено на восстановление, поддержание функций хряща и профилактику его разрушения. Болезнь легче предотвратить, потому что изменения при артрозе носят необратимый характер.
Популярным препаратом, стимулирующем восстановление хрящевой ткани, является Дона. Провизор Алёна Подойницына рассказывает о составе лекарства, как его принимать, какие побочные эффекты оно может вызвать. Сравнивает Дону с тремя аналогами: Алфлутоп, Мукосат и Терафлекс.
Состав
Препарат имеет три лекарственные формы, в состав которых входит одно действующее вещество глюкозамина сульфат. Врачи могут назначить уколы Доны или прием внутрь в таблетках или порошках. Ампулы Дона содержат лидокаин для обезболивания при введении внутримышечно.
Содержание глюкозамина сульфата в лекарственных формах отличается:
- Таблетки, покрытые пленочной оболочкой — 750 мг
- Порошок для приготовления раствора для приема внутрь — 1500 мг
- Инъекции для внутримышечного введения — 400 мг в ампуле
Глюкозамин в организме вырабатывается хрящевой тканью. Он входит в состав синовиальной жидкости («смазки» суставов) и важного компонента хряща хондроитина. Дона лекарство:
- восполняет дефицит естественного глюкозамина
- стимулирует синтез коллагена и гиалуроновой кислоты
- оказывает небольшой противовоспалительный эффект.
- помогает усвоению кальция и укреплению костной ткани
- тормозит разрушения в суставах
- восстанавливает функцию суставов
- уменьшает суставные боли
РЛС
Дона – препарат, зарегистрированный в государственном реестре лекарственных средств России (ГРЛС). Согласно источнику, Препарат относится к стимуляторам репарации (восстановления) тканей. Международное непатентованное наименование медикамента – глюкозамин.
МНН
МНН (международное непатентованное наименование) препарата — глюкозамин.
Как принимать таблетки
Биодоступность глюкозамина при пероральном приеме составляет всего 25%. Для результата препарат в таблетках по инструкции необходимо принимать по 750 мг (1 таблетка) 2 раза в сутки во время еды, запивая целым стаканом воды.
Улучшение наступает через 2-3 недели. Минимальный курс для Доны 4-6 недель. Врач может назначить повторные курсы с перерывом на 2 месяца.
Противопоказания
Препарат противопоказан пациентам с повышенной чувствительностью к компонентам препарата и тяжелой почечной недостаточностью. Инъекционный раствор также запрещен при нарушении сердечной проводимости, острой сердечной недостаточности, эпилептиформных судорогах в истории болезни и тяжелых нарушениях функции печени, а раствор для приема внутрь – при фенилкетонурии. Все лекарственные формы Доны не следует использовать во время беременности, в период грудного вскармливания и в детском возрасте до 18 лет. С полным списком противопоказаний можно ознакомиться в инструкции.
Совместимость с алкоголем
На время лечения рекомендуется исключить употребление алкоголя. Спиртные напитки сводят к минимуму положительный эффект терапии и повышают риск развития побочных действий.
Побочные действия
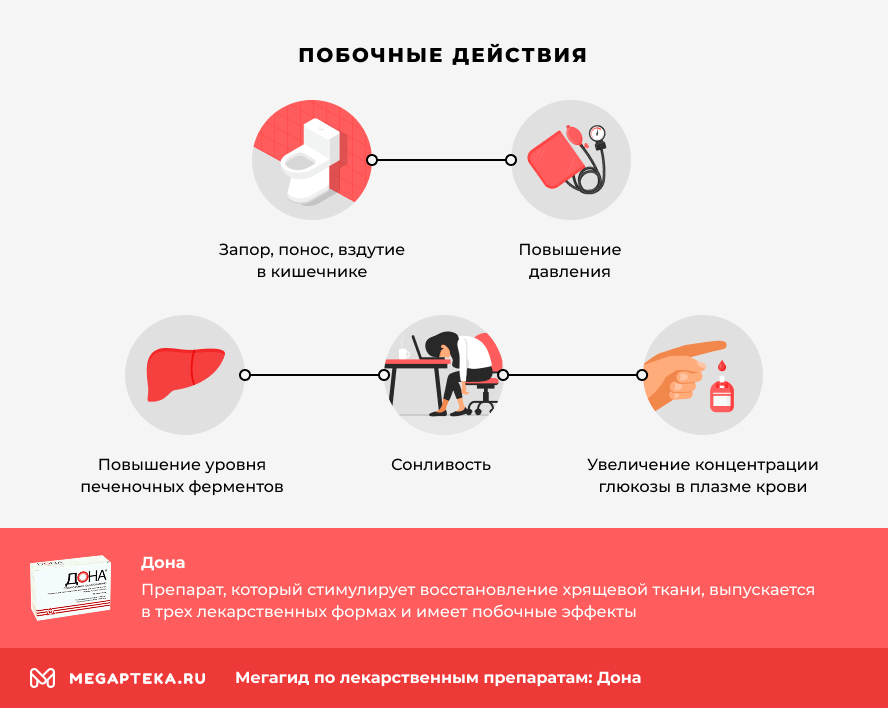
Наиболее частыми побочными эффектами при лечении Доной могут быть:
- тошнота, боль в животе, диспепсия
- запор, понос, вздутие в кишечнике
- головная боль
- сонливость
- усталость
- повышение уровня печеночных ферментов
- увеличение концентрации глюкозы в плазме крови
- повышение давления
Передозировка
Согласно официальной инструкции случаи передозировки препарата Дона до настоящего времени не зарегистрированы. Если это произойдет, то необходимы промывание желудка и симптоматическая терапия.
Дона или Терафлекс: что лучше?
Терафлекс выпускают в капсулах, которые помимо глюкозамина гидрохлорида (500 мг) содержат хондроитина сульфат натрия (400 мг). Хондроитин — это дополнительное вещество для синтеза хрящевой ткани. Он поддерживает вязкость синовиальной жидкости, блокирует ферменты эластазу и гиалуронидазу, которые расщепляют хрящ. Облегчает симптомы артроза и уменьшает потребность в обезболивающих. Более низкая дозировка глюкозамина в Терафлексе компенсируется комплексным действием двух активных веществ.
Терафлекс разрешен для терапии детей с 15 лет, таблетки Доны — только с 18 лет. В остальном противопоказания и показания у аналогов схожи.
Курс лечения у Терафлекса от 3 до 6 месяцев, при необходимости его повторяют. Дона в этом плане удобнее и экономичнее. Также у Доны есть выбор других лекарственных форм: уколы или порошок с двойной дозировкой.
Мукосат или Дона: что лучше?
Мукосат содержит только хондроитина сульфат. На рынке представлен в виде мази и раствора для внутримышечного и внутрисуставного введения. Действующие вещества у препаратов разные, но их объединяют показания к применению: артрозы суставов и остеохондрозы.
У Мукосата есть еще одно применение: для ускорения формирования костной мозоли при переломах. При лечении крупных суставов Мукосат можно сочетать по специальной схеме внутримышечные и внутрисуставные инъекции. Последние ставят только специально обученные специалисты в стерильных условиях.
Что лучше для конкретного пациента — Мукосат или Дона — должен определить лечащий врач. Мукосат в ампулах отпускают по рецепту.
Дона или Алфлутоп: что эффективнее
Алфлутоп — уникальный препарат. Его действующее вещество — это биоактивный концентрат из мелкой морской рыбы, обработанный по специальной технологии. В составе концентрата содержится хондроитин сульфат, а также аминокислоты и микроэлементы. Выпускается в ампулах для внутримышечного и внутрисуставного введения.
Алфлутоп является хондропротектором, защищает и восстанавливает хрящевую ткань. Оказывает и противовоспалительное действие за счет блокировки гиалуронидазы и стимулирования синтеза гиалуроновой кислоты.
Алфлутоп или Дона что лучше?
Показания к применению у Алфлутопа схожи с показаниями Доны, но действующие вещества у них разные. Оба препарата в ампулах — рецептурные, назначать их может только лечащий врач с учетом всех индивидуальных особенностей пациента.
Краткое содержание
- В состав Доны входит глюкозамина сульфат, который оказывает защитное и восстанавливающее действие на хрящевую ткань.
- Таблетки принимают 2 раза в день во время еды, запивая стаканом воды. Курс лечения не менее 4-6 недель.
- Частые побочные эффекты при лечении: тошнота, боль в животе, диспепсия, запор, понос, вздутие в кишечнике.
- Терафлекс содержит комбинацию хондропротекторов глюкозамина и хондроитина, что повышает его эффективность. Но курсовое лечение удобнее и дешевле у таблеток Дона.
- Мукосат и Алфлутоп нельзя принимать внутрь. Их используют только для инъекционного применения. Препараты содержат хондроитин. Отпускаются по рецепту и назначаются врачом.
Задайте вопрос эксперту по теме статьи
Остались вопросы? Задайте их в комментариях ниже – наши эксперты ответят вам. Там же вы можете поделиться своим опытом с другими читателями Мегасоветов.
Варилрикс — инструкция по применению
Синонимы, аналоги
Статьи
(Вакцина против ветряной оспы живая аттенуированная)
Регистрационный номер:
ЛСР-001354/08.
Торговое наименование:
Варилрикс® (Вакцина против ветряной оспы живая аттенуированная) / Varilrix®.
Группировочное наименование:
вакцина для профилактики ветряной оспы.
Лекарственная форма:
лиофилизат для приготовления раствора для подкожного введения.
Состав
1 прививочная доза (0,5 мл) содержит1,2:
|
Наименование компонентов |
Количество |
|
Действующее вещество |
|
|
Живой аттенуированный вирус Varicella Zoster (штамм Oka) |
≥ 103,3 БОЕ3,4 |
|
Вспомогательные вещества |
|
|
Лактоза |
32 мг |
|
Сорбитол |
6 мг |
|
Маннитол |
8 мг |
|
Аминокислоты |
8 мг |
|
Растворитель |
|
|
Вода для инъекций |
0,5 мл |
Примечания
1. Вакцина не содержит консервантов.
2. Вакцина содержит следовые количества неомицина сульфата (не более 25 мкг/дозу).
3. БОЕ — бляшкообразующие единицы.
4. Номинальный титр вируса соответствует минимальному титру, гарантируемому производителем на дату окончания срока годности. Содержание вируса в одной прививочной дозе на момент выпуска препарата должно отличаться и превышать минимальный титр, указанный в составе.
Описание
Aморфная масса или порошок от кремового до светло-желтого или светло-розового цвета; восстановленный препарат — жидкость от чистого желто-розового до розового цвета.
Растворитель: прозрачная бесцветная жидкость без видимых механических включений.
Характеристика
Варилрикс® (Вакцина против ветряной оспы живая аттенуированная) (далее — Варилрикс®) — живая аттенуированная вакцина для профилактики ветряной оспы, представляет собой живой аттенуированный вирус Varicella Zoster (штамм Oka), культивированный в культуре диплоидных клеток человека MRC-5. Варилрикс® отвечает всем требованиям Всемирной организации здравоохранения к производству медицинских иммунобиологических препаратов.
Фармако-терапевтичекая группа:
МИБП-вакцина.
Код АТХ:
J07BK01.
Иммунологические свойства
Иммунологическая и эпидемиологическая эффективность
Иммунологическую эффективность вакцины Варилрикс® в отношении профилактики ветряной оспы (случаи заболевания, подтвержденные результатами ПЦР или контактом с клинически подтвержденным случаем ветряной оспы) оценивали в масштабном международном клиническом исследовании с группой активного контроля, в котором дети в возрасте 12-22 месяцев получали одну дозу вакцины Варилрикс® или две дозы комбинированной вакцины для профилактики кори, паротита, краснухи и ветряной оспы.
Иммунологическая эффективность вакцинации вакциной Варилрикс® составила:

Введение 1 дозы вакцины Варилрикс® обеспечивало снижение количества госпитализаций по поводу ветряной оспы и количества амбулаторных визитов среди детей на 81 % и 87 %, соответственно.Эпидемиологическую эффективность 1 дозы вакцины Варилрикс® оценивали в различных условиях (вспышки заболевания, исследования случай-контроль, изучение баз данных), значение величины эффективности варьировало от 20 до 92 % против ветряной оспы любой степени тяжести и от 86 до 100 % против ветряной оспы средней или тяжелой степени тяжести.
Данные по эпидемиологической эффективности свидетельствуют о повышении уровня защиты и снижении частоты эпизодов «прорыва» ветряной оспы после введения 2 доз вакцины по сравнению с введением 1 дозы.
Иммунный ответ
Здоровые лица
У детей в возрасте от 11 до 21 месяца включительно сероконверсия, измеренная методом иммуноферментного анализа (50 мМЕ/мл) через 6 недель после вакцинации, составила 89,6 % после введения 1 дозы и 100 % после введения 2 доз вакцины.
У всех детей в возрасте от 9 месяцев до 12 лет включительно сероконверсия, измеренная в реакции иммунофлуоресценции через 6 недель после введения 1 дозы, достигала 98 %.
У детей в возрасте от 9 месяцев до 6 лет сероконверсия, измеренная в реакции иммунофлуоресценции через 6 недель после введения второй дозы вакцины, составила 100 % (увеличение средней геометрической величины титра антител в 5-26 раз).
У детей в возрасте от 13 лет и старше сероконверсия, измеренная в реакции иммунофлуоресценции через 6 недель после введения второй дозы вакцины, составила 100 %. При контроле через 1 год после курса вакцинации все лица были серопозитивными.
В клинических исследованиях было показано, что большинство вакцинированных, находившихся впоследствии в контакте с заболевшими, либо не подвержены инфекции, либо переносят заболевание в значительно более легкой форме (меньшее количество высыпаний, отсутствие лихорадки).
Для оценки уровня защиты от развития осложнений ветряной оспы, таких как энцефалит, гепатит или пневмония, данных недостаточно.
Данные клинических исследований по применению вакцины Варилрикс® у пациентов из групп высокого риска развития ветряной оспы являются ограниченными. Установлено, что общая частота сероконверсии у пациентов данной категории составляет ≥ 80 %.
У пациентов из групп высокого риска после вакцинации следует периодически осуществлять определение титра антител к вирусу ветряной оспы для принятия решения о необходимости дополнительной прививки.
Показания к применению
— Плановая профилактика ветряной оспы с 12 месяцев, в первую очередь у лиц, отнесенных к группам высокого риска (см. раздел «Особые указания»), не болевших ветряной оспой и не привитых ранее.
— Экстренная профилактика ветряной оспы у лиц, не болевших ветряной оспой и не привитых ранее, находившихся в тесном контакте с больными ветряной оспой (члены семей, врачи, средний и младший медицинский персонал, а также другие лица).
Противопоказания
— Гиперчувствительность к какому-либо компоненту вакцины, в том числе к неомицину; симптомы гиперчувствительности на предыдущее введение вакцины для профилактики ветряной оспы.
— Тяжелый гуморальный или клеточный иммунодефициты, такие как: первичный или приобретенный иммунодефицит (развившийся вследствие лейкоза, лимфомы, дискразии крови, клинических проявлений ВИЧ-инфекции, применения иммунодепрессантов, включая высокодозную терапию кортикостероидами), определяемый по количеству лимфоцитов — менее 1200/мм3, а также при наличии других признаков клеточного иммунодефицита.
— Острые инфекционные и неинфекционные заболевания, обострение хронических заболеваний являются временными противопоказаниями для проведения прививок; при нетяжелых ОРВИ, острых кишечных заболеваниях вакцинацию проводят сразу после нормализации температуры.
— Беременность или планируемая беременность в течение 1 месяца после вакцинации. Период кормления грудью.
Применение при беременности и в период грудного вскармливания
Фертильность
Данные отсутствуют.
Беременность
Беременных женщин нельзя вакцинировать препаратом Варилрикс®. Не следует допускать наступления беременности в течение 1 месяца после вакцинации. Женщинам, планирующим беременность, следует рекомендовать отложить наступление беременности.
Соответствующие данные о применении препарата Варилрикс® у человека во время беременности отсутствуют, а исследования репродуктивной токсичности на животных не проводились.
Период грудного вскармливания
Данные о применении у женщин в период грудного вскармливания отсутствуют.
Способ применения и дозы
Способ введения
Вакцина Варилрикс® предназначена для подкожного введения. Вакцину следует вводить в область дельтовидной мышцы или в переднебоковую область бедра.
Вакцину Варилрикс® нельзя вводить внутрисосудисто или внутрикожно.
Растворитель и восстановленную вакцину перед использованием необходимо визуально проверить на отсутствие механических включений и/или изменение внешнего вида (см. раздел «Описание»). В случае их обнаружения следует отказаться от применения растворителя или восстановленной вакцины.
Вакцину Варилрикс® нельзя смешивать в одном шприце с другими вакцинами.
Приготовление вакцины перед введением с использованием растворителя в шприце
Вакцину Варилрикс® необходимо восстановить путем добавления полного объема растворителя из предварительно наполненного шприца во флакон, содержащий лиофилизат.
Внимание! Упаковка вакцины Варилрикс® может быть представлена двумя типами шприцев, различающихся по способу соединения иглы с носиком шприца.
Для правильного выбора способа соединения иглы и шприца следуйте представленным ниже инструкциям. Шприц, вкладываемый в упаковку вакцины Варилрикс®, может незначительно отличаться от изображения шприца на рисунке 1.
Шприц 1 типа
Рисунок 1
Инструкция по подготовке шприца 1 типа (рисунок 1) к использованию:
1. Открутите защитный колпачок шприца, поворачивая его против часовой стрелки (при этом следует удерживать шприц за цилиндр, избегая контакта с поршнем шприца).
2. Крутящим движением по часовой стрелке соедините иглу со шприцем до момента, когда вы ощутите их защелкивание друг на друге.
3. Удалите защитный колпачок с иглы (в отдельных случаях он может быть туго закреплен на игле).
Шприц 2 типа
В случае, если упаковка содержит шприц, отличный от представленного на рисунке 1, то после удаления защитного колпачка с носика шприца игла надевается на шприц до упора без дополнительного накручивания.
Перенести растворитель из шприца во флакон с лиофилизатом. После добавления растворителя к лиофилизату хорошо встряхнуть образовавшуюся суспензию до полного растворения лиофилизата в растворителе (приблизительно 3 минуты). После восстановления вакцину необходимо незамедлительно ввести. Для введения вакцины следует использовать новую иглу. Для введения извлекают из флакона с восстановленной вакциной все его содержимое.
Приготовление вакцины перед введением с использованием растворителя в ампуле
Варилрикс® необходимо восстановить путем добавления полного объема растворителя из ампулы во флакон, содержащий лиофилизат.
После добавления растворителя к лиофилизату хорошо встряхнуть образовавшуюся суспензию до полного растворения лиофилизата в растворителе (приблизительно 3 минуты). После восстановления вакцину необходимо незамедлительно ввести. Для введения вакцины следует использовать новую иглу. Для введения извлекают из флакона с восстановленной вакциной все его содержимое.
После обработки места проведения инъекции спиртом или другим веществом, применяющимся для дезинфекции, следует подождать, пока это вещество испарится, поскольку при контакте с подобными соединениями может произойти инактивация вакцинного вируса.
Вакцину следует вводить сразу после ее разведения растворителем.
Неиспользованный препарат и отходы от его использования должны быть уничтожены в соответствии с требованиями, принятыми в Российской Федерации.
Схемы вакцинации
Плановая профилактика
По 1 дозе вакцины (0,5 мл) двукратно.
Рекомендованный минимальный интервал между прививками должен составлять 6 недель.
Экстренная профилактика
Вакцинацию проводят однократно 1 дозой вакцины (0,5 мл) в течение первых 96 часов после контакта (предпочтительно в течение первых 72 часов).
Вакцинация групп высокого риска
Пациенты с острым лейкозом, пациенты с тяжелыми хроническими заболеваниями и пациенты, получающие терапию иммунодепрессантами и лучевую терапию
Иммунизация проводится в состоянии полной гематологической ремиссии. При этом необходимо удостовериться, что общее количество лимфоцитов составляет не менее 1200/мм3, а также отсутствуют симптомы, указывающие на недостаточность клеточного иммунитета.
Если вакцинацию планируется провести в острой фазе лейкоза, необходимо прервать химиотерапию на срок, равный одной неделе до и одной неделе после вакцинации. Не следует проводить вакцинацию в периоды лучевой терапии.
Пациенты, которым планируется произвести трансплантацию органа
Если пациентам предстоит трансплантация органа, то курс вакцинации должен быть завершен за несколько недель до начала проведения терапии иммунодепрессантами.
Пациентам групп высокого риска могут потребоваться дополнительные дозы вакцины. Решение о необходимости введения дополнительных доз вакцины Варилрикс® принимает лечащий врач (иммуногематолог, онколог, трансплантолог).
Взаимозаменяемость вакцин
Вакцина Варилрикс® может быть введена тем, кто уже был вакцинирован другой вакциной, содержащей компонент для профилактики ветряной оспы. Курс вакцинации против ветряной оспы, начатый вакциной Варилрикс®, может быть продолжен другой вакциной, содержащей компонент для профилактики ветряной оспы.
Побочное действие
Данные клинических исследований
Здоровые лица
Профиль безопасности вакцины, приведенный ниже, основан на данных, полученных для 5 369 доз вакцины, вводившейся детям, подросткам и взрослым.
Нежелательные реакции, представленные ниже, перечислены в соответствии с поражением органов и систем органов и частотой встречаемости. Частота встречаемости определяется следующим образом: очень часто (≥ 1/10), часто (≥ 1/100 и < 1/10), нечасто (≥ 1/1 000 и < 1/100), редко (≥ 1/10 000 и < 1/1 000), очень редко (< 1/10 000, включая отдельные случаи).
Частота встречаемости нежелательных реакций
Инфекционные и паразитарные заболевания
Нечасто: инфекции верхних дыхательных путей, фарингит.
Нарушения со стороны крови и лимфатической системы
Нечасто: лимфаденопатия.
Нарушения психики
Нечасто: раздражительность.
Нарушения со стороны нервной системы
Нечасто: головная боль, сонливость.
Нарушения со стороны органа зрения
Редко: конъюнктивит.
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения
Нечасто: кашель, ринит.
Нарушения со стороны желудочно-кишечного тракта
Нечасто: тошнота, рвота.
Редко: боли в абдоминальной области, диарея.
Нарушения со стороны кожи и подкожных тканей
Часто: сыпь.
Нечасто: сыпь, сходная с высыпаниями при ветряной оспе, прурит.
Редко: крапивница.
Нарушения со стороны скелетно-мышечной системы и соединительной ткани
Нечасто: артралгия, миалгия.
Общие расстройства и нарушения в месте введения
Очень часто: боль и покраснение в месте инъекции.
Часто: отек в месте инъекции, повышение температуры тела (ректальной ≥ 38 °C, в подмышечной впадине или ротовой полости ≥ 37,5 °C).
Отек в месте инъекции и повышение температуры тела встречались очень часто в исследованиях, проводимых у подростков и взрослых. Отек также очень часто встречается после введения второй дозы детям до 13 лет. Тенденция увеличения количества случаев боли, покраснения и отека в месте инъекции после введения второй дозы была сопоставима с количеством этих нежелательных реакций, наблюдавшихся после введения первой дозы.
Нечасто: повышение температуры тела (ректальной ≥ 39,5°C; в подмышечной впадине или ротовой полости > 39°C), слабость, недомогание.
Не выявлены различия между профилем реактогенности у изначально серопозитивных и серонегативных лиц.
Пациенты из групп высокого риска
Существуют только ограниченные данные клинических исследований среди пациентов повышенного риска осложненного течения ветряной оспы. Вакциноассоциированные реакции (в основном папуло-везикулезная сыпь и повышение температуры тела) имеют, как правило, легкое течение. Как и у здоровых лиц, покраснение, отек и боль в месте инъекции имеют легкую степень и являются преходящими.
Данные пострегистрационного наблюдения
В ходе пострегистрационного наблюдения дополнительно зарегистрированы следующие нежелательные реакции после вакцинации.
Инфекционные и паразитарные заболевания
Редко: инфекция, вызванная Herpes Zoster.
Нарушения со стороны крови и лимфатической системы
Редко: тромбоцитопения.
Нарушения со стороны иммунной системы
Редко: реакции гиперчувствительности, анафилактические реакции.
Нарушения со стороны нервной системы
Редко: энцефалит, острое нарушение мозгового кровообращения, церебеллит, симптомы, напоминающие церебеллит (включая преходящее нарушение походки и преходящую атаксию), судороги.
Нарушения со стороны сосудов
Редко: васкулит (включая пурпуру Шенлейна-Геноха и синдром Кавасаки).
Нарушения со стороны кожи и подкожных тканей
Редко: многоформная эритема.
При наблюдении за массовым применением вакцины зарегистрированы случаи анафилактоидных реакций.
Передозировка
Зарегистрированы отдельные сообщения о случайной передозировке вакцины. В некоторых из них сообщалось о развитии таких симптомов, как летаргия, судороги. В других случаях передозировка не привела к развитию нежелательных явлений.
Взаимодействие с другими лекарственными препаратами
При необходимости постановки туберкулиновой пробы она должна быть проведена до вакцинации, поскольку по имеющимся данным живые вирусные вакцины могут вызывать временное снижение чувствительности кожи к туберкулину. В связи с тем, что подобное снижение чувствительности может сохраняться до 6 недель, не следует осуществлять туберкулинодиагностику в течение указанного периода времени после вакцинации во избежание получения ложноотрицательных результатов.
Вакцинация препаратом Варилрикс® возможна не ранее чем через 3 месяца после введения иммуноглобулинов или после гемотрансфузии.
Следует избегать назначения салицилатов в течение 6 недель после вакцинации препаратом Варилрикс®, поскольку имелись сообщения о развитии синдрома Рея на фоне инфекции, вызванной естественным вирусом ветряной оспы.
Одновременное назначение с другими вакцинами
Вакцину Варилрикс® можно вводить одновременно с инактивированными вакцинами национального календаря профилактических прививок и календаря прививок по эпидемическим показаниям, за исключением антирабической вакцины.
Вакцину Варилрикс® можно назначать в один день с вакцинами для профилактики кори, краснухи и паротита.
При этом различные вакцины вводят в разные участки тела.
Здоровые лица
Варилрикс® может применяться одновременно с любыми другими вакцинами.
При применении с коревой вакциной, в случае если прививки не были сделаны в один день, рекомендуется соблюдать интервал 30 дней.
Пациенты из групп высокого риска
Вакцину Варилрикс® не следует назначать одновременно с другими живыми аттенуированными вакцинами, за исключением комбинированной вакцины против кори, краснухи и паротита. Однако если эти вакцины не были назначены одновременно, то интервал между их назначением для достижения максимального уровня антител должен составлять не менее 30 дней.
Особые указания
Как и при любой другой вакцинации, иммунный ответ может развиться не у всех вакцинированных.
Как и при применении других вакцин для профилактики ветряной оспы, отмечены случаи заболевания ветряной оспой у лиц, привитых вакциной Варилрикс®. Однако такие случаи ветряной оспы обычно протекают в легкой форме, с небольшим количеством элементов сыпи и менее выраженным повышением температуры тела, по сравнению со случаями ветряной оспы у невакцинированных лиц. Отмечены редкие случаи передачи вакцинного штамма вируса от вакцинированных лиц с сыпью к контактным серонегативным лицам. Нельзя исключать передачу вакцинного штамма вируса контактным серонегативным лицам от вакцинированных лиц при отсутствии у последних элементов сыпи.
При вакцинации в течение первых 72 часов после контакта с инфекцией, вызванной естественным вирусом ветряной оспы, защита от ветряной оспы может быть достигнута не полностью.
Вакцинированные лица, у которых выявляются высыпания в течение 3 недель после вакцинации, должны исключить любые контакты с беременными женщинами (особенно в течение первого триместра беременности) и с лицами с иммунодефицитными состояниями в течение 14 дней с момента появления последнего высыпания.
Как и при парентеральном введении любых других вакцин, наготове должно быть все необходимое для купирования возможной анафилактической реакции на вакцину Варилрикс®. Вакцинированный должен находиться под медицинским наблюдением в течение 30 минут после иммунизации.
После вакцинации или иногда перед ней возможен обморок (потеря сознания) как психологическая реакция на инъекцию. Перед вакцинацией важно удостовериться, что пациент не получит повреждений в случае обморока.
Следует принимать адекватные меры контрацепции в течение 1 месяца после введения вакцины Варилрикс®.
Данные о применении вакцины Варилрикс® у лиц с иммунодефицитными состояниями ограничены, поэтому вакцинацию следует проводить с осторожностью и только в том случае, когда, по мнению врача, польза превышает риск.
У лиц с иммунодефицитными состояниями, не имеющих противопоказаний к вакцинации (раздел «Противопоказания»), как и у иммунокомпетентных пациентов, может не выявиться иммунная защитная реакция, соответственно часть вакцинированных может заразиться ветряной оспой, несмотря на правильно проведенную вакцинацию. Лица с иммунодефицитными состояниями должны находиться под тщательным наблюдением для выявления признаков ветряной оспы.
Сообщается о единичных случаях диссеминации вируса ветряной оспы с вовлечением в процесс внутренних органов после вакцинации препаратом, содержащим штамм Oka, преимущественно у пациентов с иммунодефицитом.
При наличии первичного или приобретенного иммунодефицита вакцинацию проводят после определения количества лимфоцитов. У пациентов, которые получают массивную терапию иммунодепрессантами, после вакцинации могут развиться клинические признаки ветряной оспы.
Пациенты из групп высокого риска
Следующие группы лиц предрасположены к развитию тяжелой формы ветряной оспы:
— пациенты с острым лейкозом;
— пациенты, получающие терапию иммуносупрессантами, включая применение кортикостероидов по поводу злокачественных солидных опухолей или по поводу тяжелых хронических заболеваний (почечная недостаточность, аутоиммунные заболевания, коллагенозы, тяжелая бронхиальная астма);
— пациенты, которым планируется произвести операцию трансплантации;
— пациенты с тяжелыми хроническими заболеваниями, такими как метаболические и эндокринные расстройства, хронические заболевания легких и сердечно-сосудистой системы, муковисцидоз и нервно-мышечные нарушения.
Иммунизация лиц из групп высокого риска против ветряной оспы вакциной Варилрикс® позволяет снизить риск развития осложнений, вызываемых ветряной оспой.
С целью дополнительного снижения риска инфицирования пациентов из группы высокого риска рекомендуется также проводить вакцинацию лиц, находящихся в тесном контакте с заболевшими ветряной оспой или с пациентами из групп высокого риска. К данной категории относятся родители, братья и сестры пациентов из групп высокого риска, старший и средний медицинский персонал и другие лица, находившиеся в тесном контакте с лицами, заболевшими ветряной оспой.
Влияние на способность управлять транспортными средствами, механизмами
Не установлено.
Форма выпуска
Лиофилизат для приготовления раствора для подкожного введения.
Лиофилизат
По 1 дозе вакцины во флаконе из прозрачного стекла типа I (Евр.Ф.) вместимостью 3 мл, укупоренном пробкой из резины и алюминиевым колпачком под обкатку, снабженным защитной пластиковой крышечкой.
Растворитель
По 0,5 мл в ампуле прозрачного стекла типа I (Евр.Ф.) вместимостью 1 мл.
По 0,5 мл в шприце из прозрачного стекла типа I (Евр.Ф.) вместимостью 1,25 мл. Носик шприца герметично укупорен защитным резиновым колпачком или герметичной резиновой пробкой с защитным завинчивающимся пластиковым колпачком.
Комплектность
По 1 флакону с лиофилизатом, 1 ампуле с растворителем в блистере из поливинилхлорида, закрытом пленкой из полиэтилентерефталата. По 1 блистеру с инструкцией по применению в картонной пачке.
По 1 флакону с лиофилизатом, 1 шприцу с растворителем в блистере из поливинилхлорида, закрытом пленкой из полиэтилентерефталата. По 1 блистеру с инструкцией по применению в картонной пачке.
По 1 флакону с лиофилизатом, 1 шприцу с растворителем в комплекте с 1 иглой в отдельном пластиковом контейнере с канюлей, закрытой пластиковым колпачком, в блистере из поливинилхлорида, закрытом пленкой из полиэтилентерефталата. По 1 блистеру с инструкцией по применению в картонной пачке.
По 1 флакону с лиофилизатом, 1 шприцу с растворителем в комплекте с 2 иглами в отдельных пластиковых контейнерах с канюлями, закрытыми пластиковыми колпачками, в блистере из поливинилхлорида, закрытом пленкой из полиэтилентерефталата. По 1 блистеру с инструкцией по применению в картонной пачке.
По 100 флаконов с лиофилизатом с 1 или 10 инструкциями по применению в картонной коробке. По 25 ампул с растворителем в блистере из поливинилхлорида или полиэтилена, закрытом пленкой, или без пленки. По 4 блистера в картонной коробке.
Срок годности
Лиофилизат: 2 года.
Растворитель: 5 лет.
Срок годности комплекта указывается по наименьшему сроку годности одного из компонентов.
Не применять после истечения срока годности, указанного на упаковке.
Датой окончания срока годности является последний день месяца, указанного на упаковке.
Условия хранения
Лиофилизат
Хранить при температуре от 2 до 8°С. Хранить в защищенном от света месте.
Растворитель
Хранить при температуре от 2 до 25°С. Не замораживать.
Комплект (лиофилизат, растворитель, с иглами или без игл)
Хранить при температуре от 2 до 8°С. Не замораживать.
Хранить в защищенном от света месте.
Хранить в недоступном для детей месте.
Условия транспортирования
Лиофилизат
Транспортировать при температуре от 2 до 8°С.
Растворитель
Транспортировать при температуре от 2 до 25°С. Не замораживать.
Комплект (лиофилизат, растворитель, с иглами или без игл)
Транспортировать при температуре от 2 до 8°С. Не замораживать.
Условия отпуска
Упаковка, содержащая 1 флакон с лиофилизатом и 1 ампулу или шприц с растворителем, — отпускают по рецепту.
Упаковка, содержащая 100 флаконов с вакциной, упаковка, содержащая 100 ампул с растворителем, — для лечебнопрофилактических учреждений.
Производитель
Производитель готовой лекарственной формы
Лиофилизат
«ГлаксоСмитКляйн Байолоджикалз с.а.», Бельгия
«Корикса Корпорейшен», США
Растворитель
«Аспен Нотр Дам де Бондевиль», Франция
«Дельфарм Тур», Франция
«Каталент Бельгия с.а.», Бельгия
Фасовщик (первичная упаковка)
Лиофилизат
«ГлаксоСмитКляйн Байолоджикалз с.а.», Бельгия
«Корикса Корпорейшен», США
Растворитель
«Аспен Нотр Дам де Бондевиль», Франция
«Дельфарм Тур», Франция
«Каталент Бельгия с.а.», Бельгия
Упаковщик (вторичная (потребительская) упаковка)
«ГлаксоСмитКляйн Байолоджикалз с.а.», Бельгия
«Дельфарм Тур», Франция (для формы выпуска растворителя по 100 ампул)
ООО «СмитКляйн Бичем-Биомед», Россия
Выпускающий контроль качества
«ГлаксоСмитКляйн Байолоджикалз с.а.» / GlaxoSmithKline Biologicals s.a. Рю де л’Энститю, 89, 1330 Риксенсарт, Бельгия / Rue de l’Institut, 89, 1330 Rixensart, Belgium
ООО «СмитКляйн Бичем-Биомед»
Россия, Московская обл., Красногорский р-н, с. Петрово-Дальнее
Наименование и адрес держателя или владельца регистрационного удостоверения лекарственного препарата
АО «ГлаксоСмитКляйн Трейдинг», Россия
125167, г. Москва, Ленинградский проспект, д. 37А, корпус 4, этаж 3, помещение XV, комната 1
Рекламации на качество препарата и развитие поствакцинальных осложнений направлять в адрес:
Федеральной службы по надзору в сфере здравоохранения (Росздравнадзор)
109074, Россия, г. Москва, Славянская пл., 4, стр. 1
и
АО «ГлаксоСмитКляйн Трейдинг», Россия
125167, г. Москва, Ленинградский проспект, д. 37А, корпус 4,
этаж 3, помещение XV, комната 1
*Цены в Москве. Точная цена в Вашем городе будет указана на сайте аптеки.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Рейтинг модели, основанный на 59 отзывах: (4 звезды)
Комментарии временно отключены.
Обновлено: 20.07.2024
Характеристики
Описание и характеристики могут быть неточными, перед покупкой уточняйте их у продавца.
Общие характеристики
| Мощность | 2600 Вт |
| Подошва | керамика |
| Функции | постоянная подача пара, паровой удар, защита от накипи, автоматическое отключение, система самоочистки, противокапельная система |
| Регулировка подачи пара | есть |
| Автоматическая регулировка пара | нет |
| Функция разбрызгивания | есть |
Комфорт
| Желобок для пуговиц | есть |
| Сетевой кабель | шаровое крепление к корпусу |
| Длина шнура | 1.95 м |
Особенности
| Комплектация | мерный стакан |
Габариты и вес
Описание модели
Утюг DEXP CE2400S имеет мощность 2600 Вт, что позволяет быстро нагревать утюжную поверхность и эффективно гладить одежду. Подошва утюга изготовлена из керамики, что обеспечивает плавное скольжение по ткани и предотвращает появление следов и переглаживание.
Устройство обладает несколькими полезными функциями, включая постоянную подачу пара, паровой удар и защиту от накипи. Присутствует автоматическое отключение, которое безопасно отключает утюг, если он не используется в течение определенного времени. Система самоочистки позволяет легко удалить накипь и загрязнения из парового отверстия. Противокапельная система предотвращает появление капель на гладкой поверхности утюжной подошвы.
Утюг DEXP CE2400S имеет возможность регулировки подачи пара, что позволяет выбрать оптимальный уровень для различных типов тканей. Однако устройство не имеет автоматической регулировки пара. Есть функция разбрызгивания, которая помогает справиться с более трудными складками и заломами на одежде.
Для повышения комфорта использования предусмотрены дополнительные особенности. На утюге есть желобок для пуговиц, который позволяет легко утюжить сложные участки одежды. Сетевой кабель имеет шаровое крепление к корпусу, что предотвращает его перекручивание и обеспечивает удобство при работе. Длина шнура составляет 1,95 м, что обеспечивает достаточную свободу движений.
В комплекте с утюгом поставляется мерный стакан, который поможет дозировать воду для пара. Вес утюга составляет 1,7 кг, что делает его легким и удобным в использовании. Все эти характеристики делают утюг DEXP CE2400S надежным и эффективным помощником при глажке одежды.
