- 📜Инструкция по применению Пантасан
- 💊Состав препарата Пантасан
- ✅Показания препарата Пантасан
- 📅Условия хранения препарата Пантасан
- ⏳Срок годности препарата Пантасан
Форма выпуска, состав и упаковка
таб., покр. кишечнорастворимой оболочкой, 40 мг: 30 шт.
Рег. №: 8401/07/13/15/18 от 03.05.2018 — Срок действия рег. уд. не ограничен
Таблетки, покрытые кишечнорастворимой оболочкой желтого цвета, круглые, двояковыпуклые, гладкие с обеих сторон.
| 1 таб. | |
| пантопразол (в форме пантопразола натрия сесквигидрата) | 40 мг |
Вспомогательные вещества: маннитол, натрия карбонат безводный, лактоза безводная, кросповидон, повидон К90, кальция стеарат.
Состав оболочки: гипромеллоза 2910, полиэтиленгликоль 400, тальк, сополимер метакриловой кислоты (тип C), триэтилцитрат, титана диоксид E171, железа оксид желтый E172.
10 шт. — стрипы (3) — пачки картонные.
Описание лекарственного препарата ПАНТАСАН таблетки создано в 2015 году на основании инструкции, размещенной на официальном сайте Минздрава РБ. Дата обновления: 14.05.2015 г.
Фармакологическое действие
Активный ингредиент препарата — пантопразол — тормозит активность Н+-К+-АТФ-азы в париетальных клетках желудка и тем самым блокирует заключительную стадию секреции соляной кислоты. Это приводит к снижению уровня базальной и стимулированной секреции независимо от природы стимулирующего фактора.
При язвенной болезни двенадцатиперстной кишки, ассоциированной с Helicobacter pylori, снижение желудочной секреции повышает чувствительность микроорганизмов к антибиотикам. Не влияет на моторику ЖКТ. Секреторная активность нормализуется через 3-4 дня после окончания применения препарата.
Фармакокинетика
Фармакокинетика одинакова как после однократного, так и после многократного применения препарата.
Всасывание
Пантопразол полностью всасывается после приема внутрь. Абсолютная биодоступность препарата при приеме внутрь составляет 77%. Прием пищи не влияет на AUC, Cmax и биодоступность. В среднем Cmax достигается через 2-2.5 ч после приема препарата и составляет 1-1.5 мкг/мл, эти показатели остаются постоянными после многократного применения препарата. В диапазоне доз от 10 до 80 мг кинетическая прямая концентрации пантопразола в плазме крови имеет линейную зависимость как после приема внутрь, так и после в/в применения.
Распределение
Связывание пантопразола с белками плазмы крови составляет 98%. Vd — 0.15 л/кг, клиренс — 0.1 л/ч/кг.
Метаболизм
Метаболизируется в печени. Основным метаболитом в плазме крови и моче является дисметилпантопразол, который конъюгирует с сульфатом.
Выведение
Основной путь выведения — с мочой (около 80%) в виде метаболитов пантопразола, в небольшом количестве выводится с калом. Т1/2 пантопразола — 1 ч, Т1/2 метаболтиа — около 1.5 ч. Было отмечено несколько случаев замедленной элиминации (при применении раствора для в/в введения).
Фармакокинетика у сособых групп пациентов
Пациентам с нарушением функции почек (включая пациентов, находящихся на гемодиализе) уменьшение дозы пантопразола не требуется. Также как и у здоровых лиц, у пациентов этой группы Т1/2 препарата короткий. Незначительное количество пантопразола подвергается диализу. Несмотря на то, что Т1/2 основного метаболита несколько увеличивается (2-3 ч), он быстро выводится, и таким образом не накапливается.
У пациентов с циррозом печени (классы А, В по шкале Чайлд-Пью) значение Т1/2 увеличивается до 7-8 ч, AUC увеличивается в 5-7 раз, Cmax в плазме крови увеличивается в 1.5 раза по сравнению с пациентами с нормальной функцией печени.
Небольшое увеличение AUC и Cmax у пациентов пожилого возраста по сравнению с соответствующими данными у пациентов молодого возраста не является значимым.
Показания к применению
Взрослые и дети старше 12 лет
- рефлюкс-эзофагит.
- язвенная болезнь желудка и двенадцатиперстной кишки, эрозивный гастрит (в т.ч. вызванные приемом НПВС);
- патологические гиперсекреторные состояния, включая синдром Золлингера-Эллисона;
- эрадикация H.pylori в комбинации с антибактериальными средствами.
Взрослые
Реклама
Режим дозирования
Препарат принимают внутрь, независимо от приема пищи. Таблетку следует проглатывать целиком, запивая водой. При назначении 1 раз/сут предпочтительно принимать препарат утром, что способствует лучшему соблюдению пациентами схемы лечения.
Пантасан 40 мг таблетки, покрытые кишечнорастворимой оболочкой, являются неделимыми, поэтому при необходимости применения пантопразола в дозе 20 мг следует применять таблетки Пантасан 20 мг.
Рефлюкс-эзофагит
Пантопразол назначают в дозе 40 мг 1 раз/сут. При отсутствии эффекта возможно увеличение дозы до 80 мг 1 раз/сут. Курс лечения — 4-8 недель. Для проведения противорецидивной терапии рекомендуемая доза составляет 20 мг/сут.
Язвенная болезнь желудка и двенадцатиперстной кишки, эрозивный гастрит (в т.ч. вызванные приемом НПВС)
Пантопразол назначают в дозе 40 мг 1 раз/сут. При отсутствии эффекта возможно увеличение дозы до 80 мг 1 раз/сут. Курс лечения — 2 недели при обострении язвенной болезни двенадцатиперстной кишки и 4-8 недель — при обострении язвенной болезни желудка. Для проведения противорецидивной терапии язвенной болезни желудка и двенадцатиперстной кишки рекомендуемая доза составляет 20 мг/сут.
Эрадикация Helicobacter pylori
Рекомендуемая доза пантопразола для взрослых составляет 40 мг 2 раза/сут в течение 7-14 дней в комбинации с подходящим антибиотиком:
— 1000 мг амоксициллина 2 раза/сут + 500мг кларитромицина 2 раза/сут;
— 500 мг метронидазола 2 раза/сут + 500 мг кларитромицина 2 раза/сут;
— 1000 мг амоксициллина 2 раза/сут + 500 мг метронидазола 2 раза/сут.
Патологические гиперсекреторные состояния, включая синдром Золлингера-Эллисона
Дозу подбирают индивидуально. Рекомендуемая доза для взрослых — 80 мг 1 раз/сут. В зависимости от уровня секреции соляной кислоты в желудке доза пантопразола может быть увеличена либо снижена. Дозу пантопразола свыше 80 мг/сут делят на 2 приема. Возможно временное назначение пантопразола в дозе выше 160 мг/сут, но подобное повышение дозы не должно длиться дольше, чем это необходимо для адекватного снижения секреции соляной кислоты.
Продолжительность лечения определяется в зависимости от уровня соляной кислоты.
Побочные действия
Побочные эффекты возникают редко, если пантопразол принимают в соответствии с показаниями и в рекомендуемых дозах. Согласно имеющимся данным побочные эффекты возникают примерно у 5% пациентов, принимающих пантопразол. Наиболее частые побочные эффекты: диарея и головная боль (возникают примерно у 1% пациентов, принимающих пантопразол).
В зависимости от частоты возникновения побочных эффектов используются категории: очень часто (≥1/10); часто (≥1/100, <1/10); нечасто (≥1/1000, <1/100); редко (≥1/10 000, <1/1000); очень редко (<1/10 000); частота неизвестна (не может быть определена на основании доступных данных).
Применение пантопразола может сопровождаться следующими побочными реакциями:
| Часто | Нечасто | Редко | Очень редко | Частота неизвестна |
| Со стороны системы кроветворения | ||||
| тромбоцитопения, лейкопения | ||||
| Со стороны иммунной системы | ||||
| анафилактические реакции, включая анафилактический шок | ||||
| Со стороны обмена веществ | ||||
| повышение уровня триглицеридов, холестерина; изменение массы тела | гипонатриемия, гипомагниемия | |||
| Психические нарушения | ||||
| нарушение сна | депрессия | дезориентация | галлюцинации, спутанность сознания (особенно у пациентов, склонных к этому), а также усиление данных симптомов в случаях, если они наблюдались до начала приема пантопразола | |
| Со стороны нервной системы | ||||
| головная боль, головокружение | ||||
| Со стороны органа зрения | ||||
| нарушение зрения, затуманенное зрение | ||||
| Со стороны пищеварительной системы | ||||
| диарея, тошнота, рвота, вздутие живота, запор, сухость во рту, боль и дискомфорт в области живота | ||||
| Со стороны гепатобилиарной системы | ||||
| повышение активности печеночных ферментов (трансаминазы, ГГТ) | повышение концентрации билирубина | повреждение клеток печени, приводящее к желтухе (с или без печеночной недостаточности) | ||
| Со стороны кожи и подкожной клетчатки | ||||
| сыпь, экзантема, зуд | крапивница, отек Квинке | синдром Стивенса-Джонсона, многоформная эритема, фоточувствительность, синдром Лайелла | ||
| Со стороны костно-мышечной системы | ||||
| артралгия, миалгия | переломы костей | |||
| Со стороны мочевыделительной системы | ||||
| интерстициальный нефрит | ||||
| Со стороны половой системы и молочной железы | ||||
| гинекомастия | ||||
| Общие реакции | ||||
| слабость, усталость, общее недомогание | повышение температуры тела, периферические отеки |
Противопоказания к применению
- одновременное применение атазанавира;
- повышенная чувствительность к компонентам препарата.
С осторожностью следует назначать препарат при печеночной недостаточности.
Применение при беременности и кормлении грудью
Нет точных данных по применению пантопразола у беременных женщин. Исследования на животных выявили токсический эффект в отношении репродуктивной системы. Доклинические исследования не выявили признаков снижения фертильности или тератогенных эффектов. Потенциальный риск применения препарата остается неизвестным. Препарат не следует применять при беременности.
В исследованиях на животных выявлено, что пантопразол выделяется с грудным молоком. Имеются сообщения о том, что пантопразол выделяется с грудным молоком у человека. Препарат не следует применять в период грудного вскармливания.
Применение при нарушениях функции печени
Пациентам с выраженными нарушениями функции печени пантопразол назначают с осторожностью. Рекомендуемая доза — 20 мг 1 раз/сут или 40 мг 1 раз в 2 дня (под контролем биохимических показателей крови). При увеличении активности печеночных ферментов следует прекратить применение препарата.
Пациентам с печеночной недостаточностью тяжелой степени не следует назначать препарат в комбинации для эрадикации H.pylori, поскольку отсутствует достаточный опыт такого лечения у пациентов данных групп.
Пациентам с печеночной недостаточностью тяжелой степени не рекомендуется назначать препарат в суточной дозе выше 40 мг. Исключением является проведение комбинированной антимикробной терапии в отношении H.pylori, когда пациентам необходимо принимать пантопразол в дозе 40 мг 2 раза/сут.
Применение при нарушениях функции почек
Пациентам с нарушением функции почек (включая пациентов, находящихся на гемодиализе) уменьшение дозы пантопразола не требуется.
Пациентам с почечной недостаточностью не следует назначать препарат в комбинации для эрадикации H.pylori, поскольку отсутствует достаточный опыт такого лечения у пациентов данных групп.
Пациентам с нарушением функции почек не рекомендуется назначать препарат в суточной дозе выше 40 мг. Исключением является проведение комбинированной антимикробной терапии в отношении H.pylori, когда пациентам необходимо принимать пантопразол в дозе 40 мг 2 раза/сут.
Применение у детей
Клинический опыт применения пантопразола у детей отсутствует, поэтому назначение препарата детям в возрасте до 12 лет не рекомендуется.
Особые указания
Перед началом лечения необходимо исключить возможность наличия злокачественного процесса (особенно при язве желудка), т.к. лечение пантопразолом может маскировать симптомы и отсрочить правильную диагностику.
При длительном лечении пантопразолом (1 год и более) пациентов следует регулярно наблюдать.
Были получены сообщения о развитии симптоматической и асимптоматической гипомагниемии у пациентов, принимающих ингибиторы протонового насоса как минимум 3 мес, в большинстве случаев после 1 года терапии. Серьезные побочные явления включают тетанию, аритмию, судороги. Большинству пациентов требовалось введение солей магния и прекращение применения ингибиторов протонового насоса. Если планируется длительное применение ингибиторов протонового насоса или совместное применение дигоксина или других лекарственных средств, которые могут вызывать снижение содержания магния (например, диуретиков), необходимо определить содержание магния в сыворотке крови до начала применения ингибиторов протонового насоса и периодически во время провдения терапии.
Данные исследований свидетельствуют о том, что применение ингибиторов протонового насоса может быть связано с повышенным риском возникновения переломов бедра, запястья, позвоночника. Риск возникновения переломов повышался у пациентов, которые получали ингибиторы протонового насоса в высоких дозах (многократный ежедневный прием) и/или при длительной терапии (1 год и более). Рекомендуется принимать ингибиторы протонового насоса в минимальной терапевтической дозе в соответствии с показаниями для применения, продолжительность курса лечения должна быть минимальной. Пациентов с риском возникновения переломов следует лечить согласно утвержденным рекомендациям.
Пациентам с выраженными нарушениями функции печени пантопразол назначают с осторожностью. Рекомендуемая доза — 20 мг 1 раз/сут или 40 мг 1 раз в 2 дня (под контролем биохимических показателей крови). При увеличении активности печеночных ферментов следует прекратить применение препарата.
Пациентам с печеночной недостаточностью тяжелой степени или почечной недостаточностью не следует назначать препарат в комбинации для эрадикации H.pylori, поскольку отсутствует достаточный опыт такого лечения у пациентов данных групп.
Пациентам с печеночной недостаточностью тяжелой степени и пациентам с нарушением функции почек не рекомендуется назначать препарат в суточной дозе выше 40 мг. Исключением является проведение комбинированной антимикробной терапии в отношении H.pylori, когда пациентам необходимо принимать пантопразол в дозе 40 мг 2 раза/сут.
Использование в педиатрии
Клинический опыт применения пантопразола у детей отсутствует, поэтому назначение препарата детям в возрасте до 12 лет не рекомендуется.
Влияние на способность к вождению автотранспорта и управлению механизмами
Пантасан не оказывает влияние на способность управлять автотранспортом и механизмами. Следует учитывать, что на фоне применения препарата возможно возникновение головокружения или нарушения зрения, в таких случаях пациенту следует воздержаться от управления автомобилем и другими механизмами.
Токсичность, эмбриотоксичность, тератогенность, мутагенность, канцерогенность
В 2-летнем исследовании канцерогенности крысам вводили пантопразол в дозах в 4-352 раза превышающих доза, рекомендуемые для людей. Наблюдали образование карциноидных опухолей желудка в конце жизни и дозозависимую гиперплазию хромаффиноподобных клеток кишечника у обоих полов. Последнее изменение обусловлено повышением уровня гастрина (гипрегастринемия) вследствие введения высоких доз ингибитора кислотности. Тот же эффект наблюдается при применении блокаторов Н2-рецепторов.
Клинический опыт применения препарата у беременных женщин ограничен. В исследованиях на животных отмечали легкие случаи фетотоксичности при применении в дозах, превышающих 5 мг/кг. Нет данных о выделении пантопразола с грудным молоком у женщин.
Передозировка
До настоящего времени случаев передозировки при применении пантопразола отмечено не было. Дозы до 240 мг при в/в введение в течение 2 мин переносились хорошо.
Симптомы: возможно усиление побочных эффектов.
Лечение: проведение симптоматической и поддерживающей терапии. Пантопразол не выводится посредством гемодиализа.
Лекарственное взаимодействие
Пантопразол может снижать или повышать всасывание препаратов, чья биодоступность зависит от pH среды желудка (например, противогрибковых средств производных азола (кетоконазол, итраконазол, позаконазол), а также других лекарственных средств (например, эрлотиниб)).
Пантопразол может быть назначен без риска лекарственного взаимодействия пациентам с заболеваниями сердечно-сосудистой системы, принимающим сердечные гликозиды (дигоксин), блокаторы медленных кальциевых каналов (нифедипин), бета-адреноблокаторы (метопролол); пациентам с заболеваниями ЖКТ, принимающим антациды, антибиотики (амоксициллин, клартиромицин); пациенткам, принимающим пероральные контрацептивы; пациентам, принимающим НПВС (диклофенак, феназон, напроксен, пироксикам); пациентам с заболеваниями эндокринной системы, принимающим глибенкламид, левотироксин; пациентам с тревожными состояниями и расстройствами сна, принимающим диазепам; пациентам с эпилепсией, принимающим карбамазепин и фенитоин; пациентам, перенесшим трансплантацию, принимающим циклоспорин, такролимус.
Отмечено также отсутствие лекарственного взаимодействия с теофиллином, кофеином и этанолом.
У пациентов, принимающих пероральные антикоагулянты кумаринового ряда (например, кумарин или фенпрокумон), необходим мониторинг протромбинового времени/МНО в начале и после прекращения приема пантопразола, а также во время нерегулярного применения пантопразола.
При одновременном применении ингибиторов протонового насоса и атазанавира (а также других препаратов для лечения ВИЧ-инфекции, абсорбция которых зависит от pH среды желудка) возможно снижение биодоступности препаратов для лечения ВИЧ-инфекции, уменьшение их концентрации в сыворотке крови, что может оказать влияние на эффективность противовирусных препаратов. Поэтому данные комбинации применять не рекомендуется.
Условия хранения препарата
Препарат следует хранить в недоступном для детей, сухом, защищенном от света месте при температуре не выше 25°С.
Контакты для обращений
САН ФАРМАСЬЮТИКАЛ ИНДАСТРИЗ Лтд ООО, представительство, (Индия)
Представительство в Республике Беларусь
220113 Минск, ул. Мележа 1, оф. 1118-34
Тел./факс: (375-17) 364-54-53
http://www.sunpharma.com
Реклама
Все аналоги
Аналоги препарата
НОЛЬПАЗА®
(KRKA, d.d., Novo mesto, Словения)
ПАНТАСАН
(SUN PHARMACEUTICAL INDUSTRIES, Ltd., Индия)
ПАНТАП
(NOBEL ILAC SANAYII VE TICARET, A.S., Турция)
САНПРАЗ 20
(ЭКЗОН, ОАО, Республика Беларусь)
РЕБТАНЗА
(РЕБ-ФАРМА, ИПТУП, Республика Беларусь)
ПАНТОПРАЗОЛ
(БЕЛМЕДПРЕПАРАТЫ, РУП, Республика Беларусь)
Аналоги КФУ
МЕПРЭЗО
(РЕБ-ФАРМА, ИПТУП, Республика Беларусь)
НЕКСИУМ
(ASTRAZENECA UK, Ltd., Великобритания)
ПАНТАСАН 20
(SUN PHARMACEUTICAL INDUSTRIES, Ltd., Индия)
Другие препараты этого производителя
ЭТОРИСАН
(SUN PHARMACEUTICAL INDUSTRIES, Ltd., Индия)
ТЕЛАТРИ
(SUN PHARMACEUTICAL INDUSTRIES, Ltd., Индия)
МИЛФЛОКС
(SUN PHARMACEUTICAL INDUSTRIES, Ltd., Индия)
МЕДАБОН
(SUN PHARMACEUTICAL INDUSTRIES, Ltd., Индия)
ГЛИПРИД
(SUN PHARMACEUTICAL INDUSTRIES, Ltd., Индия)
ГАНИРЕСАН
(SUN PHARMACEUTICAL INDUSTRIES, Ltd., Индия)
СТРОЦИТ
(SUN PHARMACEUTICAL INDUSTRIES, Ltd., Индия)
ОКСЕТОЛ
(SUN PHARMACEUTICAL INDUSTRIES, Ltd., Индия)
ЛЕВИПИЛ XR
(SUN PHARMACEUTICAL INDUSTRIES, Ltd., Индия)
ДРОНИС
(SUN PHARMACEUTICAL INDUSTRIES, Ltd., Индия)
Реклама
Эта статья завершает наш спецпроект по псориазу. Теперь, когда мы уже знакомы с особенностями развития этой патологии, пришло время разобраться с ее лечением. Поиски лекарства для полной и безоговорочной победы над этой болезнью пока не увенчались успехом, но привели к появлению множества терапевтических подходов, позволяющих держать ее в узде. Познакомимся с преимуществами и недостатками основных способов лечения псориаза и попытаемся разобраться, как они работают.

Псориаз
Спецпроект посвящен генетическому кожному заболеванию, от которого страдает около 1% россиян. В статьях спецпроекта мы стараемся подробно, достоверно и интересно осветить это заболевание со всех возможных сторон. В этом нам помогают наши рецензенты: специалист по псориазу, кандидат биологических наук Алёна Золотаренко и врач-дерматовенеролог, кандидат медицинских наук Михаил Бетехтин.
Предыдущие статьи нашего цикла о псориазе («Псориаз: на войне с собственной кожей» [1], «Псориаз: Т-хелперы, цитокины и молекулярные шрамы» [2], «Генетика псориаза: иммунитет, барьерная функция кожи и GWAS» [3], «Эпигенетика псориаза: молекулярные отметины судьбы» [4]) очень подробно объяснили, насколько сложна этиология этого заболевания: она связана и с особенностями генома, и с эпигенетическими модификациями, и с провоцирующими факторами внешней среды. Вычленить из этого коктейля конкретные причины заболевания еще не удалось, поэтому и его лечение до сих пор не этиотропное (позволяющее повлиять на причину болезни), а патогенетическое — направленное на то или иное звено патогенеза псориаза. К сожалению, о полном излечении пока речи нет, но современные терапевтические подходы позволяют приостановить развитие заболевания и достичь ремиссии.
Чаще всего псориаз контролируют с помощью следующих подходов (рис. 1):
- лекарственной терапии (глюкокортикоиды, аналоги витаминов D и А, цитостатики, антитела к цитокинам, ингибиторы провоспалительных ферментов);
- фототерапии (УФ-лучи самостоятельно или в сочетании с молекулами, повышающими их эффективность).
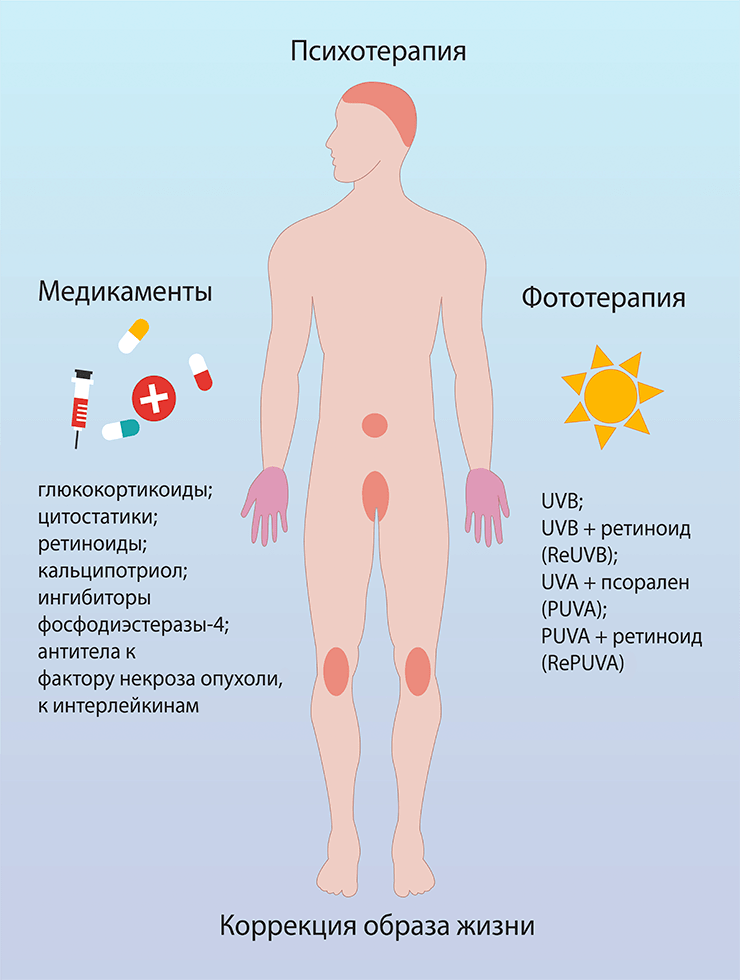
Рисунок 1. Лечение псориаза
Глюкокортикоиды
Гормоны из группы глюкокортикостероидов входят в число антипсориатических препаратов первой линии, то есть тех, с которых лечение начинают. Эти гормоны сокращенно называют глюкокортикоидами, кортикостероидами или даже просто стероидами, хотя последнее не совсем корректно. Название этой группы гормонов отражает их принадлежность к стероидам — веществам, главной и системообразующей молекулой которых является циклопентанопергидрофенантрен. Знаменитые «стероиды» бодибилдеров тоже содержат эту молекулу. К глюкокортикоидам относят лишь те стероиды, что способны повышать уровень глюкозы в крови. Термин же «кортикостероиды» очерчивает круг стероидов, происходящих исключительно из коркового слоя, или кортекса, надпочечников.
Природные гормоны из надпочечников животных — кортизон и гидрокортизон (кортизол) — были выделены еще в первой половине XX века. Благодаря широкому спектру действия на разные процессы в организме (общий обмен веществ, водно-электролитный обмен и др.) их применяли для лечения различных заболеваний. Затем появилась возможность усовершенствовать их путем химического синтеза — чтобы они действовали сильнее и прицельнее. Так появились:
- преднизолон, в четыре раза превосходящий кортизол по глюкокортикоидной (влияющей на обмен глюкозы) активности;
- флудрокортизон, превосходящий кортизол не только по глюкокортикоидной, но и по минералокортикоидной активности;
- бетаметазон, в 25 раз превосходящий кортизол по глюкокортикоидной активности и не влияющий на водно-солевой обмен; структура вещества позволяет применять его местно на коже и слизистых.
Хотя эти гормоны давно известны, ученые лишь приоткрыли завесу тайны над молекулярными основами их действия. Известно, что они проникают внутрь клетки и соединяются со специальными внутриклеточными глюкокортикоидными рецепторами. Комплекс гормон—рецептор транспортируется в ядро, где взаимодействует с участками ДНК GRE (glucocorticoid response elements) в промоторах ряда генов, регулируя таким образом их активность. Стероиды, в частности, контролируют экспрессию генов таких факторов транскрипции, как активаторный белок 1 (AP-1) и ядерный фактор каппа-би (NF-kB). А они, в свою очередь, регулируют работу генов цитокинов, молекул адгезии, протеиназ и других веществ, участвующих в иммунном ответе и воспалении [5].
Глюкокортикоиды — мощные иммуносупрессоры и регуляторы воспаления. На иммунную систему они действуют неизбирательно, вмешиваясь в работу чуть ли не всех ее звеньев. В частности, они влияют на дифференцировку и/или функции макрофагов, нейтрофилов, моноцитов, Т- и В-лимфоцитов. При псориазе глюкокортикоиды оказывают противовоспалительное действие за счет угнетения синтеза простагландинов, лейкотриенов и цитокинов, уменьшения проницаемости кровеносных сосудов для клеток и жидкости, снижения хемотаксиса иммунокомпетентных клеток и их активности, а также подавления активности фибробластов.
Для лечения псориаза кортикостероиды назначают как наружно (мази, кремы, лосьоны, крело — что-то среднее между кремом и лосьоном), так и внутрь (таблетки, растворы и суспензии для инъекций); выбор препарата и его лекарственной формы зависит от стадии и степени тяжести заболевания. Из-за побочных действий этих препаратов их назначение внутрь стараются отложить настолько, насколько это возможно.
Парацельс, известный врач эпохи Ренессанса, утверждал, что лекарство и яд различает лишь доза. Справедливо это и для глюкокортикоидов: при длительном и/или неадекватном их применении повышается риск побочных эффектов. В связи с тем, что эти гормоны влияют на все виды обмена — углеводный, белковый, жировой и минеральный, — злоупотребление ими серьезно нарушает множество процессов в организме. Например, они стимулируют глюконеогенез (образование глюкозы из неуглеводных веществ) в печени, увеличивают концентрацию глюкозы в крови, что может вести к «стероидному» сахарному диабету. По симптомам он схож с сахарным диабетом II типа: постепенное развитие мышечной слабости и зуда кожи, нарушение зрения, изменения нервов и сосудов. Влияние на белковый обмен характеризуется угнетением синтеза и ускорением распада белков, что особенно выражено в коже, мышцах и костях и ведет к атрофии кожи и мышц, замедлению заживления ран. Влияние на обмен жиров заключается в расщеплении жира в тканях конечностей и его накоплении в туловище и лице: формируется так называемое лунообразное лицо.
Однако перечисленные нежелательные эффекты проявляются при применении глюкокортикоидов внутрь. Их нанесение на небольшие участки кожи позволяет избежать системных реакций, хотя и не делает местное применение абсолютно безопасным. Чаще всего при длительном наружном использовании сильных глюкокортикоидов могут наблюдаться телеангиэктазии (расширенные мелкие сосуды), атрофия (истончение) кожи, стероидное акне (прыщи на лице и теле), стрии (растяжки кожи) и кожные инфекции. Если переусердствовать с нанесением сильных гормональных мазей на большие участки кожи, то можно получить и системные побочные эффекты [6].
При всех несомненных преимуществах глюкокортикоидов перед другими лекарствами по части эффективности и доступности, их можно сравнить с дубиной, которой мы лупим по иммунной системе и обмену веществ. Ниже мы обсудим лекарства, более тонко регулирующие иммунные механизмы.
Производные витаминов
Витамины А и D, включая их синтетические варианты, способны подавлять проявления псориаза. Эти вещества связываются с ядерными рецепторами (и по совместительству транскрипционными факторами) RARγ/RXR и VDR/RXR, активируя экспрессию ряда генов, ответственных за дифференцировку и пролиферацию клеток. Один из таких генов кодирует особый цитокин — тимический стромальный лимфопоэтин (TSLP, thymic stromal lymphopoietin), который заставляет антигенпредставляющие дендритные клетки воспитывать Th2- и регуляторные (Treg) клетки в ущерб Th1-клеткам. Мы помним из статьи [2], что для псориаза характерна повышенная активность Th1 и Th17 при сниженной активности Th2 и Treg. Соответственно, предполагалось, что А/D-витаминные средства, активируя синтез TSLP в кератиноцитах и других клетках, могут корректировать этот дисбаланс и уменьшать Th1/Th17-опосредованное аутоиммунное воспаление. Но всё оказалось сложнее: TSLP модулирует иммунные реакции по-разному в зависимости от условий. Гомеостатическую и, вероятно, терапевтическую роли играет короткая изоформа TSLP, в то время как длинная образуется в патологических условиях, включая псориатические бляшки. Активный синтез TSLP с последующим «иммунным перекосом» в сторону Th2-звена провоцирует аллергическое воспаление, характерное для атопического дерматита и астмы. А в воспалительной среде, характерной для псориаза, TSLP (по косвенным данным, длинная форма) с помощью CD40L запускает патологическую IL-23/IL-17-сигнализацию [7], [8]. Поэтому в лечении можно было бы использовать ингибиторы длинной формы TSLP и стимуляторы синтеза короткой (либо ее саму).
Роль TSLP в патогенезе и терапии псориаза еще предстоит уточнить, но в то же время очевидно, что антипсориатические эффекты витаминов A и D обусловлены изменением транскрипции многих других генов — регуляторов дифференцировки и пролиферации клеток [1]. (Здесь я должен принести извинения читателю за весьма скудное понимание исследователями как причин, так и механизмов действия лекарств от некоторых кожных болезней.)
Ретиноиды
К ретиноидам в широком смысле слова причисляют витамин А (ретинол) и его биологически активные производные. Но в медицине так принято называть группу синтетических производных витамина А, служащих для лечения определенных болезней, а не восполнения витаминодефицита. Кожные заболевания с их помощью успешно лечат уже более 40 лет.
Чаще других для лечения псориаза используют ацитретин — ретиноид второго поколения. Как и любой другой препарат этой группы, он подавляет избыточный клеточный рост и кератинизацию — главные характеристики псориатической кожи.
Точный механизм действия ацитретина неизвестен. Судя по всему, ацитретин связывается с рецепторами ретиноевой кислоты — активного метаболита витамина А, образующегося в кератиноцитах, — и запускает характерную для нее сигнализацию [9]. Как это происходит, и почему влияет на течение псориаза, показано на рисунке 2.
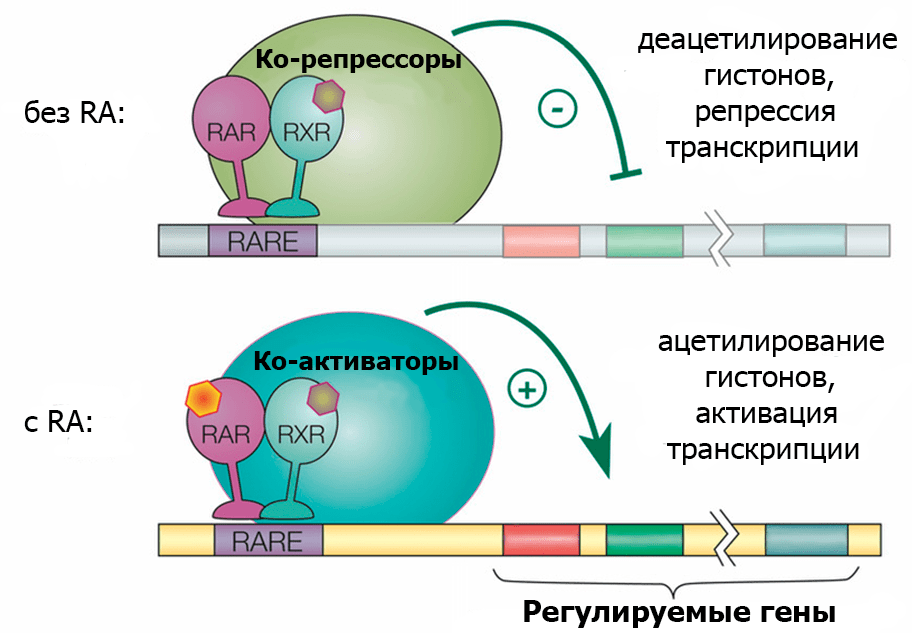
Рисунок 2. Принцип работы ретиноидных рецепторов (на примере связывания ретиноевой кислоты). За восприятие ретиноидных сигналов в клетке отвечают ядерные рецепторы семейства RAR (retinoic acid receptors, RARα–γ). RAR образует пару с другой рецепторной молекулой, RXR (retinoid X receptors, RXRα–γ), и этот комплекс взаимодействует с особыми нуклеотидными последовательностями — RARE (RA response elements) — в регуляторных областях ряда генов. Это взаимодействие модулирует активность многих генов, контролирующих рост, деление и дифференцировку клеток. Несвязанная с ретиноевой кислотой (RA) или другим лигандом пара RAR—RXR, взаимодействуя с RARE, чаще всего подавляет экспрессию близлежащих генов, потому что привлекает ко-репрессоры: они конденсируют хроматин так, что считывание наследственной информации в этом участке становится невозможным. Если же с RAR связана RA, то к такому RARE устремляются активаторы экспрессии генов, «расслабляющие» хроматин для посадки компонентов транскрипционной машины. Ретиноидная сигнализация нормализует структуру эпидермиса путем стимуляции клеточной дифференцировки и эксфолиации.
Хотя ацитретин демонстрирует высокую эффективность при псориазе, заранее сложно сказать, как долго пациенту нужно будет принимать препарат и насколько стойкую ремиссию он даст. Прием ацитретина может сопровождаться нежелательными реакциями, порой непереносимыми: фоточувствительностью, истончением и шелушением кожи по всему телу, хрупкостью ногтей, болями в костях и мышцах, тошнотой и др. Препарат противопоказан при нарушениях работы почек и печени, а из-за тератогенного эффекта — и при беременности. Более того, планировать беременность или становиться донором крови можно не менее чем через три года после завершения терапии. Из-за всех этих ограничений вопрос о назначении системных ретиноидов и их преимуществах перед другими лечебными подходами решается строго индивидуально [10].
Кальципотриол (кальципотриен)
Под таким мудреным названием скрывается синтетический аналог витамина D, а именно — его активной формы, кальцитриола. Эффективность кальципотриола была случайно обнаружена при лечении больных остеопорозом, которые также страдали и от псориаза [11]. Точный механизм действия препарата при псориазе не установлен. Известно, что благодаря своему химическому строению кальципотриол взаимодействует с рецепторами витамина D (VDR), но, в отличие от последнего, на обмен кальция влияет незначительно. Рецептор витамина D представлен в различных клетках, включая лимфоциты и кератиноциты; он относится к семейству стероидных рецепторов и работает чаще в виде гетеродимера с уже знакомым нам RXR. Одна часть VDR взаимодействует с лигандом, другая — с участками VDRE (vitamin D response elements) в промоторах регулируемых генов [12]. Далее события развиваются по аналогичному с ретиноидной регуляцией сценарию. Некоторые мутации VDR связаны с предрасположенностью к псориазу, да и дефицит VDR-сигнализации любой природы может иметь патогенетическое значение при этом заболевании.
При местном использовании кальципотриола у мышей и людей выявили дозозависимое повышение секреции кератиноцитами иммуномодулятора TSLP, причем у людей — его короткой формы (у мышей она не синтезируется) [8], [13].
Вообще, эффекты витамина D множественны, связаны не только с TSLP-сигнализацией и не до конца объяснены. При псориазе же важнее всего то, что в терапевтических дозах он:
- смещает баланс Th1+Th17/Th2-влияний в пользу последних, подавляя синтез Th1/Th17- и ряда других провоспалительных цитокинов, в числе которых IL-2, IFN-γ, TNF, IL-17, IL1β. В то же время активнее размножаются и вырабатывают цитокины клетки Th2, повышается уровень противовоспалительного IL-10, который подавляет активность Th1 и дендритных клеток;
- способствует дифференцировке и иммуносупрессивной активности регуляторных Т-клеток. Витамин D здесь может действовать через посредников — дендритные клетки;
- ограничивает избыточную пролиферацию Т-клеток и кератиноцитов, провоцируя их дифференцировку и апоптоз, а также снижает избыточную продукцию псориазина, которая нарушает дифференцировку кератиноцитов [14], [15];
- предохраняет от вторичных инфекций, стимулируя макрофагальный фагоцитоз [16].
При использовании мази, крема или раствора кальципотриола лечебный эффект появляется в течение двух недель. Существуют препараты, содержащие и кальципотриол, и глюкокортикоид: такая комбинация действует сильнее. Несмотря на все положительные стороны кальципотриола, его не стόит наносить на обширные участки пораженной кожи (более 30%), так как через нее в кровь может проникнуть избыточное количество лекарства, а это грозит повышением содержания кальция в крови и отложением его солей в почках [17].
Цитостатические препараты
Или просто цитостатики. Это противоопухолевые препараты, нарушающие процессы роста и размножения клеток, особенно быстро делящихся. Очевидно, что чаще всего их применяют для уничтожения злокачественных опухолей. Но поскольку при псориазе кератиноциты, подстегиваемые большим количеством иммунных клеток и цитокинов, делятся как угорелые, для его лечения тоже предложили использовать цитостатики, а точнее — метотрексат, циклоспорин и такролимус. Последние два препарата к этой группе относят не всегда, так как они всё же больше влияют на функции, чем на деление чувствительных клеток. Зато все три препарата можно назвать иммуносупрессорами.
Метотрексат относится к группе антиметаболитов — молекул, которые похожи по химической структуре на вещества, родные для нашего организма, и потому могут занять их место в биохимических процессах и привести к нарушению клеточных функций. Это всё равно что заменить одно из автомобильных колес колесом того же диаметра, но от велосипеда: вроде, всё то же, но далеко не уедешь.
Метотрексат активен в отношении быстро пролиферирующих клеток (в том числе клеток кожи), находящихся в S-фазе клеточного цикла (рис. 3). Но с этим связано и его губительное действие на костный мозг, слизистые оболочки желудочно-кишечного тракта и мочевыводящих путей [6], [18]. Универсальный механизм его работы таков. Для синтеза ДНК организму необходима тетрагидрофолиевая кислота, которая образуется с помощью фермента дигидрофолатредуктазы. Метотрексат блокирует работу этого фермента, притворяясь его субстратом, дигидрофолатом. Кроме того, он ингибирует и другие ферменты, необходимые для синтеза нуклеотидов. В результате подавляются синтез и репарация ДНК, нарушается митоз. Описаны и более специфические механизмы влияния метотрексата на активность лимфоцитов [19].
Деликатнее работает иммуносупрессор циклоспорин. Более 40 лет назад его выделили из почвенных грибков и чуть позже дали на вооружение врачам, которые начали его применять для лечения псориаза. Циклоспорин избирательно блокирует фосфатазную активность кальциневрина в фазах G0 или G1 клеточного цикла T-лимфоцитов. Этот фермент активирует (дефосфорилирует) транскрипционные факторы NFAT, необходимые для синтеза IL-2, IFN-γ и других цитокинов — факторов роста и созревания Т-лимфоцитов [20]. Циклоспорин также мешает экспрессии генов IL-3, IL-4, IL-5, гранулоцитарно-макрофагального колониестимулирующего фактора и TNF. Говоря проще, этот препарат борется с воспалением, обусловленным активацией Т-клеток. Но важно отметить, что он не блокирует синтез цитокинов лимфоцитами раз и навсегда. При снижении его концентрации всё возвращается на круги своя. Более того, в отличие от метотрексата, циклоспорин не подавляет гемопоэз, а в отличие от глюкокортикоидов, не парализует сразу большинство иммунных процессов. Тем не менее его иммуносупрессивного действия хватает для повышения у пациентов риска развития инфекций, паразитарных инвазий и опухолей (особенно лимфом и злокачественных новообразований кожи).
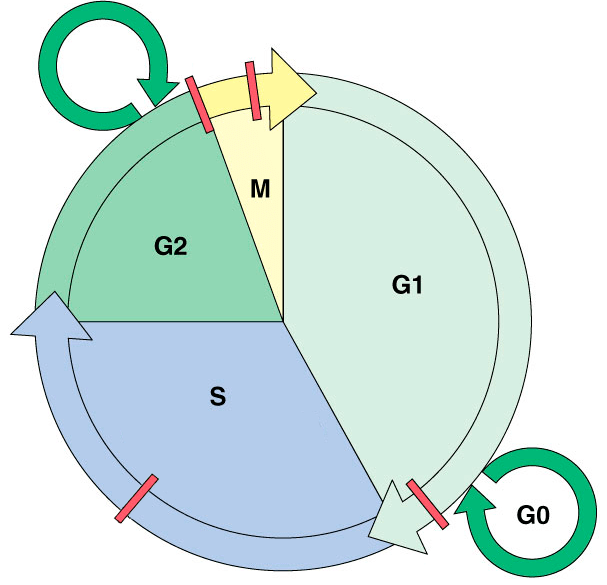
Рисунок 3. Клеточный цикл. M — митоз (деление клетки); S — синтетическая фаза (репликация ДНК); G1 и G2 (Gap 1/2) — пре- и постсинтетическая фазы; G0 — выход из клеточного цикла (временный/постоянный). Красные прямоугольники — контрольные точки (checkpoints) клеточного цикла.
Другой ингибитор кальциневрина — такролимус — можно применять местно. Этот макролид, производимый стрептомицетами, подавляет активность Т-лимфоцитов так же, как и циклоспорин. Помимо этого такролимус тормозит высвобождение медиаторов воспаления из эозинофилов, базофилов и тучных клеток (тканевых базофилов). Клетки Лангерганса под его влиянием меньше экспрессируют FcεRI (высокоаффинный поверхностный рецептор иммуноглобулина Е), что подавляет их активность и презентацию антигенов Т-лимфоцитам. Такролимус — хорошая альтернатива местным глюкокортикоидам, поскольку он не нарушает синтез коллагена и не вызывает атрофии кожи. К побочным эффектам препарата можно отнести повышение вероятности возникновения кожных инфекций, зуд, отеки и фоточувствительность. Однозначных данных о повышении риска злокачественных новообразований кожи на фоне применения такролимуса пока нет [21], [22].
Ингибиторы фактора некроза опухоли
Фактор некроза опухоли альфа (TNF-α, или просто TNF) считают главным инициатором воспаления. В пораженной псориазом коже TNF секретируют Т-клетки и дендритные клетки. Он стимулирует синтез провоспалительных цитокинов IL-1, IL-2, IL-6, IL-8 и IFN-γ, вызывает экспрессию молекул адгезии на стенках кровеносных сосудов, способствуя привлечению иммуноцитов из кровяного русла в кожу, стимулирует производство кератиноцитами других медиаторов воспаления, активирует макрофаги, дендритные и Т-клетки.
Для ингибирования TNF применяют моноклональные антитела (инфликсимаб, адалимумаб) и гибридные белки (этанерцепт) [5], [23].
Моноклональные антитела — антитела, произведенные одним клоном клеток, берущим свое начало от одной плазматической клетки. Соединяясь с белком или другим антигеном, к которому они имеют сродство, антитела мешают ему выполнять свои функции. Лекарства из этой группы носят очень странные названия, оканчивающиеся на «-маб» (monoclonal antibody). А буквы перед «-маб» позволяют понять происхождение этих молекул: «-омабы» — полностью мышиные, «-ксимабы» — химерные, «-зумабы» — гуманизированные, «-умабы» — полностью человеческие антитела . Моноклональные антитела к TNF (рис. 4) влияют на иммунные реакции, которые изменяют уровень молекул адгезии, ответственных за миграцию лейкоцитов к очагам воспаления. Инфликсимаб вводится внутривенно, адалимумаб — подкожно.
Для препаратов, зарегистрированных после июня 2017 года, этот принцип упразднили, потому что с развитием биотехнологии появилось много комбинированных вариантов антител и возникла проблема выбора более подходящего названия [45]. — Ред.
Среди новых (применительно к обыкновенному псориазу) молекул можно выделить цертолизумаб пэгол. Это гуманизированный ПЭГилированный Fab-фрагмент антитела к TNF. Связывание с ПЭГ снижает иммуногенность, улучшает распределение в пораженных тканях и продляет жизнь молекулы в кровяном русле, а отсутствие Fc-фрагмента человеческого IgG1 меняет ее профиль цитотоксичности и затрудняет проникновение через плаценту, что может дать цертолизумабу преимущество перед одногруппниками в лечении беременных [24]. В фазе III клинических исследований препарат в дозировке 200 мг не уступил по эффективности этанерцепту, а в дозировке 400 мг — превзошел его, причем без ухудшения переносимости [25].
Гибридный белок этанерцепт действует немного иначе — как ловушка для TNF. Дело в том, что существуют два типа рецепторов TNF: рецепторы на лейкоцитах, соединение TNF с которыми запускает иммунный ответ, и растворимые рецепторы, циркулирующие в кровяном русле, которые оттягивают на себя TNF и тем самым уменьшают иммунный ответ. Как раз под последние и «подделывается» этанерцепт (рис. 4), но, благодаря Fc-фрагменту человеческого IgG1, он может дольше находиться в кровяном русле и дольше оставаться эффективным.
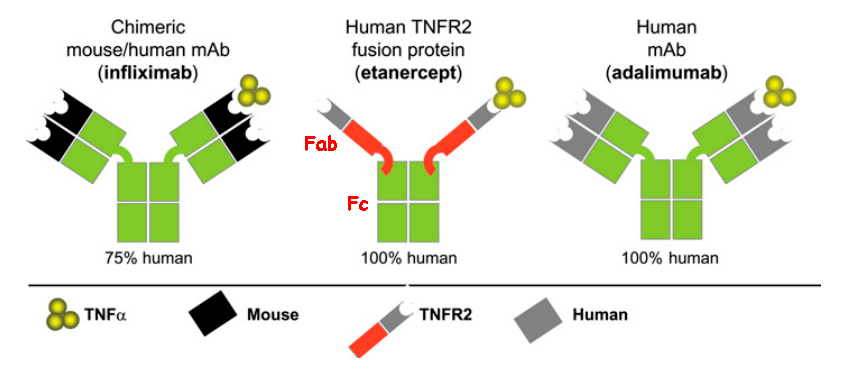
Рисунок 4. Примеры блокаторов TNF. Инфликсимаб — химерное (мышино-человеческое) моноклональное антитело к TNF. Адалимумаб — полностью человеческое моноклональное антитело. Этанерцепт — гибрид, состоящий из двух растворимых рецепторов TNF (p75) и Fc-фрагмента человеческого IgG1. Fab — антигенсвязывающий фрагмент антитела.
Одним из молекулярных механизмов терапевтического действия TNF-ингибиторов может быть перестройка эпигенетических процессов. Например, в ходе лечения этанерцептом или адалимумабом в крови частично корректируются метильные профили ДНК, меняется продукция десятков типов микроРНК [4].
Поскольку TNF участвует во множестве биологических процессов, подавление его сигнализации не может быть безобидным. Ингибиторы TNF иммуногенны (их эффективность со временем падает из-за выработки антител к ним), противопоказаны в случае тяжелых инфекций (например, туберкулеза) и могут провоцировать частые инфекции кожи и слизистых, хотя по этому пункту ученые ведут споры, ежегодно публикуя обширные статистические работы как в поддержку [26], так и в опровержение этого [27].
Ингибиторы интерлейкинов
Ингибиторы интерлейкинов фактически действуют так же, как и ингибиторы TNF, и тоже представляют собой моноклональные антитела, но связываются они уже с интерлейкинами. Поскольку популяция клеток Тh17 играет ключевую роль в возникновении псориаза, а цитокин IL-17 специфичен для иммуноопосредованных воспалительных заболеваний (псориаза, болезни Крона, ревматоидного артрита и др.), моноклональные антитела к IL-17 бьют по цели точнее, чем ингибиторы TNF. С IL-17А взаимодействуют секукинумаб и иксекизумаб, а с рецептором IL-17 — бродалумаб.
Моноклональные антитела к субъединицам IL-12 и/или IL-23 тоже эффективно подавляют деятельность Тh17 и Тh1. В эту группу препаратов входят широко известный устекинумаб и относительно недавно одобренная к применению в США и Евросоюзе молекула гуселькумаб [28].
Поскольку ингибиторов интерлейкинов появляется всё больше, приходится регулярно сравнивать их эффективность. Так, одно из исследований 2018 года выстроило препараты по мере снижения эффективности в таком порядке: иксекизумаб и бродалумаб → секукинумаб → устекинумаб [29]. Однако препараты могут проявлять разную эффективность при разных исходных данных, таких как возраст, форма и тяжесть псориаза, сопутствующие болезни и др. А эти исследования им только предстоит пройти.
Моноклональные антитела к интерлейкинам произвели революцию в лечении псориаза, но, к сожалению, эти лекарства отличает очень высокая цена. Поэтому, несмотря на высокую эффективность в клинических исследованиях, они пока остаются малодоступными для широкого круга больных. Нежелательные реакции при применении этой группы препаратов и ингибиторов TNF схожи [27], [30].
Исследователи не ограничились существующим набором молекул и продолжают поиск более эффективных и при этом не менее безопасных. Или не менее эффективных, но более безопасных и/или экономически выгодных. Недавно завершилась фаза 2b клинических исследований новой гуманизированной молекулы — бимекизумаба [31]. Она блокирует сразу две разновидности интерлейкина-17 — IL-17A и IL-17F. Если сравнивать с традиционной блокировкой IL-17A, такая двойная нейтрализация сильнее подавляет экспрессию провоспалительных генов и миграцию иммунных клеток. К 2020 году должна завершиться III фаза клинических исследований бимекизумаба, с бóльшим числом участников, продленным сроком лечения и секукинумабом в качестве контрольного препарата.
Ингибиторы фосфодиэстеразы-4
Фосфодиэстераза-4 (PDE4) — это основная фосфодиэстераза, регулирующая обмен циклического аденозинмонофосфата (цАМФ) в иммунных клетках. Высокая концентрация цАМФ в клетках приводит к депонированию кальция, направлению активности ферментов и цитокиновой сигнализации в сторону подавления воспаления: выработка TNF, IL-23, IL-17 снижается, а IL-10 — повышается. PDE4 разрушает цАМФ, чем стимулирует воспаление, а потому служит одной из терапевтических мишеней при псориазе.
Показано, что апремиласт ингибирует PDE4, что в конечном счете ведет к ослаблению воспалительной реакции. Преимуществом апремиласта считают то, что он подавляет воспаление на более раннем этапе, чем моноклональные антитела к TNF (инфликсимаб, адалимумаб), IL-12/23 (устекинумаб) или IL-17A (секукинумаб, иксекизумаб) [32].
Из нежелательных реакций при приеме апремиласта чаще всего фиксируют расстройства пищеварения и инфекции дыхательных путей [33]. Эффективность апремиласта оценивают лишь к концу первого полугодия лечения, что в сочетании с его высокой стоимостью и доступностью более дешевых противопсориатических препаратов говорит не в пользу его назначения.
Сводная схема таргетированных терапевтических воздействий на основные звенья патогенеза псориаза приведена на рисунке 5. Если говорить о сравнительной эффективности ингибиторов TNF, интерлейкинов и PDE4, то крупное исследование 2018 года показало, что с помощью ингибиторов интерлейкинов или инфликсимаба можно избавиться от псориатических бляшек быстрее, чем с помощью этанерцепта, адалимумаба или апремиласта. Инфликсимаб проигрывает ингибиторам интерлейкинов по двум параметрам: его нужно вводить внутривенно, и на фоне его применения чаще развиваются инфекционные заболевания [29].
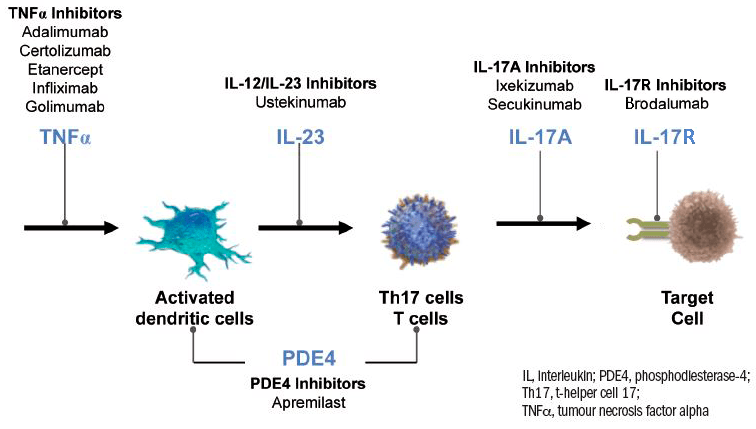
Рисунок 5. Патогенетическая терапия псориаза. Объяснения даны в тексте.
Фототерапия
В борьбе с псориазом часто задействуют и физические факторы, а именно — ультрафиолетовое (УФ) излучение. Облучение пораженных участков кожи УФ определенной длины волны (UVА, UVB) называют фототерапией. UVB-терапия может быть широкополосной (280–320 нм) и узкополосной средневолновой (NB-UVB, 311 нм). Второму варианту практически идентична UVB-терапия, проводимая эксимерным лазером (308 нм). Эта группа методов не требует применения каких-либо специальных медикаментов и не противопоказана даже детям.
UVА-терапию чаще используют в виде модификации PUVA — облучения длинноволновым УФ (320–400 нм) с применением фотосенсибилизаторов из группы псораленов. Фотосенсибилизаторы — это вещества, повышающие чувствительность клеток к воздействию УФ. Они могут применяться перорально или наружно, в том числе в виде псораленовых ванн. Из-за повышенной (относительно UVB-терапии) канцерогенности к PUVA прибегают при тяжелых формах псориаза, его прогрессии и в случае неэффективности других средств.
Фототерапия может действовать на течение псориаза несколькими способами, которые обычно делят на четыре категории: индукция апоптоза, изменение цитокиновой сигнализации, иммуносупрессия, прочие механизмы (см. врезку) [34]. Однако эти эффекты во многом взаимосвязаны и взаимообусловлены.
Выбор лечебного подхода
Любой лечебный подход преследует три главных цели: уменьшение баллов PASI (индекса охвата и тяжести псориаза), повышение качества жизни и максимальная продолжительность ремиссии. Достичь этих целей можно только под руководством грамотного врача, который обязан учитывать многообразие эффектов лечебного агента, особенности его метаболизма [3] и возможное взаимодействие с другими лекарственными средствами.
В лечении псориаза, как и большинства заболеваний, всё очень и очень индивидуально. То, что работает у одного, другому может абсолютно не подойти. Тем не менее врачи разработали общую стратегию ведения пациентов с псориазом (рис. 7).
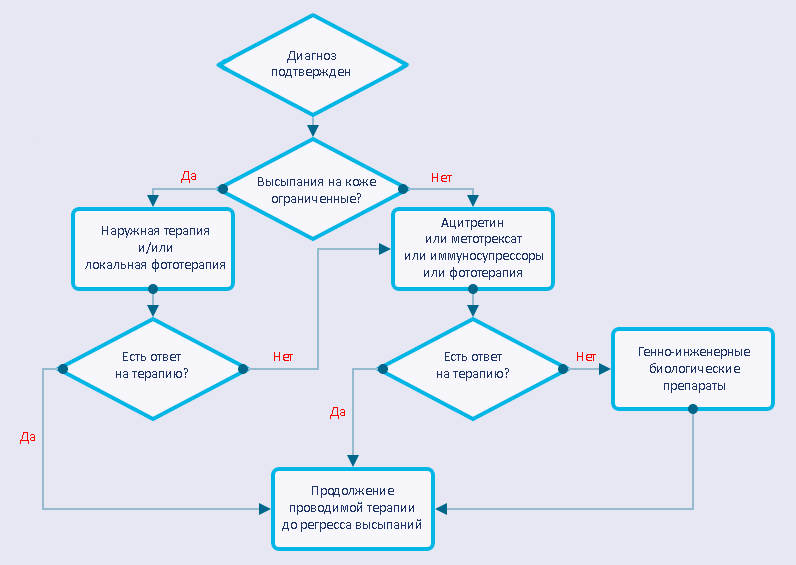
Рисунок 7. Стандартный алгоритм ведения пациента с подтвержденным диагнозом «псориаз»
Выбор того или иного лечебного подхода определяется степенью тяжести псориаза. А объективным критерием тяжести псориаза, принятым в большинстве стран мира, служит PASI. При значении индекса до 10 псориаз считается легким, от 10 до 20 — средней тяжести, более 20 — тяжелым. У большинства пациентов PASI не превышает 10, и в таких случаях ограничиваются наружным лечением. Превышение 10 баллов служит показанием для назначения метотрексата, циклоспорина и ацитретина [40]. В некоторых случаях целесообразно комбинировать метотрексат или ацитретин с фототерапией (UVВ, PUVA), что позволяет одновременно снизить дозировку препаратов, частоту побочных эффектов и канцерогенный потенциал фототерапии [41], [42]. В случае неэффективности, непереносимости побочных эффектов или при противопоказаниях к применению перечисленных подходов прибегают к биологическим препаратам (моноклональным антителам).
Вносить свою лепту в тяжесть болезни и длительность ремиссии могут и вспомогательные, немедикаментозные подходы. Обычно врачи рекомендуют снижение уровня стресса, соблюдение диеты, климатотерапию (курорты с сероводородными, кремнистыми и радоновыми водами) и применение увлажняющих средств.
Заключение
Даже если просто просмотреть заголовки в этой статье, станет ясно: разнообразие видов терапии псориаза настолько велико, что позволяет более-менее индивидуализировать лечение. Но ни один из существующих подходов не лишен недостатков, порой весьма серьезных.
Псориаз — одна из самых распространенных кожных болезней, которая до сих пор окружена множеством загадок и сильно влияет на жизнь больных. Поэтому пациенты с этим диагнозом больше, чем многие другие страдающие хроническими воспалительными заболеваниями, могут рассчитывать на изобретение той самой «волшебной таблетки» (а скорее, нескольких), которая наконец заставит забыть о недуге навсегда. В последние годы новая информация о патогенезе, генетике и эпигенетике псориаза появляется особенно быстро. Это позволяет постепенно переходить от неизбирательной «тяжелой артиллерии» к специфичным средствам, бьющим по конкретным звеньям патогенеза. Каждый год в мире синтезируются новые молекулы, но лишь единицы из них, пройдя длинный путь проверок безопасности и эффективности, достигают организма больного. При этом каждый новый одобренный препарат хоть в чём-то превосходит старые, приближая нас к моменту, когда псориаз станет очередной побежденной болезнью в истории медицины.
- Псориаз: на войне с собственной кожей;
- Псориаз: Т-хелперы, цитокины и молекулярные шрамы;
- Генетика псориаза: иммунитет, барьерная функция кожи и GWAS;
- Эпигенетика псориаза: молекулярные отметины судьбы;
- Karow T. Allgemeine und Spezielle Pharmakologie und Toxikologie. Verlag: Dr. med. Thomas Karow, 2012. — 1275 p.;
- Кубанова А.А., Кисина В.И., Блатун Л.А., Вавилов А.М. и др. Рациональная фармакотерапия заболеваний кожи и инфекций, передаваемых половым путем: Рук. для практикующих врачей / под общ. ред. Кубановой А.А., Кисиной В.И. М.: «ЛитТерра», 2005. — 890 с.;
- Elisabetta Volpe, Lucia Pattarini, Carolina Martinez-Cingolani, Stephan Meller, Marie-Helene Donnadieu, et. al.. (2014). Thymic stromal lymphopoietin links keratinocytes and dendritic cell–derived IL-23 in patients with psoriasis. Journal of Allergy and Clinical Immunology. 134, 373-381.e4;
- Katerina Tsilingiri, Giulia Fornasa, Maria Rescigno. (2017). Thymic Stromal Lymphopoietin: To Cut a Long Story Short. Cellular and Molecular Gastroenterology and Hepatology. 3, 174-182;
- Ferdinand Marlétaz, Linda Z. Holland, Vincent Laudet, Michael Schubert. (2006). Retinoic acid signaling and the evolution of chordates. Int. J. Biol. Sci.. 38-47;
- United States pharmacopeia dispensing information. Drug information for the health care professional. 24th ed. V. 1.plus updates. Thomson/Micromedex. Greenwood Village, CO, 2004. — p. 21;
- Morimoto S. and Kumahara Y. (1985). A patient with psoriasis cured by 1-α-hydroxyvitamin D3. Med. J. Osaka Univ. 35 (3–4), 51–54;
- Igor Orlov, Natacha Rochel, Dino Moras, Bruno P Klaholz. (2012). Structure of the full human RXR/VDR nuclear receptor heterodimer complex with its DR3 target DNA. The EMBO Journal. 31, 291-300;
- M. Li, P. Hener, Z. Zhang, S. Kato, D. Metzger, P. Chambon. (2006). Topical vitamin D3 and low-calcemic analogs induce thymic stromal lymphopoietin in mouse keratinocytes and trigger an atopic dermatitis. Proceedings of the National Academy of Sciences. 103, 11736-11741;
- Ananya Datta-Mitra, Suravi Raychaudhuri, Anupam Mitra. (2014). Immunomodulatory mechanisms of action of calcitriol in psoriasis. Indian J Dermatol. 59, 116;
- A Ekman, J Vegfors, C Eding, C Enerbäck. (2017). Overexpression of Psoriasin (S100A7) Contributes to Dysregulated Differentiation in Psoriasis. Acta Derm Venerol. 97, 441-448;
- Luigi Barrea, Maria Cristina Savanelli, Carolina Di Somma, Maddalena Napolitano, Matteo Megna, et. al.. (2017). Vitamin D and its role in psoriasis: An overview of the dermatologist and nutritionist. Rev Endocr Metab Disord. 18, 195-205;
- Дерматовенерология. Клинические рекомендации / под ред. Кубановой А.А. М.: «ДЭКС-Пресс», 2010. — 428 с.;
- Биохимия: Учеб. для вузов / под ред. Северина Е.С. М.: «ГЭОТАР-Медиа», 2003. — 779 с.;
- J. A. M. Wessels, T. W. J. Huizinga, H.-J. Guchelaar. (2007). Recent insights in the pharmacological actions of methotrexate in the treatment of rheumatoid arthritis. Rheumatology. 47, 249-255;
- Satoshi Matsuda, Shigeo Koyasu. (2000). Mechanisms of action of cyclosporine. Immunopharmacology. 47, 119-125;
- T.C. Lucka, D. Pathirana, A. Sammain, F. Bachmann, S. Rosumeck, et. al.. (2012). Efficacy of systemic therapies for moderate-to-severe psoriasis: a systematic review and meta-analysis of long-term treatment. Journal of the European Academy of Dermatology and Venereology. 26, 1331-1344;
- Alan Menter, Neil J. Korman, Craig A. Elmets, Steven R. Feldman, Joel M. Gelfand, et. al.. (2009). Guidelines of care for the management of psoriasis and psoriatic arthritis. Journal of the American Academy of Dermatology. 61, 451-485;
- Róbert Kui, Brigitta Gál, Magdolna Gaál, Mária Kiss, Lajos Kemény, Rolland Gyulai. (2016). Presence of antidrug antibodies correlates inversely with the plasma tumor necrosis factor (TNF)-α level and the efficacy of TNF-inhibitor therapy in psoriasis. J Dermatol. 43, 1018-1023;
- Enrique Soriano, Maria Laura Acosta Felquer, Javier Rosa. (2016). An evidence-based review of certolizumab pegol in the treatment of active psoriatic arthritis: place in therapy. OARRR. 37;
- Mark Lebwohl, Andrew Blauvelt, Carle Paul, Howard Sofen, Jolanta Węgłowska, et. al.. (2018). Certolizumab pegol for the treatment of chronic plaque psoriasis: Results through 48 weeks of a phase 3, multicenter, randomized, double-blind, etanercept- and placebo-controlled study (CIMPACT). Journal of the American Academy of Dermatology. 79, 266-276.e5;
- Allison S. Dobry, Charles P. Quesenberry, G. Thomas Ray, Jamie L. Geier, Maryam M. Asgari. (2017). Serious infections among a large cohort of subjects with systemically treated psoriasis. Journal of the American Academy of Dermatology. 77, 838-844;
- André Vicente Esteves de Carvalho, Rodrigo Pereira Duquia, Bernardo Lessa Horta, Renan Rangel Bonamigo. (2017). Efficacy of Immunobiologic and Small Molecule Inhibitor Drugs for Psoriasis: A Systematic Review and Meta-Analysis of Randomized Clinical Trials. Drugs R D. 17, 29-51;
- Kristian Reich, April W. Armstrong, Peter Foley, Michael Song, Yasmine Wasfi, et. al.. (2017). Efficacy and safety of guselkumab, an anti-interleukin-23 monoclonal antibody, compared with adalimumab for the treatment of patients with moderate to severe psoriasis with randomized withdrawal and retreatment: Results from the phase III, double-blind, placebo- and active comparator–controlled VOYAGE 2 trial. Journal of the American Academy of Dermatology. 76, 418-431;
- Anne M. Loos, Shanshan Liu, Celia Segel, Daniel A. Ollendorf, Steven D. Pearson, Jeffrey A. Linder. (2018). Comparative effectiveness of targeted immunomodulators for the treatment of moderate-to-severe plaque psoriasis: A systematic review and network meta-analysis. Journal of the American Academy of Dermatology. 79, 135-144.e7;
- Agnieszka Wasilewska, Marta Winiarska, Małgorzata Olszewska, Lidia Rudnicka. (2016). Interleukin-17 inhibitors. A new era in treatment of psoriasis and other skin diseases. pdia. 4, 247-252;
- Kim A. Papp, Joseph F. Merola, Alice B. Gottlieb, Christopher E.M. Griffiths, Nancy Cross, et. al.. (2018). Dual neutralization of both interleukin 17A and interleukin 17F with bimekizumab in patients with psoriasis: Results from BE ABLE 1, a 12-week randomized, double-blinded, placebo-controlled phase 2b trial. Journal of the American Academy of Dermatology. 79, 277-286.e10;
- Stacy L. Haber, Sarah Hamilton, Mark Bank, Shi Yun Leong, Evelyn Pierce. (2016). Apremilast. Ann Pharmacother. 50, 282-290;
- Kim Papp, Jennifer C Cather, Les Rosoph, Howard Sofen, Richard G Langley, et. al.. (2012). Efficacy of apremilast in the treatment of moderate to severe psoriasis: a randomised controlled trial. The Lancet. 380, 738-746;
- Tami Wong, Leon Hsu, Wilson Liao. (2013). Phototherapy in Psoriasis: A Review of Mechanisms of Action. J Cutan Med Surg. 17, 6-12;
- S. Haupt. (2003). Apoptosis — the p53 network. Journal of Cell Science. 116, 4077-4085;
- Terrence C. Keaney, Robert S. Kirsner. (2010). New Insights into the Mechanism of Narrow-Band UVB Therapy for Psoriasis. Journal of Investigative Dermatology. 130, 2534;
- Chih-Hung Lee, Shi-Bei Wu, Chien-Hui Hong, Hsin-Su Yu, Yau-Huei Wei. (2013). Molecular Mechanisms of UV-Induced Apoptosis and Its Effects on Skin Residential Cells: The Implication in UV-Based Phototherapy. IJMS. 14, 6414-6435;
- Olga María Palomino. (2015). Current knowledge in Polypodium leucotomos effect on skin protection. Arch Dermatol Res. 307, 199-209;
- Chih-Hung Lee, Shi-Bei Wu, Chien-Hui Hong, Hsin-Su Yu, Yau-Huei Wei. (2013). Molecular Mechanisms of UV-Induced Apoptosis and Its Effects on Skin Residential Cells: The Implication in UV-Based Phototherapy. IJMS. 14, 6414-6435;
- U. Mrowietz, E.M.G.J. de Jong, K. Kragballe, R. Langley, A. Nast, et. al.. (2014). A consensus report on appropriate treatment optimization and transitioning in the management of moderate-to-severe plaque psoriasis. J Eur Acad Dermatol Venereol. 28, 438-453;
- John Koo, Mio Nakamura. (2017). Combing Phototherapy with Acitretin: Re-PUVA and Re-UVB. Clinical Cases in Phototherapy. 113-118;
- Heba M. Mashaly, Marwa F. Hussein, Shaimaa Hamdy, Olfat Shaker. (2017). Evaluation of carcinogenic risk of PUVA versus Re-PUVA in psoriatic patients. Journal of the Egyptian Womenʼs Dermatologic Society. 14, 106-110;
- Jacquelyn J. Bower, Leah D. Vance, Matthew Psioda, Stephanie L. Smith-Roe, Dennis A. Simpson, et. al.. (2017). Patterns of cell cycle checkpoint deregulation associated with intrinsic molecular subtypes of human breast cancer cells. npj Breast Cancer. 3;
- Cristina Russo, Riccardo Polosa. (2005). TNF-α as a promising therapeutic target in chronic asthma: a lesson from rheumatoid arthritis. Clin. Sci.. 109, 135-142;
- Paul W. H. I. Parren, Paul J. Carter, Andreas Plückthun. (2017). Changes to International Nonproprietary Names for antibody therapeutics 2017 and beyond: of mice, men and more. mAbs. 9, 898-906.
Псориаз (чешуйчатый лишай) — хроническое, весьма
распространенное заболевание кожи, известное с давних времен.
Распространенность его в различных странах колеблется от 0,1 до 3%.
Однако эти цифры отражают лишь удельный вес псориаза у больных с
другими дерматозами или частоту его встречаемости у пациентов с
внутренними болезнями. Поскольку болезнь часто носит локализованный и
неактивный характер, больные обычно не обращаются за помощью в
медицинские учреждения, а следовательно, нигде не регистрируются.
Причина болезни остается неясной. Несмотря на огромное количество
предлагаемых гипотез, ни одна не является общепризнанной. Четко
установлена лишь роль генетических факторов — семейный показатель
больных в несколько раз превышает популяционный. Есть указания на связь
псориаза с антигенами HLA-cистемы — В13, В15, В16, В17, В27, В39, Dw11,
DRW6, DR7, A1. Имеются данные о возможной патогенетической значимости
генетических маркеров Lewis, MN, Ss, Duffy, Hp.
Основным патогенетическим звеном, вызывающим появление кожных
высыпаний, являются повышенная митотическая активность и ускоренная
пролиферация клеток эпидермиса, приводящая к тому, что клетки нижних
слоев «выталкивают» вышележащие клетки, не дав им ороговеть. Этот
процесс носит название паракератоза и сопровождается обильным
шелушением. Большое значение в развитии псориатических поражений в коже
играют местные иммунопатологические процессы, связанные с
взаимодействием различных цитокинов — фактора некроза опухоли,
интерферонов, интерлейкинов, а также лимфоцитов различных субпопуляций.
Пусковым моментом возникновения болезни часто является сильный
стресс — этот фактор присутствует в анамнезе большинства больных. К
другим триггерным факторам можно отнести травмы кожи, применение
медикаментов, злоупотребление алкоголем, инфекции.
Многочисленные нарушения в эпидермисе, дерме и во всех системах
организма тесно связаны и не могут по отдельности объяснить механизм
развития болезни.
Общепринятой классификации псориаза нет. Традиционно наряду с
обычным (вульгарным) псориазом выделяют эритродермическую,
артропатическую, пустулезную, экссудативную, каплевидную,
ладонно-подошвенную формы.
Обычный псориаз клинически проявляется образованием плоских папул,
четко отграниченных от здоровой кожи. Папулы розовато-красного цвета,
покрыты рыхлыми серебристо-белыми чешуйками. С диагностической точки
зрения интересна группа признаков, возникающих при поскабливании папул
и называемых псориатической триадой. Сначала появляется феномен
«стеаринового пятна», характеризующийся усилением шелушения при
поскабливании, что придает поверхности папул сходство с каплей
стеарина. После удаления чешуек наблюдается феномен «терминальной
пленки», проявляющийся в виде влажной блестящей поверхности элементов.
Вслед за этим при дальнейшем поскабливании отмечается феномен «кровяной
росы» — в виде точечных, несливающихся капелек крови.
Высыпания могут располагаться на любом участке кожного покрова, но
преимущественно локализуются на коже коленных и локтевых суставов и
волосистой части головы, с поражения которой очень часто заболевание
начинается. Для псориатических папул характерна склонность к
периферическому росту и слиянию в бляшки различных размеров и
очертаний. Бляшки могут быть изолированными, небольшими или крупными,
занимающими обширные участки кожных покровов.
При экссудативном псориазе меняется характер шелушения — чешуйки
становятся желтовато-сероватыми, склеиваются с образованием корочек,
плотно прилегающих к коже. Сами высыпания более яркие и отечные, чем
при обычном псориазе.
Псориаз ладоней и подошв может наблюдаться в виде изолированного
поражения или сочетаться с поражениями других локализаций. Проявляется
он в виде типичных папуло-бляшечных элементов, а также
гиперкератотических, мозолеподобных очагов с болезненными трещинами или
пустулезных высыпаний.
Практически всегда при псориазе поражаются ногтевые пластинки.
Наиболее патогномоничным считается появление на ногтевых пластинках
точечных вдавлений, придающих ногтевой пластинке сходство с наперстком.
Также могут отмечаться разрыхление ногтей, ломкость краев, изменение
окраски, поперечные и продольные борозды, деформации, утолщение,
подногтевой гиперкератоз.
Псориатическая эритродермия является одной из наиболее тяжелых форм
псориаза. Она может развиваться за счет постепенного прогрессирования
псориатического процесса и слияния бляшек, но чаще возникает под
влиянием нерационального лечения. При эритродермии вся кожа приобретает
ярко-красный цвет, становится отечной, инфильтрированной, отмечается
обильное шелушение. Больных беспокоит сильный зуд, ухудшается общее
состояние.
Рентгенологически различные изменения костно-суставного аппарата
наблюдаются у большинства больных без клинических признаков поражения
суставов. К таким изменениям относят околосуставной остеопороз, сужение
суставных щелей, остеофиты, кистозные просветления костной ткани.
Диапазон клинических проявлений может варьировать от незначительных
артралгий до развития инвалидизирующего анкилозирующего артроза.
Клинически обнаруживаются припухлость суставов, покраснение кожи в зоне
пораженных суставов, болезненность, ограничение подвижности, деформации
суставов, анкилозы, мутиляции.
Пустулезный псориаз проявляется в виде генерализованных или
ограниченных высыпаний, локализованных преимущественно на коже ладоней
и подошв. Хотя ведущим симптомом этой формы псориаза считается
возникновение на коже пустул, считающихся в дерматологии проявлением
гнойничковой инфекции, содержимое этих пузырьков обычно стерильно.
Каплевидный псориаз чаще развивается у детей и сопровождается
внезапным высыпанием рассеянных по всему кожному покрову мелких
папулезных элементов.
Псориаз наблюдается примерно с одинаковой частотой у мужчин и
женщин. У большинства пациентов заболевание начинает развиваться до 30
лет. У многих больных отмечается связь обострений с временем года: чаще
заболевание обостряется в холодный период (зимняя форма), гораздо реже
— летом (летняя форма). В дальнейшем эта зависимость может меняться.
В течении псориаза различают 3 стадии: прогрессирующую, стационарную
и регрессирующую. Для прогрессирующей стадии характерны рост по
периферии и появление новых высыпаний, особенно на местах прежних
высыпаний (изоморфная реакция Кебнера). В регрессирующей стадии
наблюдается уменьшение либо исчезновение инфильтрации по окружности или
в центре бляшек.
Вульгарный псориаз дифференцируют от парапсориаза, вторичного
сифилиса, красного плоского лишая, дискоидной красной волчанки,
себорейной экземы. Сложности возникают при дифференциальной диагностике
ладонно-подошвенного и артропатического псориаза.
При вульгарном псориазе прогноз для жизни благоприятный. При
эритродермии, артропатическом и генерализованном пустулезном псориазе
возможны инвалидизация и даже летальный исход из-за истощения и
развития тяжелых инфекций.
Неопределенным прогноз остается в отношении продолжительности
заболевания, длительности ремиссии и обострений. Высыпания могут
существовать длительно, многие годы, но чаще обострения чередуются с
периодами улучшения и клинического выздоровления. У значительной части
больных, в особенности не подвергавшихся интенсивному системному
лечению, возможны многолетние, самопроизвольные периоды клинического
выздоровления.
Нерациональное лечение, самолечение, обращение к «целителям»
ухудшают течение болезни, приводят к обострению и распространению
кожных высыпаний. Именно поэтому основная цель данной статьи — дать
краткую характеристику современным методам лечения этой болезни.
Сегодня существует огромное количество методов лечения псориаза, в
терапии этого заболевания используются тысячи различных препаратов.
Ноэто лишь означает, что ни один из методов не дает гарантированного
эффекта и не позволяет вылечить болезнь окончательно. Более того,
вопрос об излечении и не ставится — современная терапия в состоянии
лишь свести к минимуму кожные проявления, не затрагивая многих
неизвестных на сегодня патогенетических факторов.
Лечение псориаза проводится с учетом формы, стадии, степени
распространенности высыпаний, общего состояния организма. Как правило,
лечение комплексное, предусматривающее сочетание наружных и системных
препаратов.
Большое значение при лечении имеют мотивация пациента, семейные
обстоятельства, социальное положение, образ жизни, злоупотребление
алкоголем.
Способы лечения можно разделить на следующие направления: наружная
терапия, системная терапия, физиотерапия, климатотерапия,
нетрадиционные и народные методы.
Наружная терапия
Терапия препаратами наружного действия имеет при псориазе важнейшее
значение. В легких случаях лечение начинают с местных мероприятий и ими
ограничиваются. Как правило, препараты для местного применения реже
оказывают какие-либо побочные действия, но по эффективности уступают
системной терапии.
В прогрессирующей стадии наружное лечение проводят с большой
осторожностью, чтобы не вызвать ухудшения состояния кожи. Чем
интенсивнее воспаление, тем меньшей должна быть концентрация мазей.
Обычно на этой стадии при лечении псориаза ограничиваются кремом
«Унна», 0,5–2% салициловой мазью, травяными ваннами.
На стационарной и регрессирующей стадии показаны более активные
препараты — 5–10% нафталановая мазь, 2–10% мазь АСД, 2–5% салициловая
мазь, 2–5% серно-дегтярная мазь, а также многие другие способы терапии.
В современных условиях при выборе способа терапии или конкретного
препарата врач должен руководствоваться официальными протоколами и
формулярами, разработанными руководящими органами здравоохранения. В
Федеральном руководстве по использованию лекарственных средств (выпуск
IV) для местного лечения больных псориазом предлагаются стероидные
лекарственные средства, салициловая мазь, препараты дегтя и
кальципотриол.
Исходя из «Методических материалов по диагностике и лечению наиболее
распространенных инфекций, передаваемых половым путем, и заболеваний
кожи», разработанных ЦНИКВИ в 2001 г., в качестве наружной терапии
используют 1–2% салициловую мазь, мази с содержанием дегтя 5–10%,
нафталана 5–10%, витамина Д3, а также кортикостероидные мази
(бетаметазон с салициловой кислотой, мометазон) и аэрозоль цинка
пиритионата. В «Протоколах ведения больных», разработанных учеными
ЦНИКВИ в 2003 г., рекомендуются те же препараты.
Остановимся в основном на указанных в руководствах препаратах.
Гидратитрующие средства. Смягчают шелушащуюся поверхность
псориатических элементов, уменьшают стягивание кожи, улучшают
эластичность. Используют кремы на основе ланолина с витаминами, крем
«Унна». По данным литературы, даже после такого легкого воздействия
клинические эффекты (снижение зуда, эритемы и шелушения) достигаются у
трети больных.
Препараты салициловой кислоты. Обычно используют мази с
концентрацией от 0,5 до 5% салициловой кислоты. Она обладает
антисептическим, противовоспалительным, кератопластическим и
кератолитическим действием, может применяться в комбинации с дегтем и
кортикостероидами. Салициловая мазь размягчает шелушащиеся слои
псориатических элементов, а также усиливает действие местных стероидов
путем усиления их всасывания, поэтому часто используется в комбинации с
ними. Сама салициловая кислота легко проникает в кожу и затем в кровь.
Поэтому ее не применяют на обширных поверхностях и в концентрации
больше 2%, а у детей даже 2-процентную мазь накладывают только на
ограниченных участках кожи. Непереносимость встречается редко, однако
салициловая кислота может вызывать в качестве побочного эффекта
усиление воспаления кожи.
Дегтярные препараты. Применяются издавна в виде 5–15% мазей и
паст, часто в сочетании с другими местными препаратами. В России
используются мази с древесным дегтем (обычно березовым), в некоторых
зарубежных странах — с каменноугольным. Последний более активен, но,
как считают наши ученые, обладает канцерогенными свойствами, хотя
многочисленные публикации и зарубежный опыт не подтверждают этого.
Деготь превосходит салициловую кислоту по активности, обладает
противовоспалительными, кератопластическими и антиэксфолиативными
свойствами. Его применение при псориазе обусловлено, кроме того,
влиянием на клеточную пролиферацию. Применение дегтярных препаратов
ограничено из-за неприятного запаха, их нельзя накладывать на лицо.
Комбинации дегтя с цинком или салициловой кислотой не обладают
значительными преимуществами перед монокомпонентными препаратами дегтя.
Способность дегтя повышать фоточувствительность используется для
комбинированной терапии в сочетании с ультрафиолетовым облучением. Не
следует применять препараты дегтя длительно и в повышенной
концентрации, так как это может привести к всасыванию и системному
действию (поражение почек, общая интоксикация, паралич). При назначении
препаратов дегтя следует учитывать его фотосенсибилизирующее действие и
риск ухудшения функции почек у лиц с нефрологическими болезнями.
Для мытья головы используют шампуни с дегтем (фридерм-тар, Т/гель).
Нефть нафталанская. Смесь углеводородов и смол, содержит серу,
фенол, магний и много других веществ. Препараты нафталанской нефти
обладают противовоспалительными, рассасывающими, противозудными,
антисептическими, отшелушивающими и репарационными свойствами. Для
лечения псориаза применяются 10–30% нафталановые мази и пасты. Часто
нафталанская нефть используется в комбинации с серой, ихтиолом, борной
кислотой, цинковой пастой.
Местная терапия ретиноидами. Первый эффективный местно
применяемый ретиноид, разрешенный к употреблению как средство для
лечения псориаза, — тазаротен. В России этот препарат пока не
зарегистрирован. Он представляет собой желе на водной основе и
выпускается в концентрации 0,05 и 0,1%. По эффективности он сравним с
сильнодействующими ГКС. Из побочных эффектов отмечаются зуд и
раздражение кожи. Одним из преимуществ этого препарата является более
продолжительная по сравнению с ГКС ремиссия. Так, по данным J. Koo,
через 3 мес после лечения рецидив наблюдали только у 185 больных (после
флуоцинонида — у 55%). В работе A. Marchetti показаны
фармакоэкономические преимущества тазаротена в виде 0,1% геля в
сравнении с мазью флуоцинонида (местный ГКС) и кальципотриена
(разновидность витамина Д3 для местного использования).
Гидрантроны. В первой половине XX в. применялись мази со смесью
естественных дериватов антрацена — хризаробином, который получали из
стволов бразильского дерева Vonacopua araroba семейства бобовых.
В настоящее время в Европе и США используются синтетические гидроксиантроны — дитранол, антралин, цигнолин, антраробин.
Дитранол — аналог естественного хризаробина, оказывает
цитотоксическое и цитостатическое действие, приводит к снижению
активности окислительных и гликолитических процессов в эпидермисе. В
результате уменьшаются количество митозов в эпидермисе, а также
гиперкератоз и паракератоз. К сожалению, дитранол обладает выраженным
местно-раздражающим действием, и при попадании на здоровую кожу могут
возникать ожоги. С другой стороны, дитранол очень эффективен и не
вызывает системных побочных эффектов. Несколько лет назад в Европе
появились препараты, которые высвобождают дитранол только при
температуре кожи человека (миканол). В результате ослабляется
окрашивание кожи. Сегодня дитранол применяют в достаточно высоких
концентрациях (>1%), нанося его на 5–30 минут. Этот способ не
уступает по эффективности применению препарата в низких концентрациях
на ночь. По данным литературы, средняя ремиссия при лечении дитранолом
составляет 4 – 6 мес.
Российские специалисты редко используют препараты этой группы, в
России они не производятся и за рубежом не закупаются. Ранее
предлагались несколько препаратов этой группы — цигнодерм, дитрастик,
псоракс. Они выпускаются в виде стержня, наподобие губной помады.
Добавление парафина позволяет наносить препараты точно на область
поражения, что особенно удобно при лечении ограниченных, застарелых
очагов.
К препаратам этой группы можно отнести антралин, который применяется
в европейских и американских лечебных центрах. Препарат тормозит синтез
ДНК ядра и митохондрий, угнетает метаболизм в тканях, что приводит к
снижению пролиферации. При использовании сильно окрашивает
контактируемые поверхности, может вызывать раздражения и ожоги.
Производные иприта.
К ним относятся псориазин и антипсориатикум. В их состав входят
вещества кожно-нарывного действия — иприт и трихлорэтиламин. Лечение
этими препаратами проводят с большой осторожностью, применяя сначала
мази с небольшой концентрацией на небольшие очаги поражения 1 раз в
день. Затем при хорошей переносимости концентрацию, площадь и кратность
при использовании увеличивают. Лечение осуществляют под тщательным
врачебным контролем, проводя еженедельные тесты крови и мочи. Сейчас
данные препараты практически не применяются, однако они весьма
эффективны в стационарной стадии болезни.
Цинка пиритионат. Активное вещество, выпускаемое в виде
аэрозолей, кремов и шампуней под торговым названием «Скин-кап».
Обладает противомикробным, противогрибковым, а также
антипролиферативным действием — подавляет патологический рост клеток
эпидермиса, находящихся в состоянии гиперпролиферации. Последнее
свойство определяет эффективность препарата при псориазе. Препарат
снимает воспаление, уменьшает инфильтрацию и шелушение псориатических
элементов. Лечение проводят в среднем в течение месяца. Для терапии
больных с поражениями волосистой части головы используют аэрозоль и
шампунь, при поражениях кожи — аэрозоль и крем. Препарат наносят 2 раза
в сутки, шампунь применяют 3 раза в неделю. В России начиная с 1995 г.
проводилось изучение клинической эффективности и переносимости всех
лекарственных форм цинка пиритионата. По заключению ведущих
дерматологических центров — ЦНИКВИ, РГМУ, ММА, ВМА — эффективность
препарата при лечении больных псориазом достигает 85–90%. Исходя из
данных, опубликованных в периодической печати ведущими специалистами
этих и других центров, клинического излечения удается добиться к концу
3–4 нед лечения. Эффект развивается постепенно, но очень важно, что
результаты лечения очевидны уже к концу первой недели с момента начала
применения препарата — резко снижается зуд, устраняется шелушение,
бледнеет эритема. Такое быстрое достижение клинического эффекта
приводит, соответственно, к быстрому улучшению качества жизни
пациентов. Препарат хорошо переносится. Разрешен для применения с 3-
летнего возраста.
Мази с витамином Д3. С 1987 г. при местном лечении используется синтетический препарат витамина Д3
— кальципотриол. Многочисленными экспериментальными исследованиями
показано, что кальципотриол вызывает торможение пролиферации
кератиноцитов, ускоряет их морфологическую дифференциацию, воздействует
на факторы иммунной системы кожи, регулирующие пролиферацию клеток,
обладает противовоспалительными свойствами. На российском рынке
представлены 3 препарата данной группы от различных производителей.
Препараты наносят на пораженные участки кожи 1-2 раза в сутки.
Эффективность мазей с Д3 примерно соответствует эффекту
кортикостероидных мазей I, II классов, а по данным J. Koo — даже III
класса. При применении этих мазей выраженный клинический эффект
наступает у большинства больных (до 95%). Однако для достижения
хорошего эффекта может понадобиться достаточно много времени (от 1 мес
до 1 г.), а площадь поражения не должна превышать 40%. И. В. Хамаганова
сообщает о положительном опыте применения кальципотриола у детей.
Препарат наносили 2 раза в день, выраженный эффект наблюдался к концу
четвертой недели лечения. Побочных эффектов не выявлено. О таких же
результатах лечения при использовании кальципотриола у взрослых
сообщает В. А. Самсонов.
Иногда при использовании кальципотриола могут наблюдаться
раздражение кожи, дерматит, фотосенсибилизация, обострение
псориатического процесса, гиперкальциемия. Однако кальципотриол не
вызывает побочных эффектов, характерных для стероидов, и иногда дает
более стойкий эффект, чем мази с ГКС. Хотя, по данным того же J. Koo,
рецидивы возникают у более 50% больных, при этом средняя
продолжительность ремиссии не превышает 1,5 мес.
Более выраженных эффектов достигают при сочетанном применении
кальципотриола с любыми формами фототерапии, а также с системной
терапией.
Кортикостероидные препараты. Применяются в медицинской практике
в качестве наружных средств с 1952 г., когда Sulzberger впервые показал
эффективность наружного применения стероидов. На сегодняшний день на
российском фармацевтическом рынке зарегистрированы около 50
глюкокортикостероидных средств для наружного применения. Это,
несомненно, затрудняет выбор врача, который должен иметь информацию обо
всех препаратах. Специальное анкетирование, проведенное Н. Г.
Кочергиным среди дерматологов, показало, что при выборе средств для
наружной терапии врачи исходят из следующих данных: активности кожного
процесса, локализации высыпаний, возраста больного, эффективности
рекламы и стоимости препарата в аптеке. К наиболее часто назначаемым
при псориазе ГКС, по данным того же опроса, относятся комбинированные
препараты (флуметазона пивалат с салициловой кислотой), мометазона
фуроат или бетаметазона дипропионат.
Терапевтический эффект наружных ГКС обусловлен целым рядом потенциально благоприятных эффектов:
- противовоспалительным действием (сужением сосудов, разрешением воспалительного инфильтрата);
- эпидермостатическим (антигиперпластическим влиянием на клетки эпидермиса);
- антиаллергическим;
- местным аналгезирующим действием (устранением зуда, жжением, болезненностью, чувством стягивания).
Изменение структуры ГКС отражалось на их свойствах, активности. Так
появилась достаточно обширная группа препаратов, различающихся по
своему химическому строению и активности. Гидрокортизона ацетат сегодня
при псориазе практически не применяется, его используют в клинических
исследованиях для сравнения со вновь получаемыми препаратами. Например,
считается, что если активность гидрокортизона принять за единицу, то
активность триамцинолона ацетонида составит 21 единицу, а бетаметазона
— 24 единицы. Из препаратов второго класса при псориазе чаще
используется флуметазона пивалат в комбинации с салициловой кислотой, а
наиболее современными являются нефторированные ГКС. В связи с
минимальным риском возникновения побочных явлений мази и кремы с
аклометазоном разрешены для применения на чувствительных участках
(лицо, кожные складки), лечения детей и пожилых людей, при нанесении на
обширные участки кожи.
Среди препаратов третьего класса можно выделить группу фторированных
ГКС — флуоцинолона ацетонид, триамцинолона ацетонид, бетаметазона
валерат и дипропионат. Фармакоэкономический анализ применения этих
препаратов (правда, не при псориазе), заключающийся в изучении
соотношения «цена/безопасность/эффективность», по данным В. А.
Аковбяна, выявил благоприятные показатели у бетаметазона валерата —
быстрое развитие терапевтического эффекта, более низкая стоимость курса
лечения.
При лечении псориаза начинать следует с более легких препаратов —
гидрокортизона, преднизолона, аклометазона, а при повторных обострениях
и неэффективности используемых препаратов давать более сильные. Однако
среди американских дерматологов популярна следующая тактика: вначале
применяется сильный ГКС для достижения быстрого эффекта, а потом
пациента переводят на умеренный или слабый препарат для проведения
поддерживающей терапии. В любом случае сильные препараты используют
короткими курсами и лишь на ограниченные участки, так как при их
назначении чаще развиваются побочные эффекты.
Помимо указанной классификации, препараты подразделяют на
фторированные, дифторированные и нефторированные средства разных
поколений. Нефторированные ГКС первого поколения (гидрокортизона
ацетат) по сравнению с фторированными, как правило, менее эффективны,
но более безопасны в отношении побочных реакций. Сейчас проблема низкой
эффективности нефторированных ГКС уже решена — созданы нефторированные
препараты четвертого поколения, сравнимые по силе с фторированными, а
по безопасности — с гидрокортизона ацетатом. Это, в частности,
гидрокортизона бутират, мометазона фуроат, метилпреднизолона ацепонат.
Проблема усиления действия препарата решается не путем галогенизации, а
благодаря этерификации. Кроме усиления действия это позволяет
использовать этерифицированные препараты 1 раз в сутки. К примеру,
гидрокортизона бутират имеет следующие фармакодинамические свойства:
торможение миграции лейкоцитов и лимфоцитов в область воспаления,
угнетение протеолитической активности тканевых кининов, задержка роста
фибробластов, предупреждение развития соединительной ткани в очаге
воспаления. Именно нефторированные ГКС четвертого поколения являются
сегодня предпочтительными для местного применения при псориазе.
Стандартные побочные эффекты при применении местных стероидов — это
развитие атрофии кожи, гипертрихоза, телеангиэктазий, гнойничковых
инфекций, системное действие с влиянием на
гипоталамо-гипофизарно-надпочечниковую систему. В современных
нефторированных препаратах, упомянутых выше, эти побочные эффекты
сведены к минимуму.
Фармацевтические компании стараются разнообразить спектр
лекарственных форм и выпускают ГКС в виде мазей, кремов, лосьонов.
Жирная мазь, создавая пленку на поверхности очага поражения, вызывает
более эффективное рассасывание инфильтрации, чем другие лекарственные
формы. Крем лучше купирует островоспалительные явления, увлажняет,
охлаждает кожу. Безжировая основа лосьона обеспечивает его легкое
распределение по поверхности волосистой части головы без склеивания
волос.
По литературным данным, при использовании, например, мометазона в
течение 3 нед положительного терапевтического эффекта (уменьшения
количества высыпаний на 60–80%) удается добиться почти у 80% больных.
По данным В. Ю. Уджуху, наиболее выгодного соотношения
«эффективность/безопасность» можно достичь при использовании
гидрокортизона бутирата. Выраженный клинический эффект при применении
этого препарата сочетается с хорошей переносимостью — ни у одного из
прошедших курс лечения больных авторы не наблюдали побочных реакций,
даже при нанесении на лицо. При длительном использовании других ГКС
приходилось останавливать лечение из-за развития побочных эффектов. По
данным B. Bianchi и Н. Г. Кочергина, сравнение результатов клинического
применения мометазона фуората и метилпреднизолона ацепоната показало
одинаковую эффективность этих лекарственных средств при наружном
применении. Ряд авторов (Е. Р. Аравийская, Е. В. Соколовский)
предлагают этапную кортикостероидную терапию псориаза. Рекомендуется
начинать наружную терапию с комбинированных препаратов, содержащих ГКС
(например, бетаметазон и салициловую кислоту). Средняя
продолжительность такого лечения — около 3 нед. В дальнейшем происходит
переход на чистый ГКС, желательно третьего класса (например,
гидрокортизона бутират или мометазона фуроат).
Больных привлекают простота использования стероидных препаратов,
возможность достаточно быстро снять клиническую симптоматику
заболевания, доступность, отсутствие запаха. Кроме того, эти
лекарственные средства не оставляют жирных пятен на одежде. Однако их
применение должно быть кратковременным, во избежание ухудшения течения
болезни. При длительном применении стероидных мазей развивается
привыкание. Резкая отмена кортикостероидов может вызвать обострение
кожного процесса. В литературе указывается разная длительность ремиссии
после местного лечения кортикостероидами. Большинство работ
свидетельствует о непродолжительной ремиссии — от 1 до 6 мес.
Исследования R. Seville установили, что ГКС в комбинации с другими
методами (в частности, с дитранолом) повышают эффективность лечения, но
уменьшают длительность ремиссии. Пациентам нужно рекомендовать как
можно дольше обходиться без применения кортикостероидных мазей. Во
многих зарубежных источниках мази, содержащие глюкокортикостероидные
гормоны, рекомендуют предпочтительно использовать на ограниченных
открытых участках поверхности кожи — лицо, руки. Однако следует помнить
об опасности развития на лице стероидного периорального дерматита или
розацеа, особенно при применении фторированных ГКС.
При псориазе наиболее эффективны комбинации стероидных гормонов
(чаще всего бетаметазона) с салициловой кислотой. Салициловая кислота
благодаря своему кератолитическому и противомикробному действию
дополняет дерматотропную активность стероидов.
На волосистую часть головы удобно наносить комбинированные лосьоны с
кортикостероидами и салициловой кислотой. По данным отечественных
авторов (Г. И. Суколин, В. А. Молочков, Н. С. Потекаев), эффективность
комбинированных препаратов достигает 80 — 100%, при этом очищение кожи
происходит очень быстро —в течение 3 нед.
Подводя итоги, следует сказать, что на практике врачу всегда
необходимо решать, использовать ли только наружные методы лечения или
назначать их в сочетании с какой-либо системной терапией в целях
повышения эффективности лечения и удлинения ремиссии.
Ю. Н. Перламутров, доктор медицинских наук, профессор
А. М. Соловьев, кандидат медицинских наук
МГМСУ, Москва
Пантаза-лф: инструкция по применению
Форма выпуска: Таблетки
Цены в аптеках: Минск
Уточняйте
Содержание
- Описание
- Фармакотерапевтическая группа
- Показания к применению
- Противопоказания
- Способ применения и дозы
- Побочное действие
- Передозировка
- Меры предосторожности
- Взаимодействие с другими лекарственными средствами
- Условия хранения
- Срок годности
- Упаковка
- Условия отпуска
Описание
Круглые таблетки, желтовато-бежевого цвета, двояковыпуклой формы, покрытые оболочкой.
Состав:
Каждая таблетка содержит:
Активное вещество: пантопразол (в виде пантопразола натрия сесквигидрата) – 20 мг или 40 мг;
Вспомогательные вещества: натрия карбонат безводный, кальция стеарат, кросповидон, повидон (К-17), маннитол.
Состав оболочки: Аквариус Преферед® желтый (гипромеллоза, коповидон пласдон, полидекстроза, полиэтиленгликоль, триглицерид каприловой/каприновой кислоты, титана диоксид Е-171, оксид железа желтый Е-172); Акрил-ИЗ® бесцветный (сополимер метакриловой кислоты и этилакрилата, тальк, макрогол/ПЭГ, кремния диоксид коллоидный безводный, натрия гидрокарбонат, натрия лаурилсульфат), симетикон.
Фармакотерапевтическая группа
Противоязвенные средства и средства, применяемые при гастроэзофагеальной рефлюксной болезни. Ингибиторы протонного насоса.
Код ATX: А02ВС02.
Показания к применению
Лекарственное средство Пантаза-ЛФ 20 мг применяется для краткосрочного лечения симптомов рефлюкса (например, изжога, кислая отрыжка) у взрослых.
Лекарственное средство Пантаза-ЛФ 40 мг применяется при следующих показаниях:
Взрослые и дети 12 лет и старше:
-рефлюкс-эзофагит.
Взрослые:
эрадикация Helicobacter pylori в составе комбинированной терапии с антибактериальными средствами;
язва желудка или двенадцатиперстной кишки;
синдром Золлингера–Эллисона и другие патологические состояния, связанные с повышенной желудочной секрецией.
Если у Вас возникли сомнения или вопросы, проконсультируйтесь с лечащим врачом.
Цены в аптеках Минск
Препарат отсутствует в продаже
Аналоги
Нольпаза, таблетки, 40 мг ×14
покрытые кишечнорастворимой оболочкой, КРКА, Словения • Без рецепта
Омез, капсулы, 40 мг ×28
Др. Редди`с, Индия • Без рецепта
Омез, капсулы, 10 мг ×30
Др. Редди`с, Индия • Без рецепта
Нольпаза, таблетки, 20 мг ×14
покрытые кишечнорастворимой оболочкой, КРКА, Словения • Без рецепта
Нольпаза, таблетки, 40 мг ×28
покрытые кишечнорастворимой оболочкой, КРКА, Словения • Без рецепта
Нольпаза, таблетки, 20 мг ×28
покрытые кишечнорастворимой оболочкой, КРКА, Словения • Без рецепта
Омез, капсулы, 20 мг ×30
Др. Редди`с, Индия • Без рецепта
Обобщенные научные материалы по действующему веществу препарата Пантаз (таблетки, покрытые кишечнорастворимой оболочкой, 40 мг)
Дата последней актуализации: 15.02.2021
Особые отметки:
Содержание
- Действующее вещество
- ATX
- Владелец РУ
- Условия хранения
- Срок годности
- Источники информации
- Фармакологическая группа
- Фармакология
- Показания к применению
- Нозологическая классификация (МКБ-10)
- Противопоказания
- Применение при беременности и кормлении грудью
- Побочные действия
- Взаимодействие
- Передозировка
- Способ применения и дозы
- Меры предосторожности
- Аналоги (синонимы) препарата Пантаз
- Заказ в аптеках Москвы
Действующее вещество
ATX
Владелец РУ
Медлей Фармасьютикалз
Условия хранения
В сухом месте, при температуре не выше 25 °C.
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не применять по истечении срока годности, указанного на упаковке.
Источники информации
www.fda.gov и www.rxlist.com, 2021.
Фармакологическая группа
Фармакология
Ингибитор протонного насоса.
Механизм действия
Пантопразол — ингибитор протонного насоса, который подавляет заключительную стадию продуцирования соляной кислоты путем ковалентного связывания с ферментной системой H+,K+-АТФазой на секреторной поверхности париетальных клеток желудка. Этот эффект приводит к подавлению как базальной, так и стимулированной секреции соляной кислоты, независимо от раздражителя. Результатом связывания с H+,K+-АТФазой является продолжительный антисекреторный эффект, который сохраняется более 24 ч для всех исследованных доз (от 20 до 120 мг).
Фармакодинамика
Антисекреторная активность
В условиях максимальной кислотной стимуляции с использованием пентагастрина дозозависимое снижение продукции соляной кислоты происходит после однократного перорального приема 20–80 мг пантопразола у здоровых субъектов. Ежедневный прием пантопразола 1 раз в день приводит к усилению угнетения секреции соляной кислоты. После первоначальной пероральной дозы пантопразола 40 мг среднее ингибирование 51% было достигнуто через 2,5 ч. При приеме 1 раз в день в течение 7 дней среднее ингибирование увеличивалось до 85%. Пантопразол подавлял секрецию кислоты более чем на 95% у половины пациентов. Секреция кислоты нормализовалась в течение 1 нед после последней дозы пантопразола, эффект «отскока» гиперсекреции не наблюдался.
В исследованиях зависимости эффекта от дозы пантопразол в пероральных дозах от 20 до 120 мг вызывал дозозависимое увеличение среднего значения pH базального желудочного сока, которое во всех случаях было >3 и >4. Пантопразол в дозе 40 мг вызывал значительно большее увеличение pH желудочного сока, чем в дозе 20 мг. Дозы более 40 мг (60, 80, 120 мг) не приводили к дальнейшему значительному увеличению среднего значения pH желудочного сока.
Эффекты сывороточного гастрина
Уровень гастрина в сыворотке крови натощак оценивали в двух двойных слепых исследованиях у пациентов с острым эрозивным эзофагитом, в которых 682 пациента с ГЭРБ получали 10, 20 или 40 мг пантопразола в течение срока до 8 нед. Через 4 нед лечения наблюдалось повышение среднего уровня гастрина на 7, 35 и 72% соответственно по сравнению со значениями до начала применения. Аналогичное повышение уровня гастрина в сыворотке крови было отмечено во время 8-недельного применения с соответствующим средним увеличением на 3, 26 и 84%. Медиана сывороточного уровня гастрина оставалась в пределах нормы во время поддерживающей терапии.
В долгосрочных международных исследованиях с участием более 800 пациентов в первые месяцы применения пантопразола в дозе 40 мг/сут во время поддерживающего лечения ГЭРБ и 40 мг или выше в день у пациентов с рефрактерной ГЭРБ наблюдалось среднее увеличение уровня гастрина в сыворотке крови в 2–3 раза по сравнению с его уровнем натощак перед лечением. Уровень гастрина в сыворотке натощак обычно оставался примерно в 2–3 раза выше исходного в течение до 4 лет периодического наблюдения в клинических исследованиях.
После кратковременного применения пантопразола повышенный уровень гастрина возвращается к норме как минимум через 3 мес.
Влияние на энтерохромаффиноподобные (ECL) клетки
У 39 пациентов, получавших пантопразол внутрь в дозах от 40 до 240 мг/сут (большинство из которых получали от 40 до 80 мг) в течение 5 лет, наблюдалось умеренное увеличение плотности ECL-клеток начиная с первого года применения с предполагаемым выходом на плато через 4 года.
В доклиническом исследовании на крысах линии Sprague-Dawley воздействие пантопразола в дозах от 0,5 до 200 мг/кг/сут в течение 24 мес приводило к дозозависимому увеличению пролиферации ECL-клеток желудка и опухолей нейроэндокринных (NE) желудочных клеток. Опухоли NE-клеток у крыс могут возникнуть в результате хронического повышения концентрации гастрина в сыворотке крови. Высокая плотность ECL-клеток в желудке крысы делает этот вид очень восприимчивым к пролиферативным эффектам гастрина, содержащегося в повышенной концентрации в результате действия ингибитора протонного насоса. Однако после введения пантопразола в дозе 0,5 мг/кг/сут повышения уровня гастрина в сыворотке крови не наблюдалось. В отдельном исследовании опухоль NE-клеток желудка без сопутствующих пролиферативных изменений ECL-клеток наблюдалась у 1 самки крысы после 12 мес введения пантопразола в дозе 5 мг/кг/сут и 9-месячного восстановления после отмены дозы.
Эндокринные эффекты
В клиническом фармакологическом исследовании пантопразол в дозе 40 мг 1 раз в сутки в течение 2 нед не оказывал влияния на уровни следующих гормонов: кортизол, тестостерон, трийодтиронин (Т3), тироксин (Т4), ТТГ, белок, связывающий тиронин, паратиреоидный гормон, инсулин, глюкагон, ренин, альдостерон, ФСГ, ЛГ, пролактин и гормон роста. В 1-летнем исследовании пациентов с ГЭРБ, получавших партопразол в дозе 40 или 20 мг, не наблюдалось изменений по сравнению с исходным уровнем горомнов Т3, Т4 и ТТГ.
Фармакокинетика
Всасывание
Абсорбция пантопразола в виде таблеток с кишечнорастворимым покрытием начинается после прохождения желудка. Cmax и AUC увеличиваются пропорционально дозе в интервале от 10 до 80 мг. Пантопразол не накапливается, и его фармакокинетика не изменяется при многократном ежедневном приеме. После перорального введения концентрация пантопразола в сыворотке крови снижается биэкспоненциально с конечным T1/2 приблизительно 1 ч.
У сильных метаболизаторов с нормальной функцией печени, получающих пероральную дозу пантопразола 40 мг, Cmax составляет 2,5 мкг/мл, Tmax — 2,5 ч, а средняя AUC — 4,8 мкг·ч/мл (диапазон от 1,4 до 13,3 мкг·ч/мл). Пантопразол слабо метаболизируется при первом прохождении через печень, в результате чего абсолютная биодоступность составляет примерно 77%. На абсорбцию пантопразола не влияет одновременный прием антацидов.
Прием пантопразола в виде таблеток с замедленным высвобождением вместе с пищей может задержать его абсорбцию до 2 ч или дольше, однако Cmax и степень абсорбции (AUC) не изменяются. Поэтому пантопразол можно принимать независимо от приема пищи.
Распределение
Кажущийся Vd пантопразола составляет приблизительно от 11 до 23,6 л, распределение в основном происходит во внеклеточной жидкости. Связывание пантопразола с белками сыворотки крови, в первую очередь с альбумином, составляет около 98%.
Метаболизм
Пантопразол интенсивно метаболизируется в печени с участием цитохрома P450 (CYP). Метаболизм пантопразола не зависит от пути введения. Основным метаболическим путем является деметилирование с помощью CYP2C19 с последующим сульфатированием, другие метаболические пути включают окисление с участием CYP3A4. Отсутствуют доказательств того, что какой-либо из метаболитов пантопразола обладает значительной фармакологической активностью.
Экскреция
После однократного перорального введения 14С-меченного пантопразола здоровым субъектам с нормальным метаболизмом примерно 71% дозы выводится с мочой, а 18% — с калом через желчные пути. Почечной экскреции неизмененного пантопразола не наблюдалось.
Особые группы пациентов
Пожилой возраст. У пожилых людей (от 64 до 76 лет) после многократного перорального приема наблюдалось небольшое или умеренное увеличение AUC (43%) и Cmax (26%) пантопразола по сравнению с более молодыми предметами.
Дети. Фармакокинетика пантопразола изучалась в четырех рандомизированных открытых клинических исследованиях у детей младше 16 лет с предполагаемой или доказанной ГЭРБ. Пантопразол в виде таблеток с замедленным высвобождением изучали у детей старше 5 лет. Результаты популяционного фармакокинетического анализа показали нелинейное увеличение общего клиренса с увеличением массы тела. Общий клиренс увеличивался с возрастом только у детей до 3 лет.
Дети и подростки от 6 до 16 лет. Фармакокинетика пантопразола в виде таблеток оценивалась у детей в возрасте от 6 до 16 лет с клиническим диагнозом ГЭРБ. Фармакокинетические параметры после однократного перорального приема пантопразола в дозе 20 или 40 мг у детей в возрасте от 6 до 16 лет сильно варьировали (коэффициент вариации от 40 до 80%). Среднее геометрическое значение AUC, оцененное на основе популяционного фармакокинетического анализа после приема пантопразола в дозе 40 мг у педиатрических пациентов, было примерно на 39 и 10% соответственно выше у детей в возрасте от 6 до 11 и от 12 до 16 лет по сравнению со взрослыми.
Пол. У женщин наблюдается умеренное увеличение AUC и Cmax пантопразола по сравнению с мужчинами. Однако значения клиренса, нормализованные по весу, у женщин и мужчин одинаковы. Популяционный фармакокинетический анализ у детей в возрасте от 1 до 16 лет показал отсутствие клинически значимого влияния пола на клиренс пантопразола.
Почечная недостаточность. У пациентов с тяжелой почечной недостаточностью фармакокинетические параметры пантопразола были аналогичны таковым у здоровых людей.
Нарушение функции печени. У пациентов с легкой и тяжелой печеночной недостаточностью (классы А и С по шкале Чайлд-Пью) Cmax пантопразола увеличивалась лишь незначительно (в 1,5 раза) по сравнению со здоровыми субъектами. Хотя значения T1/2 в сыворотке крови увеличились до 7–9 ч, а AUC — в 5–7 раз у пациентов с печеночной недостаточностью, это увеличение не было больше, чем у пациентов с недостаточным метаболизмом CYP2C19, для которых корректировка дозировки не требуется. Эти фармакокинетические изменения у пациентов с нарушением функции печени приводят к минимальному накоплению ЛС после приема нескольких доз 1 раз в день. Дозы выше 40 мг/сут у пациентов с нарушением функции печени не изучались.
Фармакогеномика
CYP2C19 демонстрирует известный генетический полиморфизм из-за его дефицита в некоторых субпопуляциях (например, примерно 3% представителей европеоидной расы и афроамериканцев и от 17% до 23% представителей монголоидной расы являются слабыми метаболизаторами). Хотя у этих субпопуляций со слабым метаболизмом пантопразола T1/2 составляет от 3,5 до 10 ч у взрослых, при дозировке 1 раз в день кумуляция остается незначительной (≤23%). Для взрослых пациентов, которые являются слабыми метаболизаторами по CYP2C19, коррекция дозы не требуется.
Аналогично взрослым, у детей, являющихся слабыми метаболизаторами генотипа CYP2C19 (CYP2C19*2/*2), наблюдалось более чем 6-кратное увеличение AUC по сравнению с сильными (CYP2C19*1/*1) и умеренными (CYP2C19*1/*×) метаболизаторами. У слабых метаболизаторов кажущийся пероральный клиренс примерно в 10 раз ниже, чем у сильных метаболизаторов. Для детей, которые известны как слабые метаболизаторы, следует рассмотреть возможность снижения дозы.
Клинические исследования
Пантопразол в виде таблеток с кишечнорастворимым покрытием использовался в следующих клинических испытаниях.
Эрозивный эзофагит, связанный с ГЭРБ
Взрослые пациенты. Многоцентровое двойное слепое плацебо-контролируемое исследование применения пантопразола в дозе 10, 20 или 40 мг 1 раз в день было проведено в США с участием 603 пациентов с симптомами рефлюкса и эндоскопически диагностированным эрозивным эзофагитом 2-й степени или выше (шкала Hetzel-Dent). В этом исследовании примерно 25% включенных пациентов имели тяжелый эрозивный эзофагит 3-й степени, а 10% — 4-й степени. Доля вылеченных пациентов (согласно протоколу, n=541) в этом исследовании указана в таблице 1.
Таблица 1
Доля вылеченных пациентов с эрозивным эзофагитом (согласно протоколу), %
| Неделя | Пантопразол | Плацебо | ||
| 10 мг/сут (n=153) | 20 мг/сут (n=158) | 40 мг/сут (n=162) | (n=68) | |
| 4 | 45,61 | 58,41,2 | 751,3 | 14,3 |
| 8 | 661 | 83,51,2 | 92,61,3 | 39,7 |
1 p<0,001 в сравнении с плацебо.
2 p<0,05 в сравнении с 10 мг пантопразола.
3 p <0,05 в сравнении с 10 или 20 мг пантопразола.
В этом исследовании во всех группах лечения пантопразолом отмечены значительно более высокие показатели выздоровления, чем в группе плацебо. Это не зависело от статуса H.pylori пациентов в группах лечения, получавших 40 и 20 мг пантопразола. Применение пантопразола в дозе 40 мг приводило к значительно более высокой степени излечения, чем 20 или 10 мг. Значительно бóльшая часть пациентов, получавших пантопразол в дозе 40 мг, испытала полное облегчение дневной и ночной изжоги и отсутствие регургитации начиная с первого дня лечения в сравнении с группой плацебо. Пациенты, получавшие пантопразол, значительно меньше нуждались в приеме антацида в течение дня, чем пациенты, получавшие плацебо.
В многоцентровом двойном слепом исследовании в США с участием 243 пациентов с симптомами рефлюкса и эндоскопически диагностированным эрозивным эзофагитом 2-й степени или выше сравнивали применение пантопразола в дозе 40 и 20 мг 1 раз в день с применением низатидина в дозе 150 мг 2 раза в день. Доля вылеченных пациентов (согласно протоколу, n=212) приведена в таблице 2.
Таблица 2
Доля вылеченных пациентов с эрозивным эзофагитом (согласно протоколу), %
| Неделя | Пантопразол | Низатидин | |
| 20 мг/сут (n=72) | 40 мг/сут (n=70) | 150 мг 2 раза в день (n=70) | |
| 4 | 61,41 | 641 | 22,2 |
| 8 | 79,21 | 82,91 | 41,4 |
1 (p<0,001) пантопразол в сравнении с низатидином.
Применение пантопразола в дозе 40 или 20 мг 1 раз в день приводило к значительному увеличению доли вылеченных пациентов как через 4, так и через 8 нед в сравнении с лечением низатидином 2 раза в день в дозе 150 мг. В группе лечения с применением пантопразола в дозе 40 мг были достигнуты значительно более высокие показатели заживления по сравнению с низатидином, независимо от статуса H.pylori. Значительно бóльшая часть пациентов в группах лечения пантопразолом испытала полное облегчение ночной изжоги и срыгивания начиная с первого дня и дневной изжоги на второй день по сравнению с пациентами, получавшими низатидин. Пациенты, получавшие пантопразол, значительно меньше нуждались в приеме антацидов в течение дня, чем пациенты, получавшие низатидин.
Дети в возрасте от 5 до 16 лет. Эффективность применения пантопразола при лечении эрозивного эзофагита, связанного с ГЭРБ, у детей в возрасте от 5 до 16 лет экстраполирована на основании данных адекватных и хорошо контролируемых исследований с участием взрослых пациентов, исходя из того, что патофизиология заболевания одинаковая. Четыре пациента детского возраста с эндоскопически диагностированным эрозивным эзофагитом участвовали в многоцентровых рандомизированных двойных слепых исследованиях с параллельными группами. Дети с эндоскопически диагностированным эрозивным эзофагитом (≥2 баллов по шкале Hetzel-Dent) получали 1 раз в день в течение 8 нед пантопразол в дозе 20 или 40 мг). Все 4 пациента вылечились (оценка 0 или 1 по шкале Hetzel-Dent) через 8 нед.
Долгосрочное поддерживающее лечение эрозивного эзофагита
Для подтверждения эффективности пантопразола при долгосрочном поддерживающем лечении эрозивного эзофагита были проведены два независимых многоцентровых рандомизированных двойных слепых с препаратом сравнения исследования идентичного дизайна с участием взрослых пациентов с ГЭРБ и эндоскопически подтвержденным излеченным эрозивным эзофагитом. В двух исследованиях в США приняли участие 386 и 404 пациента соответственно, которые получали 10, 20 или 40 мг пантопразола 1 раз в день или 150 мг ранитидина 2 раза в день. Как видно из таблицы 3, пантопразол в дозе 40 и 20 мг значительно превосходил ранитидин в каждый момент времени по доле пациентов, которые оставались вылеченными. Кроме того, в дозе 40 мг пантопразол превосходил все другие иследованные методы лечения.
Таблица 3
Долгосрочное поддерживающее лечение эрозивной ГЭРБ: доля пациентов, которые остались вылеченными, %1
| Исследование и момент времени | Пантопразол, 20 мг/сут | Пантопразол, 40 мг/сут | Ранитидин, 150 мг 2 раза в день |
| Исследование 1 | n=75 | n=74 | n=75 |
| 1 мес | 912 | 992 | 68 |
| 3 мес | 822 | 932,3 | 54 |
| 6 мес | 762 | 902,3 | 44 |
| 12 мес | 702 | 862,3 | 35 |
| Исследование 2 | n=74 | n=88 | n=84 |
| 1 мес | 892 | 922,3 | 62 |
| 3 мес | 782 | 912,3 | 47 |
| 6 мес | 722 | 882,3 | 39 |
| 12 мес | 722 | 832 | 37 |
1 Пантопразол в дозе 10 мг превосходил (p<0,05) ранитидин в исследовании 2, но не в исследовании 1.
2 (p<0,05) в сравнении с ранитидином.
3 (p<0,05) в сравненис с пантопразолом 20 мг.
Пантопразол в дозе 40 мг превзошел ранитидин в снижении количества эпизодов дневной и ночной изжоги с первого по двенадцатый месяц лечения. Пантопразол в дозе 20 мг 1 раз в день также был эффективен в уменьшении эпизодов дневной и ночной изжоги в одном из исследований.
Патологические гиперсекреторные состояния, включая синдром Золлингера-Эллисона
В многоцентровом открытом исследовании 35 пациентов с патологическими гиперсекреторными состояниями, такими как синдром Золлингера-Эллисона, с множественной эндокринной неоплазией 1-го типа или без нее, применение пантопразола позволяло успешно контролировать секрецию соляной кислоты. Дозы в диапазоне от 80 до 240 мг/сут обеспечивали выделение кислоты в желудке ниже 10 мЭкв/ч у пациентов без предшествующей кислотоснижающего хирургического лечения и ниже 5 мЭкв/ч у пациентов, получивших ранее кислотоснижающее хирургическое лечение.
Проводилось предварительное титрование дозы в соответствии с индивидуальными потребностями пациента и коррекция дозы у некоторых пациентов в зависимости от клинического ответа со временем. Пантопразол хорошо переносился в этом диапазоне доз в течение длительного периода времени (более 2 лет у некоторых пациентов).
Показания к применению
Кратковременное лечение эрозивного эзофагита, связанного с ГЭРБ, у взрослых и детей в возрасте 5 лет и старше (краткосрочное лечение до 8 нед для устранения и облегчения симптомов эрозивного эзофагита; у взрослых пациентов, не получивших излечение после 8 нед, можно рассмотреть дополнительный 8-недельный курс; безопасность применения пантопразола более 8 нед у детей не установлена); поддерживающее лечение эрозивного эзофагита (поддержание лечебного эффекта и снижение частоты рецидивов дневных и ночных симптомов изжоги у взрослых пациентов с ГЭРБ); патологические гиперсекреторные состояния, включая синдром Золлингера-Эллисона (длительное лечение).
Противопоказания
Гиперчувствительность, в т.ч. к любому замещенному бензимидазолу (реакции гиперчувствительности могут включать анафилаксию, анафилактический шок, ангионевротический отек, бронхоспазм, острый интерстициальный нефрит и крапивницу); одновременное применение рилпивирина (см. «Взаимодействие»).
Применение при беременности и кормлении грудью
Исследования репродукции, выполненные на крысах (пантопразол в дозах до 450 мг/кг/сут, что примерно в 88 раз больше рекомендуемой дозы для человека в пересчете на площадь поверхности тела) и кроликах (дозы до 40 мг/кг/сут или около 16 рекомендуемых доз для человека в пересчете на площадь поверхности тела), с введением пантопразола во время органогенеза у беременных животных, не выявили доказательств нарушения фертильности или повреждения плода, вызванных применением пантопразола.
Адекватные и хорошо контролируемые исследования у беременных женщин отсутствуют. Поскольку исследования репродукции, выполненные на животных, не всегда позволяют прогнозировать реакцию человека, пантопразол следует использовать во время беременности, только если потенциальная польза для матери оправдывает потенциальный риск для плода.
Пантопразол и его метаболиты выделяются с молоком у крыс. Экскреция пантопразола с грудным молоком была обнаружена в исследовании у одной кормящей матери после однократного перорального приема 40 мг пантопразола. Клиническая значимость этого факта неизвестна. Многие ЛС, которые выделяются с грудным молоком, могут вызывать серьезные побочные реакции у грудных детей. С учетом потенциальной канцерогенности пантопразола натрия, показанной в исследованиях на грызунах, следует принять решение о прекращении кормления грудью или применения пантопразола, с учетом его пользы для матери.
Побочные действия
Реклама: ООО «РЛС-Патент», ИНН 5044031277
Результаты клинических исследований
Поскольку клинические исследования проводятся в различных условиях, частота побочных реакций, наблюдаемая при их проведении, не может напрямую сравниваться с частотой, наблюдаемой при исследовании другого ЛС, и может не отражать частоту их встречаемости в клинической практике.
Взрослые пациенты
Безопасность применения пантопразола изучалась в девяти рандомизированных сравнительных клинических исследованиях в США у пациентов с ГЭРБ, включая 1473 пациента, получавших пантопразол перорально в дозе 20 или 40 мг, 299 пациентов, получавших H2-антигистаминные ЛС, 46 пациентов, получавших другой ингибитор протонного насоса, и 82 пациента, получавших плацебо. Наиболее часто встречающиеся побочные реакции перечислены в таблице 4.
Таблица 4
Побочные реакции, отмечавшиеся в клинических исследованиях у взрослых пациентов с ГЭРБ с частотой >2%
| Побочная реакция | Пантопразол (n=1473), % | Препарат сравнения (n=345), % | Плацебо (n=82), % |
| Головная боль | 12.2 | 12,8 | 8,5 |
| Диарея | 8,8 | 9,6 | 4,9 |
| Тошнота | 7 | 5,2 | 9,8 |
| Боль в животе | 6,2 | 4,1 | 6,1 |
| Рвота | 4,3 | 3,5 | 2,4 |
| Метеоризм | 3,9 | 2,9 | 3,7 |
| Головокружение | 3 | 2,9 | 1,2 |
| Артралгия | 2,8 | 1,4 | 1,2 |
Кроме того, с частотой ≤2% отмечались следующие побочные реакции.
Со стороны организма в целом: аллергическая реакция, гипертермия, реакция светочувствительности, отек лица.
Со стороны ЖКТ: запор, сухость во рту, гепатит.
Со стороны крови: лейкопения, тромбоцитопения.
Со стороны обмена веществ и питания: повышение уровня креатинкиназы, генерализованный отек, повышение уровня триглицеридов, повышение уровня ферментов печени.
Со стороны скелетно-мышечной системы: миалгия.
Со стороны нервной системы: депрессия, головокружение.
Со стороны кожи и подкожной ткани: крапивница, сыпь, кожный зуд.
Со стороны органов чувств: помутнение зрения.
Дети
Безопасность применения пантопразола при лечении эрозивного эзофагита, связанного с ГЭРБ, оценивалась у детей в возрасте от 1 до 16 лет в трех клинических исследованиях. В испытаниях безопасности участвовали пациенты с эрозивным эзофагитом, однако поскольку он редко встречается в педиатрической популяции, также были обследованы 249 детей с эндоскопически подтвержденным или симптоматическим ГЭРБ. Считается, что все побочные реакции на пантопразол у взрослых относятся и к педиатрическим пациентам. У пациентов в возрасте от 1 года до 16 лет наиболее частые (>4%) побочные реакции включают инфекции верхних дыхательных путей, головную боль, лихорадку, диарею, рвоту, сыпь и боль в животе.
Кроме того, у детей в клинических испытаниях с частотой ≤4% отмечались следующие побочные реакции.
Со стороны организма в целом: аллергическая реакция, отек лица.
Со стороны ЖКТ: запор, метеоризм, тошнота.
Со стороны обмена веществ и питания: повышение уровня триглицеридов, ферментов печени, креатинкиназа.
Со стороны скелетно-мышечной системы: артралгия, миалгия.
Со стороны нервной системы: головокружение, вертиго.
Со стороны кожи и подкожных тканей: крапивница.
Следующие побочные реакции, наблюдавшиеся у взрослых в клинических исследованиях, не зарегистрированы у педиатрических пациентов, но могут рассматриваться как релевантные для них: реакция светочувствительности, сухость во рту, гепатит, тромбоцитопения, генерализованный отек, депрессия, зуд, лейкопения и помутнение зрения.
В клинических исследованиях синдрома Золлингера-Эллисона побочные реакции, отмечавшиеся у 35 пациентов детского возраста, получавших пантопразол в дозе 80–240 мг/сут в течение до 2 лет, были аналогичны наблюдавшимся у взрослых пациентов с ГЭРБ.
Пострегистрационный опыт
Следующие побочные реакции были выявлены во время применения пантопразола после регистрации. Поскольку сообщения об этих реакциях поступали в добровольном порядке от популяции неопределенного размера, не всегда возможно надежно оценить их частоту или установить причинно-следственную связь с применением ЛС.
Общие нарушения и реакции в месте введения: астения, повышенная утомляемость, недомогание, изменение веса.
Со стороны крови: панцитопения, агранулоцитоз.
Со стороны печени и желчевыводящих путей: гепатоцеллюлярное повреждение, ведущее к развитию желтухи и печеночной недостаточности.
Со стороны иммунной системы: анафилаксия (включая анафилактический шок), СКВ.
Инфекции и инвазии: диарея, ассоциированная с Clostridium difficile.
Со стороны обмена веществ и питания: гипонатриемия, гипомагниемия.
Со стороны скелетно-мышечной системы: рабдомиолиз, перелом костей.
Со стороны нервной системы: агевзия, дисгевзия.
Психические нарушения: галлюцинации, спутанность сознания, бессонница, сонливость.
Со стороны почек и мочевыводящих путей: интерстициальный нефрит.
Со стороны кожи и подкожных тканей: тяжелые дерматологические реакции (в т.ч. с летальным исходом), включая многоформную эритему, синдром Стивенса-Джонсона, токсический эпидермальный некролиз, ангионевротический отек (отек Квинке) и кожные формы красной волчанки.
Взаимодействие
Влияние других ЛС на пантопразол
Пантопразол метаболизируется в основном посредством CYP2C19 и в незначительной степени — CYP3A4, CYP2D6 и CYP2C9. В исследованиях взаимодействия in vivo у здоровых добровольцев фармакокинетика пантопразола существенно не изменялась при совместном применении с субстратами CYP2C19 (диазепам, также субстрат CYP3A4), фенитоин (также индуктор CYP3A4) и клопидогрел), CYP3A4 (нифедипин, мидазолам и кларитромицин), CYP2D6 (метопролол), CYP2C9 (напроксен и пироксикам) и CYP1A2 (теофиллин).
Влияние пантопразола на другие ЛС
Клопидогрел. Клопидогрел частично метаболизируется до активного метаболита с помощью CYP2C19. В перекрестном клиническом исследовании 66 здоровым добровольцам вводили клопидогрел (ударная доза 300 мг, а затем 75 мг/сут) отдельно и с пантопразолом (80 мг одновременно с клопидогрелом) в течение 5 дней. На 5-й день средняя AUC активного метаболита клопидогрела уменьшилась примерно на 14% (среднее геометрическое соотношение составляло 86% при 90% ДИ от 79 до 93%), когда пантопразол вводили одновременно с клопидогрелом, по сравнению с клопидогрелом, вводимым отдельно. Были также измерены фармакодинамические параметры, которые продемонстрировали, что изменение ингибирования агрегации тромбоцитов (индуцированное 5 мкМ АДФ) коррелировало с изменением воздействия активного метаболита клопидогрела. Клиническое значение этого факта неизвестно.
Другие ЛС. Исследования in vivo свидетельствуют о том, что пантопразол не оказывает значительного влияния на фармакокинетику следующих ЛС: цизаприд, теофиллин, диазепам (и его активный метаболит, десметилдиазепам), фенитоин, метопролол, нифедипин, карбамазепин, мидазолам, кларитромицин, диклофенак и пероральные контрацептивы (левоноргестрел + этинилэстрадиол). В других исследованиях in vivo не отмечено клинически значимого взаимодействия пантопразола с дигоксином, этанолом, глибуридом, феназоном, кофеином, метронидазолом и амоксициллином. Не изучалась возможность значительного взаимодействия при приеме высоких доз пантопразола более одного раза в сутки у лиц с недостаточным метаболизмом или нарушением функции печени.
Не наблюдалось взаимодействия пантопразола с одновременно принимаемыми антацидами.
В таблице 5 приведены данные по клинически важным взимодействиям пантопразола и других ЛС и влиянию пантопразола на результаты лабораторных тестов, а также рекомендации по их предотвращению или управлению.
Дополнительная информация о взаимодействии с ингибиторами протонного насоса может содержаться в инструкциях по применению одновременно назначаемых ЛС.
Таблица 5
Клинически значимые взаимодействия с другими ЛС и влияние пантопразола на результаты лабораторных тестов
| ЛС, группа ЛС или тест | Взаимодействие | Рекомендации |
| Антиретровирусные ЛС | Влияние ингибиторов протонного насоса на антиретровирусные ЛС вариабельно. Клиническое значение и механизмы этих взаимодействий не всегда известны. Уменьшение экспозиции некоторых антиретровирусных ЛС (например, рилпивирин, атазанавир и нелфинавир) при одновременном применении с пантопразолом может снизить противовирусный эффект и способствовать развитию лекарственной устойчивости. Увеличение экспозиции антиретровирусных ЛС (например, саквинавир) при одновременном применении с пантопразолом может повысить риск развития побочных действий. Существуют антиретровирусные ЛС, не имеющие клинически значимого взаимодействия с пантопразолом при одновременном применении |
Рилпивирин: одновременное применение рилпивирина и пантопразола противопоказано (см. «Противопоказания»). Атазанавир: за информацей о дозировке следует обратиться к инструкции по применению атазанавира. Нелфинавир: следует избегать одновременного применения с пантопразолом. Саквинавир: информация для мониторинга потенциальных побочных эффектов, связанных с применением саквинавиром, содержится в инструкции по его применению. Другие антиретровирусные ЛС: см. информацию по применению конкретных антиретровирусных ЛС |
| Варфарин | При одновременном применении варфарина и пантопразола возможно повышение МНО и ПВ, которые могут привести к развитию патологического кровотечения и даже смертельному исходу | При одновременном применении необходимо контролировать МНО и ПВ и при необходимости скорректировать дозу варфарина для поддержания целевого диапазона МНО |
| Метотрексат | Одновременное применение пантопразола и метотрексата (в основном в высоких дозах) может увеличивать концентрацию в сыворотке крови и экспозицию метотрексата и/или его метаболита гидроксиметотрексата, что может приводить к усилению побочных эффектов метотрексата. Официальные исследования взаимодействия метотрексата в высоких дозах и ингибиторов протонного насоса не проводились (см. «Меры предосторожности») | У некоторых пациентов, получающих высокие дозы метотрексата, можно рассмотреть возможность временной отмены пантопразола |
| ЛС, абсорбция которых зависит от pH желудочного сока (например, соли железа, эрлотиниб, дазатиниб, нилотиниб, микофенолата мофетил, кетоконазол) | Пантопразол может снижать абсорбцию других ЛС из-за его влияния на снижение секреции соляной кислоты в желудке | Микофенолата мофетил: сообщалось, что совместное введение пантопразола здоровым субъектам и пациентам с трансплантатом, получающим микофенолата мофетил, снижает воздействие активного метаболита микофеноловой кислоты, возможно, из-за снижения растворимости микофенолата мофетила при увеличении pH желудочного сока. Клиническая значимость снижения воздействия микофеноловой кислоты на отторжение органа у пациентов с трансплантатами, получающих пантопразол в виде инъекций и микофенолата мофетил, не установлена. Следует соблюдать осторожность при применении пантопразола у пациентов с трансплантатами, получающих микофенолата мофетил. Другие ЛС, абсорбция которых зависит от pH желудочного сока: см. инструкцию по применению конкретного ЛС |
| Ложноположительные анализы мочи на тетрагидроканнабинол | Имеются сообщения о ложноположительных скрининговых тестах мочи на тетрагидроканнабинол у пациентов, получающих ингибиторы протонного насоса, включая пантопразол (см. «Меры предосторожности») | Для подтверждения положительных результатов следует рассмотреть альтернативный метод диагностики |
Передозировка
Опыт лечения пациентов, принимающих очень высокие дозы пантопразола (более 240 мг), ограничен. Спонтанные пострегистрационные сообщения о передозировке обычно находятся в пределах известного профиля безопасности пантопразола.
Симптомы: однократные пероральные дозы пантопразола 709, 798 и 887 мг/кг были смертельными для мышей, крыс и собак соответственно. Симптомами острой токсичности были гипоактивность, атаксия, сгорбленная спина, вывих конечностей, положение лежа на боку, обособленность, отсутствие ушного рефлекса и тремор.
Лечение: пантопразол не выводится гемодиализом. В случае передозировки лечение должно быть симптоматическим и поддерживающим.
Способ применения и дозы
Внутрь, не разжевывая, независимо от приема пищи.
Меры предосторожности
Наличие злокачественного новообразования желудка
У взрослых симптоматический ответ на терапию пантопразолом не исключает наличия злокачественного новообразования желудка. Для взрослых пациентов, у которых наблюдается субоптимальный ответ или ранний симптоматический рецидив после завершения лечения ингибитором протонного насоса, следует рассмотреть возможность дополнительного наблюдения и диагностического тестирования. У пожилых пациентов также следует рассмотреть возможность проведения эндоскопии.
Острый интерстициальный нефрит
Острый интерстициальный нефрит наблюдался у пациентов, получавших ингибиторы протонного насоса, включая пантопразол. Острый интерстициальный нефрит может возникнуть в любой момент во время терапии ингибитором протонного насоса и, как правило, связан с реакцией идиопатической гиперчувствительности. При развитии острого интерстициального нефрита применение пантопразола необходимо прекратить (см. «Противопоказания»).
Диарея, ассоциированная с Clostridium difficile
Данные обсервационных исследований позволяют предположить, что терапия ингибитором протонного насоса, таким как пантопразол, может быть связана с повышенным риском развития диареи, ассоциированной с Clostridium difficile, особенно у госпитализированных пациентов. Этот диагноз следует рассматривать в случае непроходящей диареи (см. «Побочные действия»). Пациентам следует назначать наиболее низкую дозу и короткую продолжительность терапии, соответствующие их состоянию.
Переломы костей
Данные обсервационных исследований показывают, что применение ингибиторов протонного насоса может повышать риск переломов бедра, запястья или позвоночника, связанных с остеопорозом. Риск перелома был повышен у пациентов, получавших высокие дозы, определяемые как многократные ежедневные, и длительное лечение (год или дольше). Пациентам следует назначать наиболее низкую дозу и короткую продолжительность терапии, соответствующие их состоянию.
Кожные формы красной волчанки и СКВ
Отмечались случаи развития кожной красной волчанки и СКВ у пациентов, получавших ингибиторы протонного насоса, включая пантопразол. Эти случаи возникали как новое заболевание, так и как обострение существующего аутоиммунного заболевания.
Большинство случаев красной волчанки, ассоциированной с применением ингибиторов протонного насоса, были кожной формой. Наиболее распространенной была подострая форма кожной красной волчанки, и заболевание возникало в течение от нескольких недель до нескольких лет после непрерывной лекарственной терапии у пациентов, начиная от младенцев до пожилых людей. Как правило, гистологические данные показывали отсутствие вовлечения органов.
СКВ отмечалась реже, чем кожная форма, у пациентов, получающих ингибитор протонного насоса. СКВ, ассоциированная с применением ингибитора протонного насоса, обычно наблюдается в более легкой форме, чем СКВ, вызванная немедикаментозным воздействием. Начало СКВ обычно происходило в течение от нескольких дней до нескольких лет после начала лечения, в основном у взрослых пациентов от молодого до пожилого возраста. У большинства пациентов появлялась сыпь, однако отмечались также случаи развития артралгии и цитопении.
Необходимо избегать применения ингибиторов протонного насоса дольше, чем указано по медицинским показаниям. Если у пациентов, получающих пантопразол, отмечаются признаки или симптомы, соответствующие кожной форме или СКВ, прием ЛС следует прекратить и обратиться к соответствующему специалисту для оценки. У большинства пациентов улучшение наблюдается через 4–12 нед после отмены только ингибитора протонного насоса. Серологические тесты (например, тест на антинуклеарные антитела) могут быть положительными, и улучшение их результатов может занять больше времени, чем разрешение клинических проявлений.
Дефицит цианокобаламина (витамин B12)
Как правило, ежедневное лечение с применением ЛС, подавляющих кислотопродукцию, в течение длительного периода времени (например, больше чем 3 года) может привести к развитию мальабсорбции цианокобаламина, вызванной гипо- или ахлоргидрией. Имеются сообщения о редких случаях дефицита цианокобаламина, возникающего при кислотоподавляющей терапии. Этот диагноз следует рассматривать, если наблюдаются клинические симптомы, соответствующие дефициту цианокобаламина.
Гипомагниемия
У пациентов, получавших ингибиторы протонного насоса в течение как минимум 3 мес (в большинстве случаев после 1 года терапии), в редких случаях наблюдалось развитие гипомагниемии, симптоматической и бессимптомной. Серьезные побочные эффекты включали тетанию, аритмию и судороги. У большинства пациентов лечение гипомагниемии требовало заместительной терапии магнием и отмены ингибитора протонного насоса.
У пациентов, проходящих длительное лечение или получающих ингибитор протоного насоса одновременно с дигоксином или ЛС, способными вызвать гипомагниемию (например, диуретики), следует предусмотреть мониторинг уровня магния до начала терапии и периодически в ходе лечения.
Онкогенность
В связи с хроническим характером течения ГЭРБ возможно длительное применение пантопразола. В долгосрочных исследованиях на грызунах пантопразол проявлял канцерогенность и вызывал развитие редких типов опухолей ЖКТ. Значение этих результатов для оценки возможности развития опухолей у людей неизвестно.
Изменение результатов анализа мочи на тетрагидроканнабинол
Имеются сообщения о ложноположительных результатах скрининговых тестов мочи на тетрагидроканнабинол у пациентов, получающих ингибиторы протонного насоса, включая пантопразол (см. «Взаимодействие»).
Одновременное применение пантопразола и метотрексата
Одновременное применение пантопразола и метотрексата (в основном в высоких дозах) может увеличивать концентрацию в сыворотке крови и экспозицию метотрексата и/или его метаболита гидроксиметотрексата, что может приводить к усилению побочных эффектов метотрексата. При назначении высоких доз метотрексата некоторым пациентам может понадобиться временная отмена пантопразола (см. «Взаимодействие»).
Дети
Безопасность и эффективность применения пантопразола для краткосрочного лечения (до 8 нед) эрозивного эзофагита, связанного с ГЭРБ, были установлены у детей в возрасте от 1 года до 16 лет. Эффективность лечения эрозивного эзофагита у пациентов младше 1 года не установлена. Кроме того, для пациентов младше 5 лет отсутствует коммерчески доступная по дозировке и соответствию возрасту лекарственная форма. Поэтому пантопразол показан для краткосрочного лечения эрозивного эзофагита, связанного с ГЭРБ, пациентам в возрасте 5 лет и старше.
Безопасность и эффективность применения пантопразола у детей по другим показаниям, в т.ч. для лечения симптоматической ГЭРБ, не установлены.
Пожилой возраст
В краткосрочных клинических испытаниях в США показатели заживления эрозивного эзофагита у 107 пожилых пациентов (≥65 лет), получавших пантопразол, были аналогичны таковым у пациентов в возрасте до 65 лет. Частота побочных реакций и отклонений лабораторных показателей у пациентов в возрасте 65 лет и старше и у пациентов моложе 65 лет были аналогичными.
Описание проверено
-
Лобанова Елена Георгиевна
(фармаколог, доктор медицинских наук, профессор)
Опыт работы: более 30 лет
Представленная информация о ценах на препараты не является предложением о продаже или покупке товара.
Информация предназначена исключительно для сравнения цен в стационарных аптеках, осуществляющих деятельность в
соответствии со статьей 55 Федерального закона «Об обращении лекарственных средств» от 12.04.2010 № 61-ФЗ.