Принтеры и МФУ Canon Pixma ведут учёт израсходованной краски в картриджах. В процессе работы и сервисной прочистки сопел часть отработанных чернил попадает мимо бумаги и скапливается в специальной ёмкости (Maintenance Box), в просторечии называемой «памперсом». Принтер никак не отслеживает физическую заполненность абсорбирующего наполнителя чернилами, но приблизительно оценивает по общему количеству выработанных чернил. В результате, принтер блокирует печать по достижении усреднённого предела заполнения картриджа отработки. Понять это можно по номеру ошибки 5B00 или попеременному миганию зелёного и жёлтого индикаторов на принтере семь раз. До этого может возникать 1700 ошибка, говорящая о том что скоро счётчик будет заполнен (полный список кодов ошибок). Счетчик иногда можно сбросить специальными программами – Canon Service Tool.
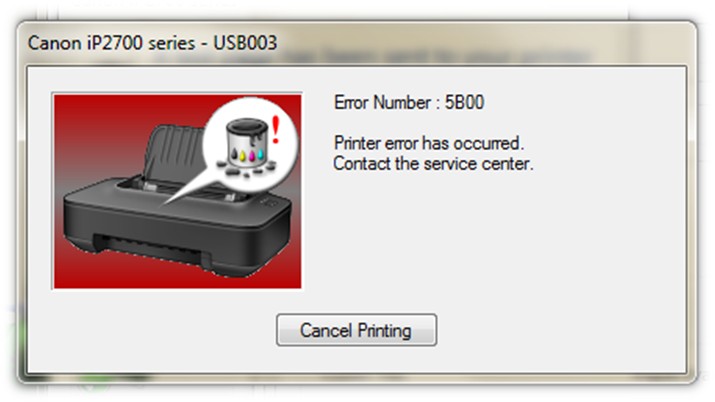
Canon код ошибки 5B00
Зачем вообще сбрасывать «памперс»
В бытовых струйных принтерах Canon PIXMA вероятность возникновения ошибки, связанной с переполнением абсорбера, не высока. Для этого нужно печатать много и часто, так что с большей вероятностью из строя выйдет одна из деталей принтера (чаще всего печатающая голова). Хотя физическая заполненность «памперса» не всегда совпадает с показаниями счётчика, это не значит, что про последний можно забыть. При реальном переполнении картриджа отработки чернила могут потечь и привести к выходу принтера из строя. К тому же любые манипуляции с сервисным режимом и сбросом счётчиков приводят к потере гарантии на устройство. Прежде хорошенько подумайте, стоит ли оно того.
На ряде принтеров сброс «памперса» срабатывает только ДО возникновения ошибки 5B00. К счастью, Service Tool отображает показатели счётчика и их можно проверить заранее.
Вход в сервисный режим
Изменение показаний счётчиков принтера требует его запуска в сервисном режиме. Для этого используются клавиши «Включения» (или Power, изображается привычным кружком с чёрточкой) и «Продолжения» / «Отмены» (Resume, выглядит как вписанный в круг треугольник) на корпусе Canon PIXMA. Клавиши могут быть сенсорными, но принцип остаётся тем же. Принтер при этом должен быть подключен к компьютеру по USB.

«Включить» и «Отмена» на панели управления Canon PIXMA iP3600
Для входа в сервисный режим:
- Выключить принтер кнопкой и дождаться выключения. Если выключить нестандартно (то есть выдернуть кабель питания при включенном устройстве, может не входить в сервисный режим).
- Зажимаем клавишу Отмена/Стоп.
- Не отпуская зажатой клавиши «Отмена», нажмите кнопку Включить/Питание.
- Не отпуская «Включить», отпустите «Отмену» и нажмите на неё чётко заданное количество раз (варьируется в зависимости от модели принтера, подробнее ниже). Индикатор рядом с кнопкой отмена должен реагировать на нажатия сменой цвета.
- Отпустите обе кнопки. Индикатор может несколько раз мигнуть зелёным и затем загореться окончательно. Это означает, что печатающее устройство вошло в сервисный режим (на более современных моделях с ЖК-экраном загорится только индикатор питания, но экран останется чёрным). Если индикатор мигает или горит жёлтым — возникла другая ошибка, которую требуется исправить или вы что-то делаете не правильно.
Количество нажатий кнопки «Отмена» зависит от модели Canon PIXMA. Его можно определить самому, повторяя пункты с 1 по 5 с разным (от 2 до 9) количеством нажатий в 4 пункте. После каждой попытки выключаем принтер КНОПКОЙ выключения, включаем заново и пробуем снова. Далее мы приводим список моделей и количество необходимых нажатий, однако его точность и полноту мы не гарантируем – функция официально не документирована.
- 2 нажатия: iP1200, iP1300, iP1600, iP1700, iP1800, iP1900, iP2200, iP2500, iP2600, iP3600, iP4600, iP4700, iP4840, iP4850, Pro9000 MarkII, Pro9500 MarkII, IX7000, MP240, MP260, MP270, MP480, MP490, MP540, MP550, MP560, MP620, MP630, MP640, MP980, MP990.
- 3 нажатия: MP250,
- 4 нажатия: iP2700, iP7240.
- 5 нажатий: iP4840, iP4850, G1400, G2400, G3400, G4400, iP4940, MP280, MX320, MX330, MX340, MX860, MG5340, MG2245, MP230, MX494, MG3540, MG3550, TS5040.
- 6 нажатий: MG2140, MG2440 (и вся линейка MG2400 Series), MG5340, MG5140, MG5240, MG6140, MG8140, MX394.
- 7 нажатий: TS6140.
ВАЖНО! Кроме чёткого количества нажатий на клавишу отмена, требуется также выдерживать ритм между нажатиями, чтобы запустился именно сервисный режим. Далеко не всегда это получается с первого раза. Не забывайте между попытками извлекать из сети шнур питания и нажимать «Включить», а только после повторять попытку.
На большинстве принтеров и МФУ для сброса нужна специальная программа Service Tool, но на некоторых можно обойтись без нее. Например, на G1400, G2400, G3400, G4400 для сброса сделайте следующее (после входа в сервисный режим):
- Вставляете лист бумаги.
- Нажимаете на кнопку Отмена/Стоп 6 раз, если у вас принтер без сканера, 5 раз – если со сканером. После этого – 1 раз на кнопку Питание.
- Выключаете принтер кнопкой «питание» (чтобы выйти из сервисного режима). Ошибка сброшена.
Использование Service Tool
Существует несколько версий Service Tool для сброса счётчика. Чем новее модель принтера, тем более поздняя версия программы нужна. Если не уверены, скачайте и попробуйте все — интерфейс у них одинаковый.
- Service-tool-v700.zip
- Service-tool-v1050.zip
- Service-tool-v2000.zip
- Service-tool-v3400.zip
- Service-tool-v3600.zip
- Service-tool-v4720.zip (пароль на архив 12345)
- Также в интернете можно легко найти ссылки на Service Tool 4904, 4905, 4906, 4907, 5301, 5303, 5306 для более новых устройств, но безопасность этих программ под вопросом – часто они содержат вирусы. Эти программы есть, например, на сайте easyfixs.blogspot.com, большинство их них заражены вирусами, но работают (!) – мы тестировали пару таких программ. Мы рекомендуем запускать программы на изолированном от интернета компьютере, а потом очищать его антивирусами или переустанавливать Windows.
Соответствие версий Service Tool моделям принтеров (полнота и точность списка не гарантируется, программа не документирована и работает нестабильно, в том числе из-за различий в ОС и драйверах):
- v700: iP1200, iP1300, iP1600, iP1700, iP1800, iP2200, iP2500, iP1900, iP2600.
- v2000: iP2700, iP3600, iP4600, iP4700, iP4840, iP4850, Pro9000 MarkII, Pro9500 MarkII, IX7000, MP240, MP250, MP260, MP270, MP480, MP490, MP540, MP550, MP560, MP620, MP630, MP640, MP980, MP990, MX320, MX330, MX860, MG2400, MG2440, MG5140, MG5150, MG5340.
- v3400: iP4940, MG2140, MG2245, MG3240, MG4240, MP230, MG3540, MX494
- v3600: iP7240.
- v4720/v4740: G1400, G2400, G3400.
Важно! Service Tool может конфликтовать с разными версиями операционных систем. При возникновении ошибок попробуйте запустить программу в режиме совместимости с Windows XP.
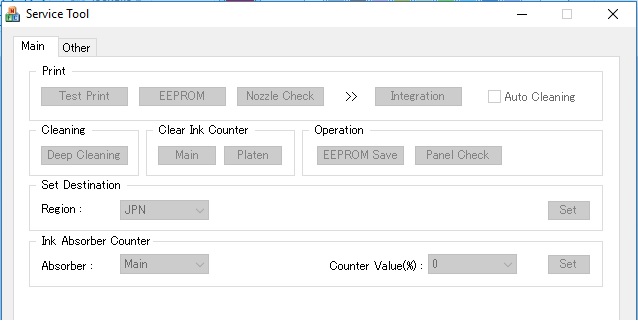
Рабочее окно программы Service Tool
Последовательность действий:
- После включения сервисного режима принтера запустите программу ServiceTool. Если программа не видит принтер, убедитесь, что он подключен к компьютеру. Если подключено больше одного печатающего устройства — выберете нужное.
- Во вкладке «Main» программы есть пункт «Print» с кнопками «Test Print», «EEPROM» и «Nozzle Check». Распечатайте Test Print, чтобы убедится, что программа правильно определила устройство. На распечатанном листе будет строка D, это значение заполненности главного памперса. Приступайте к сбросу
- В программе в секции «Ink Absorber Counter» есть графа «Counter Value» в процентном соотношении отображающая заполненность “памперса”. В графе «Clear Ink Counter» нажмите клавишу «Main», чтобы значение в «Counter Value» стало равно нулю. Если значение не обнулилось, попробуйте также нажать «Platen».
- Сбросив счётчик, закройте Service Tool. Из папки «Принтеры и факсы» удалите копию устройства, установившегося в сервисном режиме.
Альтернативный способ
Для принтеров Canon PIXMA iP3600, iP4600, MG5140, MG5240 «памперс» также обнуляется программой PrintHelp.
- Скачайте PrintHelp с официального сайта.
- Установите и запустите.
- В левом меню выберите принтер.
Во вкладке «Управление» в «Счётчиках отработки» нажмите на клавишу «Сбросить отработку»
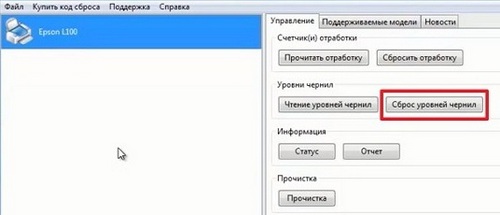
Рабочее окно программы PrintHelp
Проблемы с сервисным режимом
В моделях MG5640, MG5740 и ряде других может произойти сбой, который приводит к невозможности запуска устройства в сервисном режиме. То есть, после указанного количества нажатий на “Отмену”, загорается индикатор с молнией. В таком случае программный сброс как с помощью Service Tool, так и PrintHelp не поможет. Единственный способ решить проблему в данной ситуации – перепаивать микросхему на системной плате устройства. Обычно, данную процедуру делают в сервисных центрах, однако данное решение может быть и не оправданным с точки зрения экономии (издержки могут быть сравнимы с покупкой нового устройства).
Преднизолон (Prednisolone) инструкция по применению
📜 Инструкция по применению Преднизолон
💊 Состав препарата Преднизолон
✅ Применение препарата Преднизолон
📅 Условия хранения Преднизолон
⏳ Срок годности Преднизолон
Препарат отпускается по рецепту
Входит в список «Жизненно необходимых и важнейших лекарственных
препаратов»
Температура хранения: от 2 до 25 °С
Описание лекарственного препарата
Преднизолон
(Prednisolone)
Основано на официальной инструкции по применению препарата, утверждено компанией-производителем
и подготовлено для электронного издания справочника Видаль 2025
года, дата обновления: 2025.04.28
Владелец регистрационного удостоверения:
Контакты для обращений:
ГЕДЕОН РИХТЕР ОАО
(Венгрия)
Код ATX:
H02AB06
(Преднизолон)
Лекарственная форма
|
Препарат отпускается по рецепту |
Преднизолон |
Таблетки 5 мг: 100 шт. рег. №: ЛП-(002720)-(РГ-RU) Предыдущий рег. №: П N011381/01 |
Форма выпуска, упаковка и состав
препарата Преднизолон
Таблетки белого или почти белого цвета, плоскоцилиндрической формы, с фаской с двух сторон и гравировкой «Р» на одной стороне.
Вспомогательные вещества: кремния диоксид коллоидный, крахмал картофельный, стеариновая кислота, магния стеарат, тальк, повидон-K30, крахмал кукурузный, лактозы моногидрат.
100 шт. — флаконы полипропиленовые (1) с контролем первого вскрытия — пачки картонные.
Фармакологическое действие
Преднизолон — синтетический глюкокортикоидный препарат, дегидрированный аналог гидрокортизона. Оказывает противовоспалительное, противоаллергическое, иммунодепрессивное, противошоковое действие, повышает чувствительность β-адренорецепторов к эндогенным катехоламинам.
Взаимодействует со специфическими цитоплазматическими рецепторами (рецепторы глюкокортикоидов (ГКС) есть во всех тканях, особенно их много в печени) с образованием комплекса, индуцирующего образование белков (в т.ч. ферментов, регулирующих в клетках жизненно важные процессы).
Противовоспалительное действие связано с угнетением высвобождения эозинофилами и тучными клетками медиаторов воспаления; индуцированием образования липокортинов и уменьшения количества тучных клеток, вырабатывающих гиалуроновую кислоту; с уменьшением проницаемости капилляров; стабилизацией клеточных мембран (особенно лизосомальных) и мембран органелл. Действует на все этапы воспалительного процесса: ингибирует синтез простагландинов (Pg) на уровне арахидоновой кислоты (липокортин угнетает фосфолипазу А2, подавляет высвобождение арахидоновой кислоты и ингибирует биосинтез эндоперекисей, лейкотриенов, способствующих процессам воспаления, аллергии и другое), синтез «провоспалительных цитокинов» (в т.ч. интерлейкин 1, ФНОα); повышает устойчивость клеточной мембраны к действию различных повреждающих факторов.
Влияние на белковый обмен: уменьшает количество глобулинов в плазме крови, повышает синтез альбуминов в печени и почках (с повышением коэффициента альбумин/глобулин), снижает синтез и усиливает катаболизм белка в мышечной ткани.
Влияние на липидный обмен: повышает синтез высших жирных кислот и триглицеридов, перераспределяет жир (накопление жира происходит преимущественно в области плечевого пояса, лица, живота), приводит к развитию гиперхолестеринемии.
Влияние на углеводный обмен: увеличивает абсорбцию углеводов из ЖКТ; повышает активность глюкозо-6-фосфатазы (повышение поступления глюкозы из печени в кровь); увеличивает активность фосфоенолпируваткарбоксикиназы и синтез аминотрансфераз (активация глюконеогенеза); способствует развитию гипергликемии.
Влияние на водно-электролитный обмен: задерживает ионы натрия (Na+) и воду в организме, стимулирует выведение ионов калия (К+) (минералокортикоидная активность), снижает абсорбцию ионов кальция (Са2+) из ЖКТ, вызывает «вымывание» ионов кальция из костей и повышение его почечной экскреции, снижает минерализацию костной ткани.
Иммунодепрессивное действие обусловлено вызываемой инволюцией лимфоидной ткани, угнетением пролиферации лимфоцитов (особенно Т-лимфоцитов), подавлением миграции В-клеток и взаимодействия Т- и В-лимфоцитов, торможением высвобождения цитокинов (интерлейкина-1, 2; гамма-интерферона) из лимфоцитов и макрофагов и снижением образования антител.
Противоаллергическое действие развивается в результате снижения синтеза и секреции медиаторов аллергии, торможения высвобождения из сенсибилизированных тучных клеток и базофилов гистамина и других биологически активных веществ, уменьшения числа циркулирующих базофилов, подавления развития лимфоидной и соединительной ткани, уменьшения количества Т- и В-лимфоцитов, тучных клеток, снижения чувствительности эффекторных клеток к медиаторам аллергии, угнетения антителообразования, изменения иммунного ответа организма.
При обструктивных заболеваниях дыхательных путей действие обусловлено, главным образом, торможением воспалительных процессов, предупреждением или уменьшением выраженности отека слизистых оболочек, снижением эозинофильной инфильтрации подслизистого слоя эпителия бронхов и отложением в слизистой оболочке бронхов циркулирующих иммунных комплексов, а также торможением эрозирования и десквамации слизистой оболочки. Повышает чувствительность β-адренорецепторов бронхов мелкого и среднего калибра к эндогенным катехоламинам и экзогенным симпатомиметикам, снижает вязкость слизи за счет уменьшения ее продукции. Подавляет синтез и секрецию АКТГ и вторично — синтез эндогенных ГКС.
Фармакокинетика
Всасывание
При приеме внутрь преднизолон хорошо всасывается из ЖКТ. Cmax в крови достигается через 1-1.5 ч после перорального приема.
Распределение
До 90% преднизолона связывается с белками плазмы крови: транскортином (кортизол-связывающим глобулином) и альбумином.
Метаболизм
Преднизолон метаболизируется в печени, частично в почках и других тканях, в основном путем конъюгации с глюкуроновой и серной кислотами. Метаболиты неактивны.
Выведение
Выводится с желчью и почками путем клубочковой фильтрации и на 80-90% реабсорбируется канальцами. 20% дозы выводится почками в неизмененном виде. Т1/2 из плазмы крови после перорального приема составляет 2-4 ч.
Показания препарата
Преднизолон
Системные заболевания соединительной ткани:
- системная красная волчанка;
- склеродермия;
- узелковый периартериит;
- дерматомиозит;
- ревматоидный артрит.
Острые и хронические воспалительные заболевания суставов:
- подагрический и псориатический артрит;
- остеоартрит (в т.ч. посттравматический);
- полиартрит;
- плече-лопаточный периартрит;
- анкилозирующий спондилоартрит (болезнь Бехтерева);
- ревматоидный артрит, в т.ч. ювенильный ревматоидный артрит;
- синдром Стилла у взрослых;
- бурсит;
- неспецифический тендосиновит;
- синовит;
- эпикондилит.
Острый ревматизм, острый ревмокардит.
Бронхиальная астма.
Острые и хронические аллергические заболевания в т.ч.:
- аллергические реакции на лекарственные средства и пищевые продукты;
- сывороточная болезнь;
- крапивница;
- аллергический ринит;
- лекарственная экзантема;
- поллиноз и др.
Заболевания кожи:
- пузырчатка;
- псориаз;
- экзема;
- атопический дерматит (распространенный нейродермит);
- контактный дерматит (с поражением большой поверхности кожи);
- токсидермия;
- себорейный дерматит;
- эксфолиативный дерматит;
- токсический эпидермальный некролиз (синдром Лайелла);
- буллезный герпетиформный дерматит;
- синдром Стивенса-Джонсона.
Отек головного мозга (только после подтверждения симптомов повышения внутричерепного давления результатами магнитно-резонансной или компьютерной томографии), обусловленный опухолью головного мозга и/или связанный с хирургическим вмешательством или лучевой терапией, после парентерального применения преднизолона.
Аллергические заболевания глаз:
- аллергические формы конъюнктивита.
Воспалительные заболевания глаз:
- симпатическая офтальмия;
- тяжелые вялотекущие передние и задние увеиты;
- неврит зрительного нерва.
Первичная или вторичная надпочечниковая недостаточность (в т.ч. состояние после удаления надпочечников). Препаратами выбора являются гидрокортизон или кортизон; при необходимости синтетические аналоги могут применяться в сочетании с минералокортикостероидами; особенно важно добавление минералокортикостероидов у детей.
Врожденная гиперплазия надпочечников.
Заболевания почек аутоиммунного генеза (в т.ч. острый гломерулонефрит); нефротический синдром (в т.ч. на фоне липоидного нефроза).
Подострый тиреоидит.
Заболевания крови и системы кроветворения:
- агранулоцитоз;
- панмиелопатия;
- аутоиммунная гемолитическая анемия;
- лимфо- и миелоидный лейкозы;
- лимфогранулематоз;
- тромбоцитопеническая пурпура;
- вторичная тромбоцитопения у взрослых;
- эритробластопения (эритроцитарная анемия);
- врожденная (эритроидная) гипопластическая анемия.
Интерстициальные заболевания легких:
- острый альвеолит;
- фиброз легких;
- саркоидоз II-III стадии.
Туберкулезный менингит, туберкулез легких, аспирационная пневмония (в сочетании со специфической химиотерапией).
Бериллиоз, синдром Леффлера (не поддающийся другой терапии), рак легкого (в комбинации с цитостатиками).
Рассеянный склероз.
Желудочно-кишечные заболевания:
- язвенный колит;
- болезнь Крона;
- локальный энтерит.
Гепатит.
Профилактика реакции отторжения трансплантата при пересадке органов.
Гиперкальциемия на фоне онкологических заболеваний.
Миеломная болезнь.
Открыть список кодов МКБ
| Код МКБ-10 | Показание |
| A15 | Туберкулез органов дыхания, подтвержденный бактериологически и гистологически |
| A17.0 | Туберкулезный менингит |
| C34 | Злокачественное новообразование бронхов и легкого |
| C81 | Болезнь Ходжкина [лимфогранулематоз] |
| C90.0 | Множественная миелома |
| C91 | Лимфоидный лейкоз [лимфолейкоз] |
| C92 | Миелоидный лейкоз [миелолейкоз] |
| D59 | Приобретенная гемолитическая анемия |
| D60 | Приобретенная чистая красноклеточная аплазия (эритробластопения) |
| D61 | Другие апластические анемии |
| D69.3 | Идиопатическая тромбоцитопеническая пурпура |
| D69.5 | Вторичная тромбоцитопения |
| D70 | Агранулоцитоз |
| D86.0 | Саркоидоз легких |
| E06.1 | Подострый тиреоидит |
| E25.0 | Врожденные адреногенитальные нарушения, связанные с дефицитом ферментов |
| E27.1 | Первичная недостаточность коры надпочечников |
| E27.2 | Аддисонов криз |
| E27.4 | Другая и неуточненная недостаточность коры надпочечников |
| E83.5 | Нарушения обмена кальция |
| G01 | Менингит при бактериальных болезнях, классифицированных в других рубриках |
| G35 | Рассеянный склероз |
| G93.6 | Отек мозга |
| H10.1 | Острый атопический (аллергический) конъюнктивит |
| H20.0 | Острый и подострый иридоциклит (передний увеит) |
| H20.1 | Хронический иридоциклит |
| H21 | Другие болезни радужной оболочки и цилиарного тела |
| H44.1 | Другие эндофтальмиты (симпатический увеит) |
| H46 | Неврит зрительного нерва |
| I01 | Ревматическая лихорадка с вовлечением сердца |
| J30.1 | Аллергический ринит, вызванный пыльцой растений |
| J30.3 | Другие аллергические риниты (круглогодичный аллергический ринит) |
| J45 | Астма |
| J63.2 | Бериллиоз |
| J69.0 | Пневмонит, вызванный пищей и рвотными массами |
| J82 | Легочная эозинофилия, не классифицированная в других рубриках (в т.ч. эозинофильная астма, пневмония Леффлера) |
| J84.0 | Альвеолярные и парието-альвеолярные нарушения |
| J84.1 | Другие интерстициальные легочные болезни с упоминанием о фиброзе |
| K50 | Болезнь Крона [регионарный энтерит] |
| K51 | Язвенный колит |
| K52 | Другие неинфекционные гастроэнтериты и колиты |
| K73 | Хронический гепатит, не классифицированный в других рубриках |
| L10 | Пузырчатка [пемфигус] |
| L13.0 | Дерматит герпетиформный |
| L20.8 | Другие атопические дерматиты (нейродермит, экзема) |
| L21 | Себорейный дерматит |
| L23 | Аллергический контактный дерматит |
| L24 | Простой раздражительный [irritant] контактный дерматит |
| L26 | Эксфолиативный дерматит |
| L27 | Дерматит, вызванный веществами, принятыми внутрь |
| L30.0 | Монетовидная экзема |
| L40 | Псориаз |
| L50 | Крапивница |
| L51.1 | Буллезная эритема многоформная (синдром Стивенса-Джонсона) |
| L51.2 | Токсический эпидермальный некролиз [Лайелла] |
| M05 | Серопозитивный ревматоидный артрит |
| M06.1 | Болезнь Стилла, развившаяся у взрослых |
| M07 | Псориатические и энтеропатические артропатии |
| M08 | Юношеский [ювенильный] артрит |
| M10 | Подагра |
| M15 | Полиартроз |
| M19 | Другие артрозы |
| M30.0 | Узелковый полиартериит |
| M32 | Системная красная волчанка |
| M33 | Дерматополимиозит |
| M34 | Системный склероз |
| M45 | Анкилозирующий спондилит |
| M65 | Синовиты и теносиновиты |
| M70 | Болезни мягких тканей, связанные с нагрузкой, перегрузкой и давлением |
| M71 | Другие бурсопатии |
| M75.0 | Адгезивный капсулит плеча |
| M77 | Другие энтезопатии (эпикондилит) |
| M79.0 | Ревматизм неуточненный |
| N00 | Острый нефритический синдром (острый гломерулонефрит) |
| N04 | Нефротический синдром |
| T78.0 | Анафилактический шок, вызванный патологической реакцией на пищу |
| T78.1 | Другие проявления патологической реакции на пищу |
| T80.6 | Другие сывороточные реакции |
| T86 | Отмирание и отторжение пересаженных органов и тканей |
| T88.7 | Патологическая реакция на лекарственное средство или медикаменты неуточненная |
Открыть список кодов МКБ-11
Режим дозирования
Препарат принимают внутрь, запивая небольшим количеством воды.
Доза и продолжительность лечения подбирается врачом в индивидуальном порядке в зависимости от показаний и тяжести заболевания. Подбор дозы и длительности лечения определяется в зависимости от индивидуального ответа на терапию.
Всю суточную дозу препарата рекомендуется принимать однократно или двойную суточную дозу — через день с учетом циркадного ритма эндогенной секреции ГКС в интервале от 6 до 8 ч утра. Суточную дозу препарата Преднизолон следует принимать после еды (завтрака). Высокую суточную дозу можно распределить на 2-4 приема, при этом по утрам следует принимать большую дозу.
При острых состояниях и в качестве заместительной терапии взрослым назначают в начальной дозе 20-30 мг/сут, поддерживающая доза составляет 5-10 мг/сут. При необходимости начальная доза может составить 15-100 мг/сут, поддерживающая 5-15 мг/сут.
Для детей от 3 лет и старше начальная доза составляет 1-2 мг/кг массы тела в сутки в 4-6 приемов, поддерживающая — 0.3-0.6 мг/кг/сут.
При получении терапевтического эффекта дозу постепенно снижают по 5 мг, затем по 2.5 мг с интервалами в 3-5 дней, отменяя сначала более поздние приемы.
При длительном приеме препарата суточную дозу следует снижать постепенно. Длительную терапию нельзя прекращать внезапно. Отмена поддерживающей дозы проводится тем медленнее, чем дольше применялась глюкокортикоидная терапия.
При стрессовых воздействиях (инфекция, аллергическая реакция, травма, операция, нервный стресс) во избежание обострения основного заболевания доза преднизолона должна быть временно увеличена (в 1.5-3, а в тяжелых случаях — в 5-10 раз).
Побочное действие
Частота развития и выраженность побочных эффектов зависят от длительности применения, величины используемой дозы и возможности соблюдения циркадного ритма назначения преднизолона.
Инфекционные и паразитарные заболевания: оппортунистическая инфекция, маскирование клинических симптомов инфекций, кандидозный эзофагит.
Со стороны иммунной системы: кожная сыпь, зуд, анафилактический шок.
Со стороны эндокринной системы: снижение толерантности к глюкозе, «стероидный» сахарный диабет или манифестация латентного сахарного диабета, угнетение функции надпочечников, синдром Иценко-Кушинга (лунообразное лицо, ожирение гипофизарного типа, гирсутизм, повышение АД, дисменорея, аменорея, мышечная слабость, стрии), гирсутизм, задержка полового развития у детей, повышенная потребность в инсулине или пероральных гипогликемических препаратах у пациентов с сахарным диабетом.
Со стороны обмена веществ и питания: повышенное выведение ионов кальция, гипокальциемия, увеличение массы тела, отрицательный азотистый баланс (повышенный распад белков), повышенная потливость, повышение или снижение аппетита.
Нарушения, обусловленные минералокортикоидной активностью: задержка жидкости и ионов натрия в организме (периферические отеки), гипернатриемия, гипокалиемический синдром (гипокалиемия, аритмия, миалгия или спазм мышц, необычная слабость и утомляемость).
Нарушения психики: суицидальные мысли, неадекватное поведение, раздражительность, спутанность сознания, перепады настроения, делирий, дезориентация, эйфория, галлюцинации, маниакально-депрессивный психоз, депрессия, паранойя, нервозность или беспокойство, бессонница.
Со стороны нервной системы: амнезия, повышение внутричерепного давления, псевдоопухоль мозжечка, головная боль, судороги, когнитивные расстройства, эпидуральный липоматоз.
Со стороны органа зрения: задняя субкапсулярная катаракта, повышение внутриглазного давления с возможным повреждением зрительного нерва, склонность к развитию вторичных бактериальных, грибковых или вирусных инфекционных заболеваний глаз, трофические изменения роговицы, экзофтальм, центральная серозная хориоретинопатия, глаукома.
Со стороны органа слуха и лабиринтные нарушения: головокружение, вертиго.
Со стороны сердца: аритмия, брадикардия (вплоть до остановки сердца); развитие (у предрасположенных пациентов) или прогрессирование хронической сердечной недостаточности, изменения на ЭКГ, характерные для гипокалиемии, тромбозы. При остром и подостром инфаркте миокарда возможно распространение очага некроза, замедление формирования рубцовой ткани, что может привести к разрыву сердечной мышцы.
Со стороны сосудов: повышение АД, гиперкоагуляция, тромбоэмболия (в т.ч. тромбоэмболия легочной артерии), телеангиоэктазии.
Со стороны ЖКТ: тошнота, рвота, панкреатит, «стероидная» язва желудка и двенадцатиперстной кишки, эрозивный эзофагит, желудочно-кишечные кровотечения и перфорация стенки ЖКТ, нарушение пищеварения, метеоризм, икота.
Со стороны печени и желчевыводящих путей: повышение активности печеночных трансаминаз и ЩФ.
Со стороны кожи и подкожных тканей: замедленное заживление ран, петехии, экхимозы, истончение кожи, гипер- или гипопигментация, угри, стрии, склонность к развитию пиодермии и кандидоза.
Со стороны костно-мышечной системы и соединительной ткани: замедление роста и процессов окостенения у детей (преждевременное закрытие эпифизарных зон роста), остеопороз (патологические переломы костей, асептический некроз головки плечевой и бедренной кости), разрыв сухожилий мышц, «стероидная» миопатия, снижение мышечной массы (атрофия).
Общие расстройства: недомогание.
Прочие: повышенная восприимчивость к инфекциям, обострение инфекций (появлению этой нежелательной реакции способствуют совместно применяемые иммунодепрессанты и вакцинация), лейкоцитурия, синдром «отмены ГКС», учащенное мочеиспускание в ночное время, мочекаменная болезнь.
Противопоказания к применению
- гиперчувствительность к преднизолону или к любому из вспомогательных веществ;
- дефицит лактазы, непереносимость лактозы, глюкозо-галактозная мальабсорбция;
- системный микоз;
- одновременное применение живых и ослабленных вакцин с иммуносупрессивными дозами препарата;
- инфекция глаз, обусловленная вирусом простого герпеса (из-за риска перфорации роговицы);
- период грудного вскармливания;
- детский возраст до 3 лет.
Применение препарата у пациентов с острым или подострым инфарктом миокарда не рекомендуется в виду риска распространения очага некроза, замедления формирования рубцовой ткани, и, как следствие этого, разрыва сердечной мышцы.
С осторожностью
С осторожностью препарат следует применять при следующих заболеваниях и состояниях:
Заболевания ЖКТ:
- язвенная болезнь желудка и двенадцатиперстной кишки;
- эзофагит, гастрит;
- острая или латентная пептическая язва;
- недавно созданный анастомоз кишечника;
- язвенный колит с угрозой перфорации или абсцедирования;
- дивертикулит.
Паразитарные и инфекционные заболевания вирусной, грибковой или бактериальной природы (текущие или недавно перенесенные, включая недавний контакт с болеющим):
- простой герпес;
- опоясывающий герпес (виремическая фаза);
- ветряная оспа;
- корь;
- амебиаз;
- стронгилоидоз;
- активный или латентный туберкулез.
Применение при тяжелых инфекционных заболеваниях допустимо только на фоне специфической противомикробной терапии.
Пре- и поствакцинальный период (8 недель до и 2 недели после вакцинации), лимфаденит после прививки БЦЖ. Иммунодефицитные состояния (в т.ч. СПИД или ВИЧ инфицирование).
Заболевания сердечно-сосудистой системы, в т.ч. хроническая сердечная недостаточность, артериальная гипертензия, гиперлипидемия.
Эндокринные заболевания:
- сахарный диабет (в т.ч. нарушение толерантности к углеводам);
- тиреотоксикоз;
- гипотиреоз;
- ожирение (III-IV ст.).
Хроническая почечная или печеночная недостаточность тяжелой степени, нефроуролитиаз.
Гипоальбуминемия и состояния, предрасполагающие к ее возникновению (цирроз печени, нефротический синдром).
Судорожный синдром.
Пожилые пациенты (высокий риск остеопороза и артериальной гипертензии).
Тромбоэмболические осложнения в анамнезе или предрасположенность к развитию данных состояний.
Нарушения психики в анамнезе, острый психоз.
Системный остеопороз, миастения gravis, полиомиелит (за исключением формы бульбарного энцефалита), открыто- и закрытоугольная глаукома.
Беременность.
У детей в период роста ГКС должны применяться только по абсолютным показаниям и при особо тщательном наблюдении лечащего врача.
Применение при беременности и кормлении грудью
Беременность
Преднизолон легко проникает через плацентарный барьер.
Во время беременности (особенно в I триместре) или у женщин, планирующих беременность, применение препарата показано только в том случае, когда ожидаемый лечебный эффект превышает риск отрицательного влияния преднизолона на мать и плод. ГКС следует назначать в период беременности только по абсолютным показаниям. При длительной терапии во время беременности происходит нарушение роста плода. В III триместре беременности имеется опасность возникновения атрофии коры надпочечников у плода, что может потребовать проведения заместительной терапии у новорожденного. Дети, рожденные от матерей, которые получали преднизолон во время беременности, должны тщательно обследоваться с целью своевременного выявления возможных симптомов надпочечниковой недостаточности. Отмечались случаи развития катаракты у новорожденных, матери которых принимали ГКС во время беременности.
Необходим тщательный мониторинг беременных с гестозами II половины беременности, в т.ч. с преэклампсией на фоне приема ГКС.
Влияние ГКС на течение и исход родов неизвестно.
Период грудного вскармливания
Поскольку ГКС проникают в грудное молоко, в случае необходимости применения препарата грудное вскармливание следует прекратить.
Применение при нарушениях функции печени
С осторожностью следует назначать препарат при печеночной недостаточности тяжелой степени.
Препарат оказывает более выраженное действие при наличии у пациента цирроза печени.
Применение при нарушениях функции почек
С осторожностью следует назначать препарат при хронической почечной недостаточности.
Применение у детей
Противопоказано применение препарата в возрасте до 3 лет.
У детей в период роста ГКС должны применяться только по абсолютным показаниям и при особо тщательном наблюдении лечащего врача.
Применение у пожилых пациентов
С осторожностью следует назначать препарат пациентам пожилого возраста (высокий риск остеопороза и артериальной гипертензии).
Особые указания
Поскольку осложнения терапии преднизолоном зависят от величины дозы и длительности лечения, то в каждом конкретном случае на основании анализа соотношения пользы-риска принимают решение о необходимости такого лечения, а также определяют длительность лечения и частоту приема.
Следует применять наименьшую дозу преднизолона, обеспечивающую достаточный терапевтический эффект, при необходимости снижение дозы следует проводить постепенно.
Ввиду опасности развития аритмии, применение преднизолона в высоких дозах следует проводить в условиях стационара, оснащенного необходимым оборудованием (электрокардиографом, дефибриллятором).
При наступлении длительной спонтанной ремиссии лечение следует прекратить.
При длительном лечении пациенту следует проходить регулярное обследование (рентгенография органов грудной клетки, определение концентрации глюкозы крови через 2 ч после еды, общий анализ мочи, АД, контроль массы тела, желательно проведение рентгенологического или эндоскопического обследования при наличии в анамнезе язвенных заболеваний ЖКТ).
Следует тщательно контролировать рост и развитие детей, находящихся на длительной терапии преднизолоном. Задержка роста может наблюдаться у детей, получающих длительную ежедневную, разделенную на несколько доз, терапию. Ежедневное применение преднизолона в течение длительного времени у детей возможно только по абсолютным показаниям. Применение препарата через день может уменьшить риск развития данной нежелательной реакции или позволит избежать ее вовсе.
Дети, получающие длительную терапию преднизолоном, находятся в группе повышенного риска развития внутричерепной гипертензии.
Пациенты, получающие препараты, подавляющие иммунную систему, более восприимчивы к инфекциям. Например, ветряная оспа и корь могут иметь более тяжелое течение, вплоть до летального исхода у неиммунизированных детей или у взрослых, получающих преднизолон.
Преднизолон также должен назначаться с большой осторожностью пациентам с подтвержденными или подозреваемыми паразитарными инфекциями, такими как, стронгилоидоз. Вызванная преднизолоном иммуносупрессия у таких пациентов приводит к стронгилоидной гиперинфекции и диссеминации процесса с распространенной миграцией личинок, часто с развитием тяжелых форм энтероколита и грамотрицательной септицемии с возможным летальным исходом.
На фоне терапии преднизолоном может увеличиться восприимчивость к инфекциям, некоторые инфекции могут протекать в стертой форме, кроме того, могут развиваться новые инфекции. Также снижается способность организма к локализации инфекционного процесса. Развитие инфекций, вызываемых различными патогенными организмами, такими как вирусы, бактерии, грибы, простейшие или гельминты, которые локализуются в различных системах организма человека, может быть связано с применением преднизолона, как в качестве монотерапии, так и в сочетании с другими иммунодепрессантами, воздействующими на клеточный иммунитет, гуморальный иммунитет или на функцию нейтрофилов. Эти инфекции могут протекать нетяжело, однако в ряде случаев возможно тяжелое течение и даже летальный исход. Чем более высокие дозы препарата применяются, тем выше вероятность развития инфекционных осложнений.
Пациентам, получающим лечение преднизолоном в дозах, оказывающих иммуносупрессивное действие, противопоказано введение живых или живых ослабленных вакцин, но можно вводить убитые или инактивированные вакцины, однако реакция на введение таких вакцин может быть снижена или даже отсутствовать. Пациентам, получающим лечение преднизолоном в дозах, не оказывающих иммуносупрессивного действия, по соответствующим показаниям может проводиться иммунизация.
Применение преднизолона при активном туберкулезе следует ограничить случаями молниеносного и диссеминированного туберкулеза, когда преднизолон применяют для лечения заболевания в сочетании с соответствующей противотуберкулезной химиотерапией. Если преднизолон назначают пациентам с латентным туберкулезом или с положительными туберкулиновыми пробами, то лечение следует проводить под строгим врачебным контролем, поскольку возможна реактивация заболевания. Во время длительной терапии препаратом такие пациенты должны получать соответствующее профилактическое лечение.
Отмечены случаи развития саркомы Капоши у пациентов, получавших терапию ГКС. При отмене препарата может наступить клиническая ремиссия.
При применении препарата Преднизолон в терапевтических дозах в течение длительного периода может развиться супрессия гипоталамо-гипофизарно-надпочечниковой системы (вторичная недостаточность коры надпочечников). Степень и длительность недостаточности коры надпочечников индивидуальны у каждого пациента и зависят от дозы, частоты применения, времени приема и длительности терапии.
Выраженность данного эффекта можно уменьшить с помощью применения препарата через день или постепенным снижением дозы. Этот тип относительной недостаточности коры надпочечников может продолжаться в течение нескольких месяцев после окончания лечения, поэтому при любых стрессовых ситуациях в этот период следует вновь назначить преднизолон.
При резкой отмене препарата возможно развитие острой надпочечниковой недостаточности, приводящей к летальному исходу.
Синдром «отмены ГКС» (не относящийся к надпочечниковой недостаточности) также может возникать вследствие резкой отмены препарата. Данный синдром включает такие симптомы, как анорексия, тошнота, рвота, летаргия, головная боль, лихорадка, боль в суставах, шелушение кожи, миалгия, снижение массы тела и снижение АД. Предполагается, что данные эффекты возникают в связи с резким колебанием концентрации преднизолона в плазме крови, а не по причине ее снижения.
У пациентов с гипотиреозом или циррозом печени отмечается более выраженный эффект преднизолона.
Поскольку может нарушаться секреция минералокортикоидов, необходимо сопутствующее назначение электролитов и/или минералокортикоидов.
Средние и большие дозы гидрокортизона или кортизона могут вызывать повышение АД, задержку ионов натрия и воды и повышенную экскрецию калия. Эти эффекты менее вероятны при применении синтетических ГКС (в т.ч. преднизолона), за исключением случаев, когда они применяются в высоких дозах. Необходимо ограничение потребления поваренной соли с пищей и назначение препаратов калия. Все ГКС увеличивают выведение кальция.
Применение преднизолона может приводить к увеличению концентрации глюкозы в плазме крови, ухудшению течения имеющегося сахарного диабета. Пациенты, получающие длительную терапию преднизолоном, могут быть предрасположены к развитию сахарного диабета.
Пациентам, которые могут подвергнуться воздействию стресса на фоне терапии преднизолоном, показано увеличение дозы препарата до, во время и после стрессовой ситуации.
На фоне терапии преднизолоном возможно развитие различных психических расстройств: от эйфории, бессонницы, перепадов настроения и депрессии до острых психических проявлений. Кроме того, могут усиливаться уже имеющиеся эмоциональная лабильность или склонность к психотическим реакциям.
При применении преднизолона могут возникать потенциально тяжелые психические расстройства. Симптомы обычно проявляются в течение нескольких дней или недель от начала терапии. Большинство реакций исчезает либо после снижения дозы, либо после отмены препарата. Несмотря на это может потребоваться специфическое лечение. Пациентов и/или их родственников следует предупредить, что в случае появления изменений в психологическом статусе пациента (особенно при развитии депрессивного состояния и суицидальных попыток) необходимо обратиться за медицинской помощью. Также следует предупредить пациентов или их родственников о возможности развития психических нарушений во время или сразу после снижения дозы препарата или полной его отмены.
Имеются сообщения о развитии эпидурального липоматоза у пациентов, получающих ГКС (обычно при длительной терапии высокими дозами).
Длительное применение преднизолона может привести к возникновению задней субкапсулярной катаракты, экзофтальма или глаукомы с возможным поражением зрительного нерва и провоцировать присоединение вторичной глазной грибковой или вирусной инфекции.
В силу существующего риска перфорации роговицы, назначать ГКС при терапии заболевания глаз, вызванного вирусом простого герпеса (офтальмогерпеса) следует с осторожностью.
Терапия преднизолоном может привести к развитию центральной серозной хориоретинопатии, что в свою очередь может привести к отслойке сетчатки.
Терапия преднизолоном может маскировать симптомы пептической язвы и в этом случае перфорация или кровотечение могут развиться без значительного болевого синдрома.
Следует применять с осторожностью преднизолон пациентам с факторами риска сердечно-сосудистых заболеваний, в т.ч. с гиперлипидемией и пациентам, предрасположенным к повышению АД, поскольку прием преднизолона может провоцировать новые реакции в случае применения высоких доз препарата и длительного лечения. Необходим регулярный контроль функции сердца. Применение низких доз преднизолона через день может снизить выраженность данных реакций.
Необходимо тщательное наблюдение за пациентами, получающими системные ГКС, и недавно перенесшими инфаркт миокарда.
Пациентам, принимающим преднизолон, следует с осторожностью назначать анальгетики на основе ацетилсалициловой кислоты и НПВП.
Возможны аллергические реакции. В силу того, что у пациентов, получавших ГКС, редко отмечались такие явления, как раздражение кожи и анафилактические или псевдоанафилактические реакции, перед назначением ГКС следует принять необходимые меры, особенно если в анамнезе пациента имеется история аллергических реакций на лекарственные препараты.
Высокие дозы ГКС могут вызвать острый панкреатит.
Терапия высокими дозами ГКС может стать причиной острой миопатии; при этом заболеванию более всего подвержены пациенты с нарушениями нейромышечной передачи (например, миастения gravis), а также пациенты, получающие сопутствующую терапию холинолитиками, например, блокаторами нервно-мышечной передачи. Миопатия такого рода является генерализованной; она может затронуть мышцы глаз или дыхательной системы и даже привести к параличу всех конечностей. Кроме этого, может повыситься активность креатинкиназы. В подобных случаях клиническое выздоровление может занять недели и даже годы.
Остеопороз является часто встречающимся (но редко выявляемым) осложнением при длительной терапии высокими дозами ГКС.
ГКС с осторожностью назначают для длительной терапии у пациентов пожилого возраста из-за увеличенного риска остеопороза и задержки жидкости в организме, что потенциально вызывает повышение АД.
Одновременное лечение метилпреднизолоном и фторхинолонами увеличивает риск разрыва сухожилий, в особенности у пациентов пожилого возраста.
Т.к. преднизолон может усиливать клинические проявления синдрома Иценко-Кушинга, следует избегать применения преднизолона у пациентов с данным заболеванием.
Необходимо тщательное наблюдение за пациентами, имеющими в анамнезе или в настоящее время тромбозы или тромбоэмболические осложнения.
Влияние на способность к управлению транспортными средствами и механизмами
В период приема препарата необходимо воздержаться от управления транспортными средствами и занятий потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций.
Передозировка
Симптомы: возможно усиление дозозависимых нежелательных реакций, которые требуют снижения дозы преднизолона. При длительном приеме препарата возможно развитие синдрома Иценко-Кушинга.
Лечение: симптоматическое. При однократном приеме избыточной дозы препарата следует провести промывание желудка; возможен прием активированного угля.
Лекарственное взаимодействие
Одновременное применение преднизолона с:
- индукторами микросомальных ферментов печени (фенобарбитал, рифампицин, фенитоин, теофиллин, эфедрин, карбамазепин, аминоглутетимид, примидон, рифабутин) — приводит к снижению его концентрации в плазме крови;
- мифепристоном — уменьшение действия преднизолона на протяжении 3-4 дней после приема мифепристона;
- метотрексатом — повышение токсичности метотрексата вследствие уменьшения метаболизма преднизолона;
- этопозидом — повышение эффективности и усиление токсического действия этопозида вследствие ингибирования его метаболизма в печени под влиянием преднизолона;
- диуретиками (особенно тиазидными и ингибиторами карбоангидразы) и амфотерицином В — может привести к усилению выведения из организма ионов калия (К+);
- натрийсодержащими препаратами — может привести к развитию отеков и повышению АД;
- амфотерицином В — увеличивается риск развития сердечной недостаточности;
- сердечными гликозидами — ухудшается их переносимость и повышается вероятность развития желудочковой экстрасистолии (из-за вызываемой гипокалиемии);
- непрямыми антикоагулянтами — ослабляет (реже усиливает) их действие (требуется коррекция дозы);
- антикоагулянтами и тромболитиками — повышается риск развития кровотечений из язв в ЖКТ;
- этанолом и НПВП — повышается риск возникновения эрозивно-язвенных поражений в ЖКТ и развития кровотечений (в комбинации с НПВП при лечении артритов возможно снижение дозы ГКС из-за суммации терапевтического эффекта);
- парацетамолом — возрастает риск развития гепатотоксичности (индукция печеночных ферментов и образования токсичного метаболита парацетамола);
- ацетилсалициловой кислотой — ускоряет ее выведение и снижает концентрацию в крови (при отмене преднизолона концентрация салицилатов в крови увеличивается и возрастает риск развития нежелательных реакций);
- инсулином и пероральными гипогликемическими препаратами, гипотензивными средствами — уменьшается их эффективность;
- витамином D — снижается его влияние на всасывание ионов кальция (Са2+) в кишечнике;
- соматотропным гормоном — снижает его эффективность;
- празиквантелом — снижает его концентрацию;
- м-холиноблокаторами (включая антигистаминные препараты и трициклические антидепрессанты с м-холиноблокирующей активностью) и нитратами — способствует повышению внутриглазного давления;
- изониазидом и мексилетином — увеличивает их метаболизм (особенно у «медленных» ацетиляторов), что приводит к снижению их плазменных концентраций.
Ингибиторы карбоангидразы и «петлевые» диуретики могут увеличивать риск развития остеопороза.
Индометацин, вытесняя преднизолон из связи с альбумином, увеличивает риск развития его нежелательных реакций.
АКТГ усиливает действие преднизолона.
Эргокальциферол и паратгормон препятствуют развитию остеопатии, вызываемой преднизолоном.
Циклоспорин и кетоконазол, замедляя метаболизм преднизолона, могут в ряде случаев увеличивать его токсичность.
Одновременное применение андрогенов и стероидных анаболических препаратов с преднизолоном способствует развитию периферических отеков и гирсутизма, появлению угрей.
Эстрогены и пероральные эстрогенсодержащие контрацептивы снижают клиренс преднизолона, что может сопровождаться усилением выраженности его действия.
Митотан и другие ингибиторы функции коры надпочечников могут обусловливать необходимость повышения дозы преднизолона.
При одновременном применении с живыми противовирусными вакцинами и на фоне других видов иммунизаций — увеличивает риск активации вирусов и развития инфекций.
Антипсихотические средства (нейролептики) и азатиоприн повышают риск развития катаракты при применении преднизолона.
Иммунодепрессанты повышают риск развития инфекций и лимфомы или других лимфопролиферативных заболеваний, вызванных вирусом Эпштейна-Барр.
Одновременное применение антацидов снижает всасывание преднизолона.
При одновременном применении с антитиреоидными препаратами снижается, а с тиреоидными гормонами — повышается клиренс преднизолона.
Условия хранения препарата Преднизолон
Препарат следует хранить в недоступном для детей месте при температуре не выше 25°С.
Срок годности препарата Преднизолон
Срок годности — 5 лет. Не применять по истечении срока годности, указанного на упаковке.
Условия реализации
Препарат отпускают по рецепту.
ГЕДЕОН РИХТЕР ОАО
(Венгрия)
|
Организация, принимающая претензии потребителей: |
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Аналоги препарата
-
Преднизолон
(УРАЛБИОФАРМ, Россия) -
Преднизолон
(SIMPEX PHARMA, Индия) -
Преднизолон
(БИОСИНТЕЗ, Россия) -
Преднизолон
(IPCA LABORATORIES, Индия) -
Преднизолон
(МОСХИМФАРМПРЕПАРАТЫ им. Н.А.Семашко, Россия) -
Преднизолон
(M.J. BIOPHARM, Индия) -
Преднизолон Реневал
(ОБНОВЛЕНИЕ ПФК, Россия)
Все аналоги
Флуконазол (капсулы, 150 мг), инструкция по медицинскому применению РУ № ЛП-001477
Дата последнего изменения: 28.12.2023
Содержание
- Действующее вещество
- ATX
- Фармакологическая группа
- Лекарственная форма
- Состав
- Описание лекарственной формы
- Фармакокинетика
- Фармакодинамика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Производитель
- Аналоги (синонимы) препарата Флуконазол
- Заказ в аптеках Москвы
Действующее вещество
ATX
Фармакологическая группа
Лекарственная форма
Состав
Одна
капсула 50 мг содержит:
Действующее вещество
Флуконазол
— 50 мг.
Вспомогательные вещества
Целлюлоза
микрокристаллическая 43 мг, крахмал кукурузный — 5 мг, кремния
диоксид коллоидный (аэросил) — 1 мг, магния стеарат — 1 мг.
Состав капсулы № 3:
желатин — 98%, титана диоксид [E171] — 2,0%.
Одна
капсула 150 мг содержит:
Действующее вещество
Флуконазол
— 150 мг.
Вспомогательные вещества
Целлюлоза
микрокристаллическая 129 мг, крахмал кукурузный — 15 мг, кремния диоксид
коллоидный (аэросил) — 3 мг, магния стеарат — 3 мг.
Состав капсулы № 0:
желатин — до 100%, титана диоксид [E171] — 1,3333%, краситель хинолиновый
желтый [E104] — 0,9197%, краситель солнечный закат желтый [E110] — 0,0044%.
Описание лекарственной формы
Дозировка 50 мг:
капсулы твердые желатиновые непрозрачные белого цвета № 3. Содержимое
капсул — порошок белого или белого с желтоватым оттенком цвета.
Дозировка 150 мг:
капсулы твердые желатиновые непрозрачные желтого цвета № 0. Содержимое
капсул — порошок белого или белого с желтоватым оттенком цвета.
Фармакокинетика
Всасывание
Фармакокинетика
флуконазола сходна при внутривенном введении и приеме внутрь.
После
приема внутрь флуконазол хорошо всасывается, его концентрации в плазме крови (и общая
биодоступность) превышают 90% от таковых при внутривенном введении.
Одновременный прием пищи не влияет на всасывание флуконазола.
Распределение
Концентрация
в плазме крови пропорциональна дозе и достигает максимума через 0,5–1,5 ч
после приема флуконазола натощак, а период полувыведения (T1/2)
составляет около 30 ч.
90% равновесной
концентрации достигаются к 4–5‑му дню после начала терапии (при многократном
приеме препарата 1 раз в сутки). Максимальная концентрация (Cmax)
флуконазола в слюне при приеме капсулы достигается через 4 ч.
Введение
ударной дозы (в 1-й день), в 2 раза превышающей обычную суточную дозу, делает
возможным достижение 90% равновесной концентрации ко 2‑му дню. Объем
распределения приближается к общему содержанию воды в организме. Связывание с
белками плазмы крови — низкое (11–12%).
Флуконазол
хорошо проникает во все жидкости организма. Концентрации флуконазола в слюне и
мокроте сходны с его концентрациями в плазме крови. У пациентов с грибковым
менингитом концентрации флуконазола в спинномозговой жидкости составляют около
80% от его концентраций в плазме крови.
В
роговом слое, эпидермисе, дерме и потовой жидкости достигаются высокие
концентрации, которые превышают сывороточные. Флуконазол накапливается в
роговом слое. При приеме в дозе 50 мг 1 раз в сутки концентрация
флуконазола через 12 дней составляет 73 мкг/г, а через 7 дней
после прекращения лечения — только 5,8 мкг/г. При применении в дозе
150 мг 1 раз в неделю концентрация флуконазола в роговом слое на 7‑й день
составляет 23,4 мкг/г, а через 7 дней после приема второй дозы —
7,1 мкг/г.
Концентрация
флуконазола в ногтях после 4-месячного применения в дозе 150 мг 1 раз в
неделю составляет 4,05 мкг/г в здоровых и 1,8 мкг/г в пораженных
ногтях; через 6 мес после завершения терапии флуконазол по-прежнему
определяется в ногтях.
Биотрансформация
Циркулирующие
метаболиты не обнаружены.
Выведение
Препарат
выводится в основном почками: примерно 80% введенной дозы обнаруживается в моче
в неизмененном виде. Клиренс флуконазола пропорционален клиренсу креатинина (КК).
Длительный
период полувыведения (T1/2)
из плазмы крови позволяет принимать флуконазол однократно при вагинальном
кандидозе и 1 раз в сутки или 1 раз в неделю — при других показаниях.
В
ходе исследования фармакокинетики с участием 10 женщин, временно или полностью
прекративших кормление грудью, оценивали концентрацию флуконазола в плазме
крови и грудном молоке в течение 48 ч после однократного приема
150 мг препарата. Флуконазол был обнаружен в грудном молоке в средней
концентрации, составляющей приблизительно 98% от концентрации флуконазола в
плазме крови матери. Средняя пиковая концентрация составляла 2,61 мг/л по
истечении 5,2 ч после приема препарата.
Фармакокинетика у детей
У
детей были получены следующие значения фармакокинетических параметров:
|
Возраст |
Доза |
T1/2 |
AUC (мкг•ч/мл) |
|
9 |
Однократно |
25,0 |
94,7 |
|
9 |
Однократно |
19,5 |
362,5 |
|
Средний |
Многократно |
15,5 |
41,6 |
Фармакокинетика у пациентов пожилого возраста
Было
установлено, что при однократном применении флуконазола в дозе 50 мг
внутрь у пациентов пожилого возраста 65 лет
и старше, некоторые из которых одновременно принимали диуретики, Cmax
достигалась через 1,3 ч
после приема и составляла 1,54 мкг/мл, средние значения AUC — 76,4 ± 20,3 мкг•ч/мл, а средний T1/2
— 46,2 ч.
Значения
этих фармакокинетических параметров выше, чем у молодых пациентов, что,
вероятно, связано с пониженной почечной функцией, характерной для пожилого
возраста. Одновременный прием диуретиков не вызывал выраженного изменения AUC и Cmax.
КК
(74 мл/мин), процент флуконазола, выводимого почками в неизменном виде
(0–24 ч, 22%) и почечный клиренс флуконазола (0,124 мл/мин/кг) у
пациентов пожилого возраста ниже по сравнению с молодыми пациентами.
Фармакодинамика
Флуконазол,
триазольное противогрибковое средство, является мощным селективным ингибитором
синтеза стеролов в клетке грибов.
Его
основной механизм действия заключается в ингибировании опосредованной грибковым
цитохромом P450 реакции деметилирования 14‑альфа-ланостерола,
являющейся ключевым этапом биосинтеза эргостерола в грибах. Накопление 14‑альфа-метил-стеролов
коррелирует с последующей потерей эргостерола, входящего в состав клеточной
мембраны грибов; этот процесс, возможно, лежит в основе противогрибкового
действия флуконазола. Показано, что флуконазол более селективен по отношению к
ферментам семейства цитохрома P450 грибов, чем по отношению к
различным ферментам семейства цитохрома P450 млекопитающих.
Флуконазол
обладает высокой специфичностью в отношении грибковых ферментов, зависимых от
цитохрома P450. Терапия флуконазолом в дозе 50 мг в сутки в
течение до 28 дней не влияет на концентрацию тестостерона в плазме
крови у мужчин или концентрацию стероидов у женщин детородного возраста.
Флуконазол в дозе 200–400 мг в сутки не оказывает клинически
значимого влияния на уровни эндогенных стероидов и их реакцию на стимуляцию
адренокортикотропного гормона (АКТГ) у здоровых мужчин-добровольцев.
Исследования взаимодействия с антипирином показали, что ни однократный, ни
многократный прием доз флуконазола по 50 мг не влияет на его
метаболизм.
Фармакокинетическая/фармакодинамическая зависимость
В
исследованиях на животных выявлена зависимость между значениями минимальной
ингибирующей концентрации (МИК) и эффективностью в отношении экспериментальных
микозов, обусловленных грибком рода Candida.
В клинических исследованиях имело место практически линейное отношение 1:1
между площадью под кривой «концентрация-время» (AUC) и дозой флуконазола.
Существует хотя и прямая, но неполная взаимосвязь между показателем AUC или
дозой и успешным клиническим ответом кандидоза ротовой полости, и в меньшей
степени кандидемии на терапию. Аналогичный метод лечения в меньшей степени
подходит для лечения инфекций, вызванных штаммами с высокой МИК флуконазола.
Микробиология
Флуконазол
продемонстрировал противогрибковую активность in vitro
в отношении распространенных в клинической практике видов грибка Candida (включая C. albicans, C. parapsilosis,
C. tropicalis). C. glabrata
демонстрирует пониженную чувствительность к флуконазолу, в то время как C. krusei имеет природную
устойчивость к воздействию флуконазола. МИК и эпидемиологическое пороговое
значение EUCAST (ECOFF) флуконазола для C. guilliermondii
выше, чем для C. albicans.
Недавно появившиеся виды грибка C. auris
сравнительно устойчивы к воздействию флуконазола.
Установлена
также активность флуконазола in vitro
в отношении Cryptococcus neoformans
и Cryptococcus gattii,
а также против эндемических плесневых грибов Blastomyces dermatitidis, Coccidioides immitis, Histoplasma capsulatum
и Paracoccidioides brasiliensis.
При
приеме внутрь флуконазол проявляет активность на различных моделях грибковых
инфекций у животных. Продемонстрирована активность препарата при
оппортунистических микозах, в т.ч. вызванных Candida spp. (включая генерализованный кандидоз у животных
с подавленным иммунитетом), Cryptococcus
neoformans (включая внутричерепные инфекции), Microsporum spp. и Trichophyton spp.
Установлена
также активность флуконазола на моделях эндемических микозов у животных,
включая инфекции, вызванные Blastomyces
dermatitidis, Coccidioides immitis (включая внутричерепные инфекции)
и Histoplasma capsulatum у
животных с нормальным и подавленным иммунитетом.
Механизмы развития резистентности к флуконазолу
У
обычно восприимчивых видов Candida
наиболее часто встречающийся механизм устойчивости включает целевые ферменты
азолов, которые участвуют в биосинтезе эргостерола. Механизм резистентности
связан со сниженной чувствительностью фермента-мишени к ингибирующему
воздействию флуконазола. Точечные мутации в гене ERG11, кодирующем
фермент-мишень, приводят к видоизменению мишени и снижению аффинности к азолам.
Увеличение экспрессии гена ERG11 приводит к продукции высоких концентраций
фермента-мишени, что создает потребность в увеличении концентрации флуконазола
во внутриклеточной жидкости для подавления всех молекул фермента в клетке.
Второй
значительный механизм резистентности заключается в активном выведении
флуконазола из внутриклеточного пространства посредством активации двух типов
транспортеров, участвующих в активном выведении (эффлюксе) препаратов из
грибковой клетки. К таким транспортерам относится главный посредник, кодируемый
генами MDR (множественной лекарственной устойчивости), и суперсемейство
АТФ-связывающей кассеты транспортеров, кодируемое генами CDR.
Гиперэкспрессия
гена MDR приводит к резистентности к флуконазолу, в то же время гиперэкспрессия
генов CDR может приводить к резистентности к различным азолам.
Резистентность
к C. glabrata обычно
опосредована гиперэкспрессией гена CDR, что приводит к резистентности ко многим
азолам.
Сообщалось
о случаях суперинфекции видами Candida,
отличными от C. albicans,
которые часто обладают пониженной чувствительностью (C. glabrata) или резистентностью к флуконазолу
(например, C. krusei, C. auris).
Такие инфекции могут потребовать альтернативной противогрибковой терапии.
Пограничные значения чувствительности
Пограничные значения чувствительности (согласно EUCAST)
Основываясь
на анализе чувствительности фармакокинетических/фармакодинамических (ФК/ФД)
данных, чувствительности in vitro
и клиническом ответе, EUCAST-AFST (Европейский комитет по определению
чувствительности микроорганизмов к антимикробным препаратам — подкомитет по
определению чувствительности к противогрибковым препаратам) определил границы
чувствительности к флуконазолу для видов Candida
(документ «EUCAST Fluconazole rational document»;
Европейский комитет по определению чувствительности микроорганизмов к
антимикробным препаратам — подкомитет по определению чувствительности к
противогрибковым препаратам (документ «Таблицы пограничных значений
чувствительности для интерпретации значений МИК»)). Пограничные значения были
разделены на не относящиеся к видам, которые были определены
преимущественно на основании данных ФК/ФД и не зависят от распределения
МИК для конкретных видов, и связанные с видами, которые наиболее часто вызывают
инфекции у людей. Эти пограничные значения представлены в таблице ниже.
|
Противо-грибковые |
Границы |
Границы чувствительности, |
|||||
|
Candida albicans |
Candida dubliniensis |
Candida glabrata |
Candida krusei |
Candida parapsilosis |
Candida tropicalis |
||
|
Флуконазол |
2/4 |
2/4 |
0,001/16* |
– |
2/4 |
2/4 |
2/4 |
Ч
— чувствительный; Р — резистентный.
А — границы
чувствительности, которые не зависят от вида возбудителя, были определены
преимущественно на основании данных ФК/ФД и не зависят от распределения МИК
конкретных видов. Они предназначены исключительно для применения для
организмов, которые не имеют специфического пограничного значения.
Прочерк
— не рекомендуется проводить испытания на чувствительность, поскольку данный
вид плохо поддается терапии упомянутым лекарственным препаратом.
* Весь
C. glabrata относится к I
категории. МИК против C. glabrata
следует интерпретировать как резистентные, если они превышают 16 мг/л.
Категория чувствительности (≤0,001 мг/л) предназначена просто для
того, чтобы избежать ошибочной классификации штаммов «I» как
штаммов «S».
I — Чувствительный,
с повышенным воздействием: микроорганизм классифицируется как Чувствительный, с
повышенным воздействием, когда существует высокая вероятность терапевтического
успеха, поскольку воздействие агента увеличивается за счет корректировки режима
дозирования или его концентрации в месте инфекции.
Пограничные значения чувствительности согласно критериям
Института Клинических и Лабораторных Стандартов (ИКЛС)
Пограничные
значения чувствительности к флуконазолу, признанные ИКЛС, указаны в таблице
ниже.
|
Candida Species |
Контрольные |
||
|
Чувствительность |
чДзА |
Резистентность |
|
|
C. albicans |
≤2 |
4 |
≥8 |
|
C. glabrataБ |
– |
≤32 |
≥64 |
|
C. kruseiВ |
– |
– |
– |
|
C. parapsilosis |
≤2 |
4 |
≥8 |
|
C. tropicalis |
≤2 |
4 |
≥8 |
А — Чувствительность
дозозависимая: Чувствительность зависит от достижения максимально возможного
уровня в крови. Взрослым с нормальной функцией почек и телосложением могут
потребоваться дозы флуконазола, превышающие стандартную дозировку
(6 мг/кг/день).
Б — В
отношении флуконазола эти рекомендации основаны на обширном опыте лечения
слизистых оболочек и инвазивных инфекций, вызванных Candida spp. Если изолят идентифицирован как C. glabrata, а МИК составляет
≤32 мг/л, следует определить, подходит ли флуконазол в конкретном
клиническом контексте. В этом случае пациенты должны получать максимальную
дозировку флуконазола. Может быть полезна консультация специалиста по выбору
режима максимальной дозировки.
В — Предполагается,
что изоляты C. krusei
обладают природной резистентностью к флуконазолу, поэтому их МИК
не следует интерпретировать с использованием данной шкалы.
Пограничные значения чувствительности согласно критериям FDA
(Требования FDA США для USPI)
Food Drug Administration
(FDA) Соединенных Штатов Америки принимает пограничные значения Ч и Р
ИКЛС; хотя не использует терминологию чДз и рассматривает эти значения как
«промежуточные» (I) (https://www.fda.gov/STIC).
Показания
Флуконазол показан для лечения следующих заболеваний у
взрослых:
—
криптококкового
менингита;
—
кокцидиоидомикоза;
—
инвазивного
кандидоза;
—
слизистого кандидоза,
в т.ч. орофарингеального кандидоза, кандидоза пищевода, кандидурии и
хронического кожно-слизистого кандидоза;
—
хронического
атрофического кандидоза ротовой полости (связанного с ношением зубных
протезов), когда соблюдения гигиены полости рта или местного лечения
недостаточно;
—
вагинального
кандидоза, острого или рецидивирующего, когда местная терапия не применима;
—
кандидозного
баланита, когда местная терапия не применима;
—
дерматомикозов,
в т.ч. дерматофитии стоп, дерматофитии туловища, паховой дерматофитии,
разноцветного лишая и кожного кандидоза, когда показано системное лечение;
—
дерматофитии
ногтей (онихомикоза), когда лечение другими препаратами не приемлемо.
Флуконазол показан для профилактики следующих заболеваний у
взрослых:
—
рецидивов
криптококкового менингита у пациентов с высоким риском рецидива;
—
рецидивов
орофарингеального кандидоза и кандидоза пищевода у ВИЧ-инфицированных пациентов
с высоким риском рецидива;
—
для снижения
частоты рецидивов вагинального кандидоза (4 и более эпизодов в год);
—
для профилактики
кандидозных инфекций у пациентов с продолжительной нейропенией (таких как
пациенты с гемобластозами, проходящими химиотерапию, или пациенты, проходящие
трансплантацию гемопоэтических стволовых клеток).
Флуконазол показан для лечения детей от 3 лет:
Флуконазол
применяют для лечения слизистого кандидоза (орофарингеального кандидоза и
кандидоза пищевода), инвазивного кандидоза, криптококкового менингита и
профилактики кандидозных инфекций у пациентов с ослабленной иммунной системой.
Флуконазол можно применять в качестве поддерживающей терапии для предотвращения
рецидива криптококкового менингита у детей с высоким риском рецидива.
Противопоказания
—
Повышенная
чувствительность к флуконазолу, другим компонентам препарата или азольным
веществам со сходной флуконазолу структурой.
—
Одновременный
прием терфенадина во время многократного применения флуконазола в дозе
400 мг в сутки и более (см. раздел «Взаимодействие с другими
лекарственными средствами»).
—
Одновременное
применение с препаратами, увеличивающими интервал QT и метаболизирующимися
с помощью изофермента CYP3A4, такими как цизаприд, астемизол, эритромицин,
пимозид, хинидин (см. раздел «Взаимодействие с другими лекарственными
средствами»).
—
Детский возраст
до 3 лет (для данной лекарственной формы).
С осторожностью
—
Печеночная
недостаточность.
—
Почечная
недостаточность.
—
Появление сыпи
на фоне применения флуконазола у пациентов с поверхностной грибковой инфекцией
и инвазивными/системными грибковыми инфекциями.
—
Одновременное
применение терфенадина и флуконазола в дозе менее 400 мг в сутки.
—
Потенциально
проаритмические состояния у пациентов с множественными факторами риска
(органические заболевания сердца, нарушения электролитного баланса и
способствующая развитию подобных нарушений сопутствующая терапия).
Применение при беременности и кормлении грудью
Женщины с детородным потенциалом
Необходимо
рассмотреть эффективные методы контрацепции у женщин детородного возраста в
течение всего периода лечения и приблизительно в течение недели (5–6 T1/2)
после принятия последней дозы препарата (см. раздел «Фармакокинетика»).
Беременность
Адекватных
и контролируемых исследований безопасности применения флуконазола у беременных
женщин не проводилось.
Во
время беременности применения флуконазола следует избегать, за исключением
случаев тяжелых и потенциально угрожающих жизни грибковых инфекций, когда
ожидаемая польза лечения для матери превышает возможный риск для плода.
Сообщалось
о случаях самопроизвольного аборта и развития врожденных аномалий у младенцев, чьи
матери получали флуконазол в дозе 150 мг однократно или повторно в
I триместре беременности.
Описаны
случаи множественных врожденных пороков у новорожденных, матери которых на
протяжении большей части или всего I триместра получали терапию
флуконазолом в высокой дозе (400–800 мг в сутки). Были отмечены следующие
нарушения развития: брахицефалия, нарушение развития лицевой части черепа,
нарушение формирования свода черепа, волчья пасть, искривление бедренных
костей, истончение и удлинение ребер, артрогрипоз и врожденные пороки сердца.
Период грудного вскармливания
Флуконазол
обнаруживается в грудном молоке в концентрациях, близких к плазменным (см.
раздел «Фармакокинетика»). T1/2
препарата из грудного молока приблизительно равен T1/2
из плазмы крови — 30 ч. Предполагаемая доза флуконазола, поглощаемая
младенцем (с учетом того, что среднее количество потребляемого молока
составляет 150 мл/кг ежедневно) и рассчитанная в соответствии со средней
пиковой концентрацией препарата в грудном молоке, составляет 0,39 мг/кг в
день, что приблизительно равно 40% рекомендованной неонатальной дозы (для детей
младше 2 недель) или 13% рекомендованной младенческой дозы при лечении
кандидоза слизистых. Кормление грудью можно продолжить после приема однократной
дозы флуконазола в 150 мг. Не рекомендуется кормить грудью после
многократного приема или приема высокой дозы флуконазола. При принятии решения
о назначении флуконазола на фоне грудного вскармливания следует принимать во
внимание следующие факторы: пользу грудного вскармливания для здоровья и
развития младенца совместно с клиническими показаниями для назначения
флуконазола и возможность развития любых потенциальных побочных эффектов у
младенца или влияние сопутствующей патологии матери на здоровье младенца.
Способ применения и дозы
Внутрь.
Капсулы проглатывают целиком.
Для капсул 150 мг:
перед первым применением пациенты должны проконсультироваться со своим врачом.
Терапию
можно начинать до получения результатов посева и других лабораторных
исследований. Однако противогрибковую терапию необходимо изменить
соответствующим образом, когда результаты этих исследований станут известными.
При
переводе пациента с внутривенного на пероральный прием препарата или наоборот
изменения суточной дозы не требуется.
Суточная
доза флуконазола зависит от характера и тяжести грибковой инфекции. При инфекциях,
требующих повторного приема препарата, лечение следует продолжать до
исчезновения клинических или лабораторных признаков активной грибковой
инфекции. Пациентам, больным СПИДом и криптококковым менингитом или
рецидивирующим орофарингеальным кандидозом, обычно необходима поддерживающая
терапия для профилактики рецидивов инфекции.
Применение
у взрослых
1.
При
криптококковом менингите и криптококковых инфекциях другой локализации в
первый день обычно применяют препарат в дозе 400 мг, а затем продолжают
лечение в дозе 200–400 мг 1 раз в сутки. Длительность лечения
криптококковых инфекций зависит от наличия клинического и микологического
эффекта; при криптококковом менингите лечение обычно продолжают, по крайней
мере 6–8 недель. В случаях лечения угрожающих жизни инфекций суточную дозу
можно увеличить до 800 мг.
Для профилактики рецидива криптококкового менингита
у пациентов с высоким риском рецидива, после завершения полного курса первичного
лечения, терапию флуконазолом в дозе 200 мг в сутки можно продолжать в
течение неопределенного периода времени.
2.
При
кокцидиоидомикозе может
потребоваться применение препарата в дозе 200–400 мг в сутки. Для
некоторых инфекций, в особенности с поражением мозговых оболочек, может
рассматриваться доза 800 мг в сутки. Длительность терапии определяют
индивидуально, может длиться до 2 лет; она составляет 11–24 мес при
кокцидиоидомикозе, 2–17 мес — при паракокцидиоидомикозе, 1–16 мес —
при споротрихозе и 3–17 мес — при гистоплазмозе.
3.
При
кандидемии, диссеминированном кандидозе и других инвазивных кандидозных
инфекциях насыщающая доза
составляет 800 мг в первый день, последующая доза 400 мг в сутки.
Длительность терапии зависит от клинической эффективности. Общая рекомендация
по длительности лечения кандидемии — 2 недели после первого отрицательного
результата посева крови и исчезновения признаков и симптомов кандидемии.
Лечение слизистого кандидоза:
—
При
орофарингеальном кандидозе насыщающая доза
составляет 200–400 мг в первый день, последующая доза 100–200 мг
1 раз в сутки в течение 7–21 дня. При необходимости, пациентам с
выраженным подавлением иммунной функции лечение можно продолжать в течение
более длительного времени.
При атрофическом кандидозе
полости рта, связанном с ношением зубных протезов, препарат обычно применяют в
дозе 50 мг 1 раз в сутки в течение 14 дней в сочетании с
местными антисептическими средствами для обработки протеза.
—
При
кандидурии эффективная
доза обычно составляет 200–400 мг в сутки при длительности лечения 7–21
день. У пациентов с тяжелым нарушением функции иммунной системы можно
использовать более длительные периоды терапии.
—
При
хроническом кожно-слизистом кандидозе
применяют 50–100 мг в сутки до 28 дней лечения. В зависимости от тяжести
лечения инфекции или сопутствующего нарушения иммунной системы и инфекции можно
использовать более длительные периоды терапии.
—
При
кандидозе пищевода насыщающая доза
200–400 мг в первый день, последующая доза 100–200 мг в сутки. Курс
лечения составляет 14–30 дней (до достижения ремиссии кандидоза пищевода). При
необходимости, пациентам с выраженным подавлением иммунной функции лечение
можно продолжать в течение более длительного времени.
—
Для
профилактики рецидивов орофарингеального кандидоза у ВИЧ-инфицированных
пациентов с высоким риском рецидивов
препарат применяют по 100–200 мг в сутки или 200 мг 3 раза в
неделю в течение неопределенного периода времени у пациентов с хронически
пониженным иммунитетом.
—
Для
предотвращения рецидивов кандидоза пищевода у ВИЧ-инфицированных пациентов с
высоким риском рецидивов препарат
применяют по 100–200 мг в сутки или 200 мг 3 раза в неделю в
течение неопределенного периода времени у пациентов с хронически пониженным
иммунитетом.
—
При
хроническом атрофическом кандидозе
полости рта, связанном с ношением зубных протезов, препарат обычно применяют в
дозе 50 мг 1 раз в сутки в течение 14 дней в сочетании с
местными антисептическими средствами для обработки протеза.
—
При
остром вагинальном кандидозе, кандидозном баланите
препарат применяют однократно внутрь в дозе 150 мг. Для снижения частоты
рецидивов вагинального кандидоза препарат можно применять в дозе 150 мг
через каждые три дня — всего 3 дозы (в 1‑й, 4‑й и 7‑й
день), затем поддерживающая доза 150 мг 1 раз в неделю. Поддерживающую
дозу можно применять вплоть до 6 мес.
Лечение дерматомикозов
—
При
инфекциях кожи, включая дерматофитию стоп, дерматофитию туловища, паховую
дерматофитию и при кандидозных инфекциях,
рекомендуемая доза составляет 150 мг 1 раз в неделю или 50 мг
один раз в день. Длительность терапии составляют 2–4 недели, при микозах стоп
может потребоваться более длительная терапия до 6 недель.
—
При
разноцветном лишае рекомендуемая
доза составляет 300–400 мг 1 раз в неделю в течение 1–3 недель.
Альтернативной схемой лечения является применение препарата по 50 мг
1 раз в день в течение 2–4 недель.
4. При онихомикозе рекомендуемая
доза составляет 150 мг 1 раз в неделю. Лечение следует продолжать до
замещения инфицированного ногтя (вырастания неинфицированного ногтя). Для
повторного роста ногтей на пальцах рук и стоп обычно требуется 3–6 мес и 6–12 мес соответственно. Однако скорость роста
может варьировать в широких пределах у разных людей, а также в зависимости от
возраста. После успешного лечения длительно сохранявшихся хронических инфекций
иногда наблюдается изменение формы ногтей.
5.
Для
профилактики кандидоза у пациентов со злокачественными опухолями
рекомендуемая доза флуконазола составляет 200–400 мг 1 раз в сутки в
зависимости от степени риска развития грибковой инфекции. Для пациентов с
высоким риском генерализованной инфекции, например, с выраженной или длительно
сохраняющейся нейтропенией, рекомендуемая доза составляет 400 мг
1 раз в сутки. Флуконазол применяют за несколько дней до ожидаемого
развития нейтропении и после увеличения числа нейтрофилов более
1000 в мм3 лечение продолжают еще 7 дней.
Особые группы пациентов
Пациенты с почечной недостаточностью
При
однократном приеме изменения дозы не требуется. У пациентов (включая детей) с нарушением
функции почек при многократном применении препарата следует первоначально
ввести ударную дозу от 50 до 400 мг, после чего суточную дозу (в зависимости
от показания) устанавливают согласно следующей таблице:
|
КК (мл/мин) |
Процент |
|
>50 |
100% |
|
≤50 |
50% |
|
Гемодиализ |
100% |
Пациенты,
находящиеся на гемодиализе должны получать 100% рекомендуемой дозы после
каждого сеанса диализа. В день, когда диализ не проводится, пациенты должны
получать уменьшенную (в зависимости от КК) дозу препарата.
Пациенты пожилого возраста
При
отсутствии признаков почечной недостаточности флуконазол применяют в обычной дозе.
Пациентам с почечной недостаточностью (КК <50 мл/мин)
дозу препарата корректируют, как описано ниже.
Дети
с 3 лет
Как
и при сходных инфекциях у взрослых, длительность лечения зависит от
клинического и микологического эффекта. Для детей суточная доза препарата не
должна превышать таковую для взрослых. Флуконазол применяют ежедневно 1 раз
в сутки.
При кандидозе слизистых оболочек
рекомендуемая доза флуконазола составляет 3 мг/кг 1 раз
в сутки. В первый день с целью более быстрого достижения равновесной
концентрации можно применять ударную дозу 6 мг/кг в сутки.
Для лечения инвазивного кандидоза и криптококкового
менингита рекомендуемая
доза составляет 6–12 мг/кг 1 раз в сутки в зависимости от тяжести
заболевания.
Для подавления рецидива криптококкового менингита у
детей больных СПИДом рекомендованная доза флуконазола составляет 6 мг/кг в
сутки.
Для профилактики грибковых инфекций у детей с подавленным
иммунитетом, у которых риск
развития инфекции связан с нейтропенией, развивающейся в результате
цитотоксической химиотерапии или лучевой терапии, препарат применяют по
3–12 мг/кг 1 раз
в сутки в зависимости от выраженности и длительности сохранения индуцированной
нейтропении (см. дозу для взрослых; для детей с почечной недостаточностью — см.
дозу для пациентов с почечной недостаточностью).
При
невозможности правильного использования у детей лекарственной формы препарата
флуконазол в виде капсул следует рассмотреть возможность замены на другие
лекарственные формы препарата (порошок для приготовления суспензии для приема
внутрь или раствор для внутривенного введения) в эквивалентных дозах.
У
детей с нарушением функции почек суточную дозу препарата следует уменьшить в
той же пропорциональной зависимости, что и у взрослых, в соответствии со
степенью выраженности почечной недостаточности.
Побочные действия
Реклама: ООО «РЛС-Патент», ИНН 5044031277
Резюме профиля безопасности
Сообщалось
о случаях лекарственной реакции с эозинофилией и системными симптомами
(DRESS-синдром) в связи с лечением флуконазолом (см. раздел «Особые указания»).
Переносимость
препарата обычно очень хорошая.
Классификация
побочных реакций по органам и системам с указанием частоты их возникновения:
очень часто (≥1/10), часто (≥1/100, <1/10), нечасто
(≥1/1000, <1/100), редко (≥1/10000, <1/1000), очень редко
(<1/10000), в т.ч. отдельные сообщения, частота неизвестно (частота не может
быть оценена на основе имеющихся данных).
В
клинических и постмаркетинговых (*) исследованиях флуконазола отмечали
следующие побочные реакции:
Нарушения со стороны нервной системы
Часто — головная
боль; нечасто — головокружение*,
судороги*, изменение вкуса*, парестезия, бессонница, сонливость; редко — тремор.
Нарушения со стороны желудочно-кишечного тракта
Часто — боль в
животе, диарея, тошнота, рвота*; нечасто
— метеоризм, диспепсия*, сухость слизистой оболочки полости рта, запор.
Нарушения со стороны печени и желчевыводящих путей
Часто — повышение
сывороточной активности аминотрансфераз (аланинаминотрансферазы (АЛТ) и
аспартатаминотрансферазы (АСТ)), щелочной фосфатазы; нечасто — холестаз, желтуха*, повышение концентрации
билирубина; редко — гепатотоксичность,
в некоторых случаях с летальным исходом, нарушение функции печени*, гепатит*,
гепатоцеллюлярный некроз*, гепатоцеллюлярное повреждение.
Нарушения со стороны кожи и подкожных тканей
Часто — сыпь; нечасто — кожный зуд, крапивница,
повышенное потоотделение, лекарственная сыпь (включая стойкую лекарственную
сыпь); редко — эксфолиативные
поражения кожи*, включая синдром Стивенса-Джонсона и токсический эпидермальный
некролиз, острый генерализованный экзантематозный пустулез, отек лица,
алопеция*; частота неизвестна —
лекарственная сыпь с эозинофилией и системной симптоматикой (DRESS‑синдром).
Нарушения со стороны крови и лимфатической системы*
Редко — лейкопения,
включая нейтропению и агранулоцитоз, тромбоцитопения, анемия.
Нарушения со стороны иммунной системы*
Анафилаксия
(включая ангионевротический отек).
Нарушения со стороны сердечно-сосудистой системы*
Редко — увеличение
интервала QT на ЭКГ, аритмия желудочковая тахисистолическая типа «пируэт»
(torsade de pointes)
см. раздел «Особые указания»).
Нарушения со стороны обмена веществ*
Редко — повышение
концентрации холестерина и триглицеридов в плазме крови, гипокалиемия.
Нарушения со стороны опорно-двигательного аппарата
Нечасто — миалгия.
Прочие
Нечасто — слабость,
астения, повышенная утомляемость, лихорадка, вертиго.
У
некоторых пациентов, особенно с серьезными заболеваниями, такими как СПИД или
рак, при лечении флуконазолом и сходными препаратами наблюдались изменения
показателей крови, функции почек и печени (см. раздел «Особые указания»),
однако клиническое значение этих изменений и их связь с лечением не
установлены.
Взаимодействие
Однократное
или многократное применение флуконазола в дозе 50 мг не влияет на
метаболизм феназона (Антипирина) при одновременном применении.
Одновременное применение флуконазола со следующими
препаратами противопоказано:
Цизаприд:
при одновременном применении флуконазола и цизаприда возможны нежелательные
реакции со стороны сердца, в т.ч. аритмия желудочковая тахисистолическая
типа «пируэт» (torsade de pointes). Применение флуконазола в дозе 200 мг
1 раз в сутки и цизаприда в дозе 20 мг 4 раза в сутки приводит к
выраженному увеличению плазменных концентраций цизаприда и увеличению интервала
QT на ЭКГ. Одновременное применение цизаприда и флуконазола противопоказано.
Терфенадин:
при одновременном применении азольных противогрибковых средств и терфенадина
возможно возникновение серьезных аритмий в результате увеличения интервала QT.
При применении флуконазола в дозе 200 мг в сутки увеличение интервала QT
не установлено, однако, применение флуконазола в дозах 400 мг в сутки и
выше вызывает значительное увеличение концентрации терфенадина в плазме крови.
Одновременное применение флуконазола в дозах 400 мг в сутки и более с
терфенадином противопоказано (см. раздел «Противопоказания»). Лечение
флуконазолом в дозах менее 400 мг в сутки в сочетании с терфенадином
следует проводить под тщательным контролем.
Астемизол:
одновременное применение флуконазола с астемизолом или другими препаратами,
метаболизм которых осуществляется системой цитохрома P450, может
сопровождаться повышением сывороточных концентраций этих средств. Повышенные
концентрации астемизола в плазме крови могут приводить к удлинению
интервала QT и в некоторых случаях к развитию аритмии желудочковой
тахисистолической типа «пируэт» (torsade de pointes). Одновременное применение
астемизола и флуконазола противопоказано.
Пимозид: несмотря на то,
что не проводилось соответствующих исследований in vitro или in vivo,
одновременное применение флуконазола и пимозида может приводить к угнетению
метаболизма пимозида. В свою очередь повышение плазменных концентраций пимозида
может приводить к удлинению интервала QT и в некоторых случаях развитию
аритмии желудочковой тахисистолической типа «пируэт» (torsade de pointes).
Одновременное применение пимозида и флуконазола противопоказано.
Хинидин: несмотря на то,
что не проводилось соответствующих исследований in vitro или in vivo,
одновременное применение флуконазола и хинидина может также проводить к угнетению
метаболизма хинидина. Применение хинидина связано с удлинением
интервала QT и в некоторых случаях с развитием аритмии желудочковой
тахисистолической типа «пируэт» (torsade de pointes). Одновременное применение
хинидина и флуконазола противопоказано.
Эритромицин:
одновременное применение флуконазола и эритромицина потенциально приводит к
повышенному риску развития кардиотоксичности (удлинение интервала QT,
torsade de pointes) и, вследствие этого, внезапной сердечной смерти.
Одновременное применение флуконазола и эритромицина противопоказано.
Следует соблюдать осторожность или избегать одновременного
применения с флуконазолом:
Амиодарон:
применение амиодарона ассоциировалось с удлинением интервала QT. Следует
соблюдать осторожность при одновременном применении флуконазола и амиодарона, в
особенности при приеме высокой дозы флуконазола (800 мг).
Лемборексант:
одновременное применение с флуконазолом приводит к увеличению Cmax
и AUC лемборексанта примерно в 1,6 и 4,2 раза соответственно, что как
ожидается, приведет к увеличению риска побочных реакций, таких как сонливость.
Следует избегать одновременного применения флуконазола и лемборексанта.
Следует соблюдать осторожность и, возможно, корректировать
дозы при одновременном применении следующих препаратов и флуконазола:
Препараты, влияющие на флуконазол
Гидрохлоротиазид:
многократное применение гидрохлоротиазида одновременно с флуконазолом приводит
к увеличению концентрации флуконазола в плазме крови на 40%. Эффект такой
степени выраженности не требует изменения режима дозирования флуконазола у
пациентов, получающих одновременно диуретики, однако врачу следует это
учитывать.
Рифампицин:
одновременное применение флуконазола и рифампицина приводит, к снижению AUC на 25%
и длительности T1/2
флуконазола на 20%.
У пациентов, одновременно принимающих рифампицин, необходимо учитывать
целесообразность увеличения дозы флуконазола.
Препараты, на которые влияет флуконазол:
Флуконазол
является умеренным ингибитором изофермента 2C9 и 3A4 цитохрома P450
(CYP). Флуконазол также является ингибитором изофермента CYP2C19. Кроме того,
помимо перечисленных далее эффектов, существует риск повышения в плазме крови
концентрации и других лекарственных средств, метаболизируемых изоферментами
CYP2C9, CYP2C19 и CYP3A4 при одновременном применении с флуконазолом. В связи с
этим, следует соблюдать осторожность при одновременном применении перечисленных
препаратов, а при необходимости подобных комбинаций пациенты должны находиться
под тщательным медицинским наблюдением. Следует учитывать, что ингибирующий
эффект флуконазола сохраняется в течение 4–5 дней после отмены препарата в
связи с длительным T1/2.
Аброцитиниб:
флуконазол (ингибитор CYP2C19, 2C9, 3A4) увеличивал экспозицию активного
вещества аброцитиниба на 155%.
При одновременном применении с флуконазолом скорректируйте дозу аброцитиниба в
соответствии с инструкцией при применению аброцитиниба.
Алфентанил:
отмечается уменьшение клиренса и объема распределения, увеличение T1/2
алфентанила. Возможно, это связано с ингибированием изофермента CYP3A4
флуконазолом. Может потребоваться коррекция дозы алфентанила.
Амитриптилин, нортриптилин:
увеличение эффекта. Концентрацию 5‑нортриптилина и/или S‑амитриптилина
можно измерить в начале комбинированной терапии с флуконазолом и через неделю
после начала. При необходимости следует скорректировать дозу амитриптилина/нортриптилина.
Амфотерицин B: в исследованиях
на мышах (в т.ч.
с иммуносупрессией) были отмечены следующие результаты: небольшой аддитивный
противогрибковый эффект при системной инфекции, вызванной C. albicans, отсутствие
взаимодействия при внутричерепной инфекции, вызванной Cryptococcus neoformans и антагонизм при
системной инфекции, вызванной A. fumigatus.
Клиническое значение данных результатов не ясно.
Антикоагулянты:
как и другие противогрибковые средства (производные азола), флуконазол, при
одновременном применении с варфарином, повышает протромбиновое время (на 12%),
в связи с чем, возможно развитие кровотечений (гематомы, кровотечения из носа и
желудочно-кишечного тракта, гематурия, мелена). У пациентов, получающих
антикоагулянты кумаринового и индандионового ряда и флуконазол, необходимо
постоянно контролировать протромбиновое время в период терапии и в течение 8 дней
после одновременного применения. Также следует оценить целесообразность
коррекции дозы данных антикоагулянтов.
Азитромицин:
при одновременном применении внутрь флуконазола в однократной дозе 800 мг
с азитромицином в однократной дозе 1200 мг выраженного
фармакокинетического взаимодействия между обоими препаратами не установлено.
Бензодиазепины (короткого действия): после
приема внутрь мидазолама, флуконазол существенно увеличивает концентрацию
мидазолама и психомоторные эффекты, причем это влияние более выражено после
приема флуконазола внутрь, чем при его применении внутривенно. При необходимости
сопутствующей терапии бензодиазепинами пациентов, принимающих флуконазол,
следует наблюдать с целью оценки целесообразности соответствующего снижения
дозы бензодиазепина.
При
одновременном применении однократной дозы триазолама, флуконазол увеличивает
AUC триазолама приблизительно на 50%, Cmax
— на 20–32% и T1/2
— на 25–50% благодаря угнетению метаболизма триазолама. Может понадобиться
коррекция дозы триазолама.
Карбамазепин:
флуконазол угнетает метаболизм карбамазепина и повышает сывороточную
концентрацию карбамазепина на 30%.
Необходимо учитывать риск развития токсичности карбамазепина. Следует оценить
необходимость коррекции дозы карбамазепина в зависимости от концентрации/эффекта.
Блокаторы «медленных» кальциевых каналов:
некоторые антагонисты кальциевых каналов (нифедипин, исрадипин, амлодипин,
верапамил и фелодипин) метаболизируются изоферментом CYP3A4. Флуконазол
увеличивает системную экспозицию антагонистов кальциевых каналов. Рекомендован
контроль развития побочных эффектов.
Невирапин:
совместный прием флуконазола и невирапина увеличивает приблизительно
на 100% экспозицию невирапина по сравнению с контрольными данными по
отдельному применению невирапина. Из-за риска повышенного выделения невирапина
при сопутствующем применении лекарственных препаратов необходимы некоторые
предосторожности и тщательное наблюдение за пациентами.
Циклоспорин:
у пациентов с трансплантированной почкой, применение флуконазола в дозе
200 мг в сутки приводит к медленному повышению концентрации циклоспорина.
Однако при многократном применении флуконазола в дозе 100 мг в сутки
изменения концентрации циклоспорина у реципиентов костного мозга не
наблюдалось. При одновременном применении флуконазола и циклоспорина
рекомендуется контролировать концентрацию циклоспорина в крови.
Циклофосфамид:
при одновременном применении циклофосфамида и флуконазола отмечается увеличение
сывороточных концентраций билирубина и креатинина. Данная комбинация допустима
с учетом риска увеличения концентраций билирубина и креатинина.
Фентанил:
имеется сообщение об одном летальном исходе, возможно, связанном с
одновременным приемом фентанила и флуконазола. Предполагается, что нарушения
связаны с интоксикацией фентанилом. Было показано, что флуконазол значительно
удлиняет время выведения фентанила. Следует учитывать, что повышение
концентрации фентанила может привести к угнетению дыхательной функции.
Галофантрин:
флуконазол может увеличивать концентрацию галофантрина в плазме крови в связи с
ингибированием изофермента CYP3A4. Возможно развитие аритмии желудочковой
тахисистолической типа «пируэт» (torsade de pointes) при одновременном
применении с флуконазолом, как и с другими противогрибковыми препаратами
азолового ряда, поэтому совместное применение их не рекомендуется.
Ингибиторы ГМГ-КоА-редуктазы : при
одновременном применении флуконазола с ингибиторами ГМГ-КоА-редуктазы ,
метаболизируемыми изоферментом CYP3A4 (такими как аторвастатин и симвастатин),
или изоферментом CYP2D6 (такими как флувастатин), риск развития миопатии и
рабдомиолиза увеличивается. В случае необходимости одновременной терапии
указанными препаратами, следует наблюдать пациентов с целью выявления симптомов
миопатии и рабдомиолиза. Необходимо контролировать концентрацию
креатининкиназы. В случае значительного увеличения концентрации креатининкиназы
или если диагностируется или имеется подозрение на развитие миопатии и
рабдомиолиза, терапию ингибиторами ГМГ-КоА-редуктазы следует прекратить. Могут
потребоваться более низкие дозы ингибиторов ГМГ-КоА-редуктазы , как указано в
инструкции по медицинскому применению статинов.
Ибрутиниб:
умеренные ингибиторы изофермента CYP3A4, такие как флуконазол, увеличивают
концентрацию ибрутиниба в плазме крови и могут повышать риск токсичности. Если
применения препаратов в комбинации не удается избежать, необходимо уменьшить
дозу ибрутиниба, как указано в инструкции по медицинскому применению
ибрутиниба, и обеспечить тщательное клиническое наблюдение.
Ивакафтор (отдельно или в сочетании с препаратом того же
терапевтического класса): одновременное
применение с ивакафтором, потенциатором регулятора трансмембранной проводимости
при муковисцидозе (CFTR), повышало уровень воздействия ивакафтора в
3 раза, а уровень воздействия гидроксиметил-ивакафтора (M1) — в
1,9 раза. Необходимо снизить дозу ивакафтора (отдельно или в комбинации),
как указано в инструкции по медицинскому применению ивакафтора.
Лозартан:
флуконазол угнетает метаболизм лозартана до его активного метаболита (E‑3174),
который отвечает за большую часть эффектов, связанных с антагонизмом
ангиотензин‑II
рецепторов. Необходим регулярный контроль артериального давления.
Метадон: флуконазол
может увеличивать плазменную концентрацию метадона. Может понадобиться
коррекция дозы метадона.
Нестероидные противовоспалительные препараты (НПВП):
Cmax
и AUC флурбипрофена увеличиваются на 23 и 81%, соответственно. Аналогично Cmax
и AUC фармакологически активного изомера [S‑(+)‑ибупрофен]
повышались на 15 и 82%, соответственно при одновременном применении флуконазола
с рацемическим ибупрофеном (400 мг).
Целекоксиб:
при одновременном применении флуконазола в дозе 200 мг в сутки и
целекоксиба в дозе 200 мг Cmax
и AUC целекоксиба увеличиваются на 68 и 134%, соответственно. В данной
комбинации возможно снижение дозы целекоксиба вдвое.
Несмотря
на отсутствие целенаправленных исследований флуконазол может увеличивать
системную экспозицию других НПВП, метаболизируемых изоферментом CYP2C9
(например, напроксен, лорноксикам, мелоксикам, диклофенак). Может понадобиться
коррекция дозы НПВП.
При
одновременном применении НПВП и флуконазола пациенты должны находиться под
тщательным медицинским наблюдением с целью выявления и контроля нежелательных
явлений и проявления токсичности, связанных с НПВП.
Олапариб:
умеренные ингибиторы изофермента CYP3A4, такие как флуконазол, повышают
концентрацию олапариба в плазме крови. Их одновременное применение не рекомендовано.
Если возможно избежать одновременного применения, необходимо сократить дозу
олапариба до 200 мг 2 раза в сутки.
Пероральные контрацептивы:
при одновременном применении комбинированного перорального контрацептива с
флуконазолом в дозе 50 мг существенного влияния на уровень гормонов
не установлено, тогда как при ежедневном применении 200 мг
флуконазола AUC этинилэстрадиола и левоноргестрела увеличиваются на 40 и 24%,
соответственно, а при применении 300 мг флуконазола 1 раз в неделю
AUC этинилэстрадиола и норэтиндрона возрастают на 24 и 13%, соответственно.
Таким образом, многократное применение флуконазола в указанных дозах вряд ли
может оказать влияние на эффективность комбинированного перорального
противозачаточного средства.
Фенитоин:
одновременное применение флуконазола и фенитоина может сопровождаться
клинически значимым повышением концентрации фенитоина. В случае необходимости
одновременного применения обоих препаратов следует контролировать концентрацию
фенитоина и соответствующим образом скорректировать его дозу с целью
обеспечения терапевтической концентрации в сыворотке крови.
Преднизон:
имеется сообщение о развитии острой недостаточности коры надпочечников у
пациента после трансплантации печени на фоне отмены флуконазола после
трехмесячного курса терапии. Предположительно, прекращение терапии флуконазолом
вызвало повышение активности изофермента CYP3A4, что привело к увеличенному метаболизму
преднизона.
Пациенты,
получающие комбинированную терапию преднизоном и флуконазолом, должны
находиться под тщательным медицинским наблюдением при отмене приема флуконазола
с целью оценки состояния коры надпочечников.
Рифабутин:
одновременное применение флуконазола и рифабутина может привести к повышению
сывороточных концентраций последнего до 80%. При одновременном применении
флуконазола и рифабутина описаны случаи увеита. Пациентов, одновременно
принимающих рифабутин и флуконазол, необходимо тщательно наблюдать.
Саквинавир:
AUC повышается приблизительно на 50%, Cmax
— на 55%, клиренс саквинавира уменьшается приблизительно на 50% в связи с
ингибированием печеночного метаболизма изофермента CYP3A4 и ингибированием P‑гликопротеина.
Может понадобиться коррекция дозы саквинавира.
Сиролимус:
повышение концентрации сиролимуса в плазме крови, предположительно в связи с
ингибированием метаболизма сиролимуса через угнетение изофермента CYP3A4 и P‑гликопротеина.
Данная комбинация может применяться с соответствующей коррекцией дозы
сиролимуса в зависимости от эффекта/концентрации.
Препараты сульфонилмочевины:
флуконазол, при одновременном применении приводит к увеличению T1/2
пероральных препаратов сульфонилмочевины (хлорпропамида, глибенкламида,
глипизида и толбутамида). Пациентам с сахарным диабетом можно назначать
совместное применение флуконазола и пероральных препаратов сульфонилмочевины,
но при этом следует учитывать возможность развития гипогликемии, кроме того,
необходим регулярный контроль глюкозы крови и, при необходимости, коррекция
дозы препаратов сульфонилмочевины.
Такролимус:
одновременное применение флуконазола и такролимуса (внутрь) приводит к
повышению сывороточных концентраций последнего в 5 раз
за счет ингибирования метаболизма такролимуса, происходящего в кишечнике
посредством изофермента CYP3A4. Значительных изменений фармакокинетики
препаратов не отмечено
при применении такролимуса внутривенно. Описаны случаи нефротоксичности.
Пациентов, одновременно принимающих такролимус внутрь и флуконазол, следует
тщательно наблюдать. Дозу такролимуса следует корректировать в зависимости от
степени повышения его концентрации в крови.
Теофиллин: при
одновременном применении с флуконазолом в дозе 200 мг в течение 14 дней
средняя скорость плазменного клиренса теофиллина снижается на 18%.
При назначении флуконазола пациентам, принимающим теофиллин в высоких дозах,
или пациентам с повышенным риском развития токсического действия теофиллина,
следует наблюдать за появлением симптомов передозировки теофиллина и, при
необходимости, скорректировать терапию соответствующим образом.
Тофацитиниб:
экспозиция тофацитиниба увеличивается при его совместном применении с
препаратами, которые являются одновременно умеренными ингибиторами изоферментов
CYP3A4 и CYP2C19 (например, флуконазол). Возможно, может понадобиться коррекция
дозы тофацитиниба.
Толваптан:
экспозиция толваптана значительно увеличивается (AUC на 200%, Cmax на 80%)
при совместном применении толваптана, субстрата CYP3A4, и флуконазола,
умеренного ингибитора CYP3A4. При этом существует риск значительного увеличения
частоты развития нежелательных реакций, в частности, таких как повышенный
диурез, дегидратация и острая почечная недостаточность. При одновременном
применении данных препаратов следует уменьшить дозу толваптана и внимательно
наблюдать за состоянием пациента.
Алкалоид барвинка:
несмотря на отсутствие целенаправленных исследований, предполагается, что
флуконазол может увеличивать концентрацию алкалоидов барвинка (например,
винкристина и винбластина) в плазме крови и, таким образом, приводить к
нейротоксичности, что, возможно, может быть связано с угнетением изофермента
CYP3A4.
Витамин A: имеется
сообщение об одном случае развития нежелательных реакций со стороны центральной
нервной системы (ЦНС) в виде псевдоопухоли мозга при одновременном применении
полностью трансретиноевой кислоты и флуконазола, которые исчезли после отмены
флуконазола. Применение данной комбинации возможно, но следует помнить о
возможности возникновения нежелательных реакций со стороны ЦНС.
Вориконазол (ингибитор изоферментов CYP2C9, CYP2C19 и
CYP3A4): одновременное
применение вориконазола (по 400 мг
2 раза
в сутки в первый день, затем 200 мг 2 раза
в сутки в течение 2,5 дней)
и флуконазола (400 мг в первый день, затем по 200 мг в сутки в
течение 4 дней)
у 8 здоровых
испытуемых мужского пола привело к увеличению Cmax
и AUC вориконазола на 57 и 79%, соответственно. Было показано, что данный
эффект сохраняется при уменьшении дозы и/или уменьшении кратности приема любого
из препаратов. Одновременное применение вориконазола и флуконазола не
рекомендуется.
Зидовудин:
при одновременном применении с флуконазолом отмечается повышение Cmax
и AUC зидовудина на 84 и 74%, соответственно. Данный эффект, вероятно,
обусловлен снижением метаболизма последнего до его главного метаболита. До и
после терапии с применением флуконазола в дозе 200 мг в сутки в течение 15 дней
пациентам больным СПИДом и AUC
(комплекс, связанный со СПИДом) установлено значительное увеличение AUC
зидовудина (20%).
За
пациентами, получающими такую комбинацию, следует наблюдать с целью выявления
побочных эффектов зидовудина.
Исследования
взаимодействия пероральных форм флуконазола при его одновременном приеме с
пищей, циметидином, антацидами, а также после тотального облучения тела для
подготовки к пересадке костного мозга показали, что эти факторы не оказывают
клинически значимого влияния на всасывание флуконазола.
Перечисленные
взаимодействия установлены при многократном применении флуконазола;
взаимодействия с лекарственными средствами в результате однократного приема
флуконазола не известны.
Врачам
следует учитывать, что взаимодействие с другими лекарственными средствами
специально не изучалось,
но оно возможно.
Передозировка
Симптомы
Имеются
сообщения о передозировке флуконазола, и в одном случае у 42-летнего пациента,
инфицированного вирусом иммунодефицита человека, после приема 8200 мг
препарата появились галлюцинации и параноидальное поведение. Пациент был
госпитализирован; его состояние нормализовалось в течение 48 ч.
Лечение
В
случае передозировки адекватный эффект может дать симптоматическое лечение
(в т.ч. поддерживающие меры и промывание желудка).
Флуконазол
выводится в основном через почки, поэтому форсированный диурез, вероятно, может
ускорить выведение препарата. Сеанс гемодиализа длительность 3 ч снижает
концентрацию флуконазола в плазме крови примерно на 50%.
Особые указания
Сообщалось
о случаях суперинфекции, вызванной отличными от Candida albicans штаммами Candida,
которые часто обладают природной резистентностью к флуконазолу (например, Candida krusei). В подобных случаях может
потребоваться альтернативная противогрибковая терапия.
Во
время беременности применение флуконазола следует избегать, за исключением
случаев тяжелых и потенциально угрожающих жизни грибковых инфекций, когда
ожидаемая польза для матери превышает возможный риск для плода.
Необходимо
рассмотреть эффективные методы контрацепции у женщин детородного возраста в
течение всего периода лечения и приблизительно в течение недели (5–6 T1/2)
после принятия последней дозы препарата (см. раздел «Применение при
беременности и в период грудного вскармливания»). В редких случаях применение
флуконазола сопровождалось токсическими изменениями в печени, в т.ч. с
летальным исходом, главным образом, у пациентов с серьезными сопутствующими
заболеваниями. В случае гепатотоксических эффектов, связанных с применением
флуконазола, не отмечено их явной зависимости от общей суточной дозы препарата,
длительности терапии, пола и возраста пациента. Гепатотоксическое действие
флуконазола обычно было обратимым; признаки его исчезали после прекращения
терапии. Пациентов, у которых во время лечения препаратом нарушаются показатели
печени, необходимо наблюдать с целью выявления признаков более серьезного
поражения печени. При появлении клинических признаков или симптомов поражения
печени, которые могут быть связаны с применением флуконазола, препарат следует
отменить.
Как
и при применении других азолов, флуконазол в редких случаях может вызвать
анафилактические реакции.
Во
время лечения флуконазолом у пациентов в редких случаях развивались
эксфолиативные поражения кожи, такие как синдром Стивенса-Джонсона и
токсический эпидермальный некролиз. Сообщалось о случаях лекарственной реакции
с эозинофилией и системными симптомами (DRESS-синдром). Пациенты с
ВИЧ-инфекцией более склонны к развитию тяжелых кожных реакций при применении
многих препаратов. При появлении у пациента во время лечения поверхностной
грибковой инфекции сыпи, которую можно связать с применением флуконазола,
препарат следует отменить. При появлении сыпи у пациентов с инвазивными или
системными грибковыми инфекциями их следует тщательно наблюдать и отменить
препарат при появлении буллезных поражений или многоформной экссудативной
эритемы.
Одновременное
применение флуконазола в дозах менее 400 мг в сутки и терфенадина следует
проводить под тщательным контролем (см. раздел «Взаимодействие с другими
лекарственными средствами»).
Как
и другие азолы, флуконазол может вызвать увеличение интервала QT на ЭКГ.
Флуконазол вызывает увеличение интервала QT посредством ингибирования тока
калиевых каналов внутреннего выпрямления. Увеличение интервала QT, вызванное
другими лекарственными средствами (такими как амиодарон), может быть усилено
ингибиторами изофермента 3A4 цитохрома P450 (CYP) (см. раздел
«Взаимодействие с другими лекарственными средствами»). При применении
флуконазола увеличение интервала QT и мерцание или трепетание желудочков
отмечали очень редко у пациентов с тяжелыми заболеваниями с множественными
факторами риска, такими как органические заболевания сердца, нарушения
электролитного баланса и способствующая развитию подобных нарушений сопутствующая
терапия. Повышенный риск развития угрожающей жизни желудочковой аритмии и
полиморфной желудочковой тахикардии может возникнуть у пациентов с
гипокалиемией и прогрессирующей сердечной недостаточностью. Поэтому таким
пациентам с потенциально проаритмическими состояниями применять флуконазол
следует с осторожностью.
Пациентам
с заболеваниями печени, сердца и почек перед применением препарата
рекомендуется проконсультироваться с врачом. При применении флуконазола
150 мг по поводу вагинального кандидоза пациенты должны быть
предупреждены, что улучшение симптомов обычно наблюдается через 24 ч, но
для их полного исчезновения иногда требуется несколько дней. При сохранении
симптомов в течение нескольких дней следует обратиться к врачу.
Доказательства
эффективности флуконазола при лечении других видов эндемичных микозов, таких
как паракокцидиоидомикоз, споротрихоз и гистоплазмоз ограничены, что не
позволяет определить конкретные рекомендации по дозированию. Флуконазол
является умеренным ингибитором изофермента CYP2C9 и умеренным ингибитором
изофермента CYP3A4. Флуконазол также является ингибитором изофермента CYP2C19.
При одновременной терапии лекарственными препаратами с узким терапевтическим
профилем, метаболизирующимися изоферментами CYP2C9, CYP2C19 и CYP3A4,
рекомендуется соблюдать осторожность (см. раздел «Взаимодействие с другими
лекарственными препаратами»).
Сообщалось
о развитии недостаточности коры надпочечников у пациентов, получающих терапию
другими азолами (например, кетоконазолом). У пациентов, получающих флуконазол,
наблюдались обратимые случаи недостаточности коры надпочечников.
Кандидоз
Исследования
показали растущую распространенность инфекций, вызванных видами Candida, отличными от C. albicans. Эти виды часто обладают
резистентностью (например, C. krusei
и C. auris) или
демонстрируют пониженную чувствительность к флуконазолу (C. glabrata).
Такие инфекции могут потребовать альтернативной противогрибковой терапии
вследствие неэффективности лечения. Поэтому специалистам, назначающим лечение,
следует учитывать распространенность резистентности разных видов Candida к флуконазолу (см. раздел
«Фармакодинамика»).
При
уничтожении неиспользованных упаковок препарата специальных мер
предосторожностей не требуется.
Влияние на способность управлять
транспортными средствами, механизмами
При
применении препарата необходимо учитывать возможность развития головокружения и
судорог.
Форма выпуска
Капсулы
50 мг, 150 мг.
По
7 капсул по 50 мг или по 1 капсуле по 150 мг в контурную ячейковую
упаковку, или в банку полимерную из ПЭНД с натяжной крышкой с уплотняющим
элементом и контролем первого вскрытия из ПЭВД.
По
1, 2 или 4 контурных ячейковых упаковки, или по 1 банке полимерной вместе с
инструкцией по применению в пачку из картона.
Условия отпуска из аптек
Условия хранения
Хранить
при температуре не выше 25 °C.
Хранить
в недоступном для детей месте.
Срок годности
2
года.
Не
применять по истечении срока годности, указанного на упаковке.
Производитель
Юридическое лицо, на имя которого выдано регистрационное
удостоверение
АО
«Фармпроект», Россия,
192236,
г. Санкт-Петербург, ул. Софийская, д. 14, лит. А.
Тел./факс:
+7 (812) 331 93 10
Производитель/организация, принимающая претензии
потребителей
АО
«Фармпроект», Россия,
192236,
г. Санкт-Петербург, ул. Софийская, д. 14, лит. А.
Тел./факс:
+7 (812) 331 93 10
Описание проверено
-
Комкова Людмила Александровна
(Провизор)
Опыт работы: более 12 лет
Представленная информация о ценах на препараты не является предложением о продаже или покупке товара.
Информация предназначена исключительно для сравнения цен в стационарных аптеках, осуществляющих деятельность в
соответствии со статьей 55 Федерального закона «Об обращении лекарственных средств» от 12.04.2010 № 61-ФЗ.
-
Условия эксплуатации
Данное руководство разработано, чтобы корректно отображаться в следующих операционных системах и браузерах.
- Windows
- Операционные системы
Windows 8.1, Windows 8, Windows 7, Windows Vista SP2 и Windows XP SP3 (только 32-разрядные версии)
- Веб-браузеры
Internet Explorer 11, Internet Explorer 10, Internet Explorer 9 и Internet Explorer 8 (*1)
Mozilla Firefox
Google Chrome
- Операционные системы
- Mac OS
- Операционные системы
OS X Yosemite v10.10, OS X Mavericks v10.9, OS X Mountain Lion v10.8 и OS X Lion v10.7.5
- Веб-браузеры
Safari 8, Safari 7, Safari 6 и Safari 5
- Операционные системы
- iOS
- Операционные системы
iOS 8.0, iOS 7.1, iOS 7.0 и iOS 6.1 (*2)
- Веб-браузеры
Safari 8, Safari 7 и Safari 6
- Операционные системы
- Android
- Операционные системы
Android 4.4, Android 4.3, Android 4.2, Android 4.1, Android 4.0 и Android 2.3
- Веб-браузеры
Браузер
- Операционные системы
- Windows RT
- Веб-браузеры
Internet Explorer 11 и Internet Explorer 10
- Веб-браузеры
- * В настройках браузера разрешите использование файлов cookie и включите JavaScript.
- *1 Если в Internet Explorer 8 используется режим совместимости, возможно некорректное отображение некоторых страниц. В этом случае следует отключить режим совместимости.
- *2 Воспроизведение видеоизображения поддерживается только в iOS версии 7.0 или более поздней версии.
- Windows
- Использование данного онлайн-руководства
- Товарные знаки и лицензии
- Снимки экранов в данном руководстве

MG3600 series
Онлайн-руководство
Прочтите это
Функции принтера
Обзор
Печать
Копирование
Сканирование
Устранение неполадок
Русский (Russian)

Содержание
Замечания по использованию сайта и файлов cookie. . . . . . . . . . . . . . . . . . 16
Использование данного онлайн-руководства. . . . . . . . . . . . . . . . . . . . . . . . . 18
Товарные знаки и лицензии. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 19
Рекомендации по поиску. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 23
Использование Устройства. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 25
Печать фотографий с компьютера. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 26
Копирование оригиналов. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 30
Функции принтера. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 33
Простая установка беспроводного подключения в «режиме точки доступа». . . . . . . 34
Простая печать фотографий с помощью My Image Garden. . . . . . . . . . . . . . . . . . . . . 35
Загрузка различного содержимого. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 37
Печать материалов с помощью Easy-PhotoPrint+ (веб-приложение). . . . . . . . . . . . . . 38
Доступные способы подключения. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 39
Прямое подключение (Windows XP). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 41
Ограничения. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 43
Удобное сканирование с использованием функции автоматического сканирования. 45
Сканирование оригиналов, превышающих по размеру рабочую поверхность. . . . . . 46
Сканирование нескольких оригиналов в один прием. . . . . . . . . . . . . . . . . . . . . . . . . . 47
Использование PIXMA/MAXIFY Cloud Link. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 48
Уведомление о печати с помощью веб-службы. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 49
Использование PIXMA/MAXIFY Cloud Link со смартфона, планшета или компьютера. . . . . . . . . . 51
Перед использованием программы Canon Inkjet Cloud Printing Center. . . . . . . . . . . . . . . . . . . 52
Требования для работы Canon Inkjet Cloud Printing Center. . . . . . . . . . . . . . . . . . . . . . . . 53
Регистрация информации о пользователе в программе Canon Inkjet Cloud Printing Center. . 54
Регистрация информации о пользователе в программе Canon Inkjet Cloud Printing Center
(модели без ЖК-монитора). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 55
Использование программы Canon Inkjet Cloud Printing Center. . . . . . . . . . . . . . . . . . . . . . . . . . 62
Окно Canon Inkjet Cloud Printing Center. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 66
Добавление Принтера. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 104
Добавление пользователя PIXMA/MAXIFY Cloud Link. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 106
Устранение неполадок программы Canon Inkjet Cloud Printing Center. . . . . . . . . . . . . . . . . . 111

Простая печать со смартфона или планшета с помощью Canon PRINT Inkjet/SELPHY.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 115
Печать с помощью Windows RT. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 116
Проверка сведений о Принтере. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 117
Обращение с бумагой, оригиналами, картриджами FINE и т. д.. . . . . . . . . 120
Загрузка бумаги. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 121
Загрузка обычной бумаги или фотобумаги. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 122
Загрузка конвертов. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 126
Загрузка оригиналов. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 130
Загрузка оригиналов на Стекло рабочей поверхности. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 131
Оригиналы, которые можно загрузить. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 133
Закрепление/отсоединение крышки сканера. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 134
Замена картриджа FINE. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 135
Замена картриджа FINE. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 136
Проверка состояния чернил. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 142
Проверка уровня чернил по индикаторам чернильницы на панели управления. . . . . . . . . . 143
Обслуживание. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 144
Если печать стала бледной или неравномерной. . . . . . . . . . . . . . . . . . . . . . . . . . . . . 145
Процедура обслуживания. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 146
Печать образца для проверки сопел. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 148
Оценка образца для проверки сопел. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 149
Очистка Печатающей головки. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 150
Глубокая очистка Печатающей головки. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 151
Выравнивание Печатающей головки. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 152
Выполнение функций обслуживания с компьютера (Windows). . . . . . . . . . . . . . . . . 155
Очистка печатающих головок. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 156
Очистка подающих роликов. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 158
Выравнивание Печатающей головки. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 159
Выравнивание положения печатающих головок. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 160
Автоматическое выравнивание положения печатающих головок. . . . . . . . . . . . . . . . . . . . . . . . . . 164
Печать образца для проверки сопел. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 165
Очистка внутренних компонентов Принтера. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 166
Очистка. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 167
Очистка наружной поверхности Устройства. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 168
Очистка Стекла рабочей поверхности и Крышки сканера. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 169

Очистка Подающего ролика. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 170
Чистка внутренних компонентов Устройства (чистка поддона). . . . . . . . . . . . . . . . . . . . . . . . . . . . 171
Обзор. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 173
Безопасность. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 175
Меры предосторожности. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 176
Нормативная информация. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 178
Основные компоненты и их использование. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 179
Основные компоненты. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 180
Вид спереди. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 181
Вид сзади. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 183
Вид внутренних частей. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 184
Панель управления. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 186
Электропитание. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 188
Проверка включения питания. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 189
Включение и выключение Устройства. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 190
Уведомление о штепселе шнура питания или шнуре питания. . . . . . . . . . . . . . . . . . . . . . . . 192
Уведомление об отсоединении кабеля питания от электросети. . . . . . . . . . . . . . . . . . . . . . . 193
Изменение параметров. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 194
Изменение параметров принтера с компьютера (Windows). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 195
Изменение параметров печати. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 196
Регистрация профиля часто используемой конфигурации печати. . . . . . . . . . . . . . . . . . . . . 197
Выбор используемого картриджа. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 199
Управление питанием Принтера. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 200
Уменьшение издаваемого Принтером шума. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 202
Изменение режима работы Принтера. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 204
Изменение параметров с помощью панели управления. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 206
Параметры бесшумного режима. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 207
Автоматическое включение и выключение устройства. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 208
Инициализация параметров устройства. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 210
Отключение функции беспроводной сети. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 211
Сетевое подключение. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 212
Рекомендации по сетевому подключению. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 213
Параметры сети по умолчанию. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 214
Обнаружен еще один принтер с таким же именем. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 215
Подключение к другому компьютеру через локальную сеть/Изменение способа подключения
с USB на локальную сеть. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 216

Печать параметров сети. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 217
Передача данных по сети (Windows). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 220
Проверка и изменение параметров сети. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 221
IJ Network Tool. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 222
Изменение параметров на вкладке «Беспроводная сеть». . . . . . . . . . . . . . . . . . . . . . . . . . . 223
Изменение расширенных параметров WEP. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 225
Изменение расширенных параметров WPA/WPA2. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 227
Изменение параметров на вкладке «Проводная сеть». . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 230
Изменение параметров на вкладке «Пароль администратора». . . . . . . . . . . . . . . . . . . . . . . 231
Мониторинг состояния беспроводной локальной сети. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 232
Изменение параметров в разделе «Прямое подключение». . . . . . . . . . . . . . . . . . . . . . . . . . 235
Инициализация параметров сети. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 237
Просмотр измененных параметров. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 239
IJ Network Tool (сетевое подключение). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 240
Экран «Canon IJ Network Tool». . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 241
Экран «Конфигурация». . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 245
Вкладка «Беспроводная сеть». . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 246
Экран «Поиск». . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 249
Экран «Сведения о WEP». . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 251
Экран «Сведения о WPA/WPA2». . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 252
Экран Подтверждение типа проверки подлинности. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 253
Экран «PSK: настройка кодовой фразы и динамического шифрования». . . . . . . . . . . . . . . . 254
Экран «Подтверждение информации настройки». . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 255
Вкладка «Проводная сеть». . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 256
Вкладка «Пароль администратора». . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 257
Экран «Сведения о сети». . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 258
Вкладка «Управление доступом». . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 259
Экран Введите доступный MAC-адрес/Добавить доступный MAC-адрес. . . . . . . . . . . . . . . . 263
Экран «Введите доступный IP-адрес»/Экран «Добавить доступный IP-адрес». . . . . . . . . . . 264
IJ Network Tool (другие экраны). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 266
Экран «Canon IJ Network Tool». . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 267
Экран «Состояние». . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 271
Экран «Измерение производительности подключения». . . . . . . . . . . . . . . . . . . . . . . . . . . . . 272
Экран «Обслуживание». . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 274
Экран «Сетевая настройка гнезда карты памяти». . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 275
Экран «Связывание с портом». . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 277
Экран «Сведения о сети». . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 278
Рекомендации по передаче данных по сети. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 279

Использование слота карты памяти в сети. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 280
Драйвер принтера не связан с портом. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 283
Технические термины. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 284
Ограничения. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 291
Брандмауэр (Firewall). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 292
Обеспечение оптимального качества печати. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 293
Советы по чернилам. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 294
Инструкции по печати. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 295
Обязательно задайте параметры бумаги после ее загрузки. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 296
Отмена задания печати. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 297
Сохранение высокого качества печати. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 298
Транспортировка принтера. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 299
Юридические ограничения на сканирование/копирование. . . . . . . . . . . . . . . . . . . . . 301
Технические характеристики. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 302
Сведения о бумаге. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 306
Подходящие типы носителей. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 307
Предел загрузки бумаги. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 309
Типы носителей, непригодные для использования. . . . . . . . . . . . . . . . . . . . . . . . . . . 311
Область печати. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 312
Область печати. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 313
Размеры бумаги, отличные от форматов Letter, Legal, Конверты. . . . . . . . . . . . . . . . . . . . . . . . . . 314
Letter, Legal. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 315
Конверты. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 316
Пароль администратора. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 317
Проверка подлинности. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 319
Местоположение серийного номера. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 320
Список функций для каждой модели. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 321
Печать. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 322
Печать с компьютера. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 323
Печать с помощью прикладной программы (драйвер принтера Windows). . . . . . . . . . . . . . . . . . . 324
Печать с применением простой настройки. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 325
Параметры бумаги в драйвере принтера. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 328
Различные способы печати. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 329
Настройка «Размер стр.» и «Ориентация». . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 330

Настройка количества копий и порядка печати страниц. . . . . . . . . . . . . . . . . . . . . . . . . 332
Настройка поля для переплета. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 334
Выполнение печати без полей. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 336
Печать по размеру бумаги. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 339
Печать с масштабированием. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 341
Печать на развороте. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 344
Печать в виде плитки/постера. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 346
Печать буклета. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 349
Двухсторонняя печать. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 351
Печать штампа и фона. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 355
Сохранение штампа. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 358
Регистрация изображения для использования в качестве фона. . . . . . . . . . . . . . . . . . 362
Настройка печати конверта. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 365
Печать на открытках. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 367
Просмотр на экране подготовленного к печати материала. . . . . . . . . . . . . . . . . . . . . . . 369
Настройка размера бумаги (специальный размер бумаги). . . . . . . . . . . . . . . . . . . . . . . 370
Редактирование документа для печати или повторная печать из журнала печати. . . 372
Изменение качества печати и коррекция графических данных. . . . . . . . . . . . . . . . . . . . . . . . 376
Установка уровня «Качество печати» (Другое). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 377
Печать цветного документа в черно-белом варианте. . . . . . . . . . . . . . . . . . . . . . . . . . . 379
Указание режима корректировки цвета. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 381
Оптимальная фотопечать графических данных. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 383
Настройка цветов с помощью драйвера принтера. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 384
Печать с использованием ICC-профилей. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 386
Настройка цветового баланса. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 389
Настройка баланса цветов с использованием примерных образцов (драйвер принтера). .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 391
Настройка яркости. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 396
Настройка интенсивности. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 398
Настройка контрастности. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 400
Настройка интенсивности/контраста с использованием примерных образцов (драйвер
принтера). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 402
Общие сведения о драйвере принтера. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 406
Драйвер принтера Canon IJ. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 407
Как открыть окно настройки драйвера принтера. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 408
Монитор состояния Canon IJ. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 410
Проверка уровня чернил с компьютера. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 411
Предварительный просмотр в Canon IJ. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 412
Удаление ненужного задания печати. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 413
Инструкции по эксплуатации (Драйвер принтера). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 414
7

Описание драйвера принтера. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 416
Описание вкладки «Быстрая установка». . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 417
Описание вкладки «Главная». . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 424
Описание вкладки «Страница». . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 430
Описание вкладки «Обслуживание». . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 443
Описание функции «Предварительный просмотр Canon IJ». . . . . . . . . . . . . . . . . . . . . . 451
Описание функции «Предварительный просмотр Canon IJ XPS». . . . . . . . . . . . . . . . . 454
Описание функции «Монитор состояния Canon IJ». . . . . . . . . . . . . . . . . . . . . . . . . . . . . 463
Обновление драйверов MP Drivers. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 466
Получение последней версии MP Drivers. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 467
Удаление ненужных драйверов MP Drivers. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 468
Перед установкой MP Drivers. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 469
Установка MP Drivers. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 470
Печать с помощью прикладной программы Canon. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 471
Руководство по My Image Garden. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 472
Печать с помощью веб-службы. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 473
Использование PIXMA/MAXIFY Cloud Link. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 48
Печать с помощью Google Cloud Print. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 475
Получение учетной записи Google. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 477
Регистрация устройства в Google Cloud Print. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 478
Печать с компьютера или смартфона с помощью Google Cloud Print. . . . . . . . . . . . . . . 480
Удаление устройства из Google Cloud Print. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 484
Печать на принтере, совместимом с AirPrint, с компьютеров Mac. . . . . . . . . . . . . . . . . . . . . . . . . 486
Печать со смартфона или планшета. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 488
Печать непосредственно со смартфона или планшета. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 489
Печать с устройств Android. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 490
Печать с принтера, совместимого с AirPrint, с помощью устройства iOS. . . . . . . . . . . . . . . . 491
Использование устройства в режиме точки доступа. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 495
Печать с помощью веб-службы. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 498
Использование PIXMA/MAXIFY Cloud Link. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 48
Печать с помощью Google Cloud Print. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 475
Печать с цифрового фотоаппарата. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 502
Печать фотографий непосредственно с PictBridge-совместимого устройства (беспроводная сеть).
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 503
Параметры печати PictBridge (беспроводная сеть). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 505
Копирование. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 507
8

Создание копий на обычной бумаге. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 508
Копирование на фотобумагу. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 510
Выбор размера страницы между A4 и Letter. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 511
Копирование со смартфона или планшета. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 512
Сканирование. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 513
Сканирование с компьютера (Windows). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 514
Использование программы IJ Scan Utility. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 515
Предназначение программы IJ Scan Utility (программное обеспечение сканера). . . . . . . . . 516
Запуск программы IJ Scan Utility. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 518
Удобное сканирование с использованием функции автоматического сканирования. . . . . . 519
Сканирование документов. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 521
Сканирование фотографий. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 522
Сканирование с избранными настройками. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 523
Сканирование оригиналов, превышающих по размеру рабочую поверхность (Совмещение
изображений). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 524
Настройка рамок обрезки в окне Совмещение изображений. . . . . . . . . . . . . . . . . . . . . 529
Сканирование нескольких оригиналов в один прием. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 530
Сохранение после проверки результатов сканирования. . . . . . . . . . . . . . . . . . . . . . . . . . . . . 534
Отправка отсканированных изображений по электронной почте. . . . . . . . . . . . . . . . . . . . . . 537
Извлечение текста из отсканированных изображений (OCR). . . . . . . . . . . . . . . . . . . . . . . . . 540
Экраны программы IJ Scan Utility. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 544
Основной экран программы IJ Scan Utility. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 545
Диалоговое окно «Параметры». . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 547
Диалоговое окно Сохранить параметры. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 582
Окно Совмещение изображений. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 585
Сканирование с помощью приложения (ScanGear). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 590
Назначение программы ScanGear (драйвера сканера). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 591
Сканирование с расширенными настройками с помощью программы ScanGear (драйвера
сканера). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 593
Запуск программы ScanGear (драйвер сканера). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 594
Сканирование в основном режиме. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 595
Сканирование в расширенном режиме. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 598
Сканирование нескольких документов в один прием из УАПД (устройство
автоматической подачи документов) в расширенном режиме. . . . . . . . . . . . . . . . . . . . 601
Сканирование нескольких документов в один прием с помощью программы ScanGear
(драйвера сканера). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 603
Исправление изображений и настройка цветов с помощью программы ScanGear (драйвера
сканера). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 607

Корректировка изображений (Скрыть нечеткость, Убрать пыль и царапины, Коррекция
выцветания и т.д.). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 608
Настройка цветов с помощью цветного образца. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 612
Настройка насыщенности и баланса цвета. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 614
Настройка яркости и контрастности. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 616
Настройка гистограммы. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 619
Настройка кривой тона. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 623
Настройка порогового значения. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 626
Окна программы ScanGear (драйвер сканера). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 627
Вкладка Основной режим. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 628
Вкладка Расш. режим. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 636
Настройка ввода. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 643
Настройки вывода. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 646
Параметры изображения. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 649
Кнопки настройки цветов. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 654
Диалоговое окно Настройка. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 657
Вкладка Сканер. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 658
Вкладка Просмотр. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 663
Вкладка Сканировать. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 665
Вкладка Параметры цвета. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 666
Размещение оригиналов (сканирование с компьютера). . . . . . . . . . . . . . . . . . . . . . . . . . . . . 668
Настройка рамок обрезки (ScanGear). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 671
Общие замечания (драйвер сканера). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 675
Другие способы сканирования. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 677
Сканирование с помощью драйвера WIA. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 678
Сканирование с помощью Панели управления (только Windows XP). . . . . . . . . . . . . . . . . . . 682
Меню и экран настройки программы IJ Network Scanner Selector EX. . . . . . . . . . . . . . . . . . . . . . . 684
Удаление программы IJ Network Scanner Selector EX. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 687
Рекомендации по сканированию. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 689
Разрешение. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 690
Форматы данных. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 692
Сопоставление цветов. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 693
Размещение оригиналов (сканирование с компьютера). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 694
Параметры сетевого сканирования. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 696
Сканирование с компьютера (Mac OS). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 699
Сканирование с помощью смартфона/планшета. . . . . . . . . . . . . . . . . . . . . . . . . . . . 700
Использование PIXMA/MAXIFY Cloud Link. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 48

Устранение неполадок. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 702
Проблемы сетевого взаимодействия. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 704
Не удается обнаружить устройство в сети. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 705
Не удается обнаружить устройство на экране «Проверить параметры принтера». . . . . . . . 706
Не удается обнаружить устройство во время настройки беспроводной сети: проверка 1.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 707
Не удается обнаружить устройство во время настройки беспроводной сети: проверка 2.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 708
Не удается обнаружить устройство во время настройки беспроводной сети: проверка 3.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 710
Не удается обнаружить устройство во время настройки беспроводной сети: проверка 4.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 711
Не удается обнаружить устройство на экране «Список подключенных к сети принтеров». 712
Невозможно продолжить работу после появления экранов подключения принтера/
подключения кабеля. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 713
Не удается обнаружить устройство в беспроводной сети. . . . . . . . . . . . . . . . . . . . . . . . . . . . 715
Проблемы сетевого подключения. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 718
Устройство неожиданно невозможно использовать. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 719
Неизвестный ключ сети. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 723
Неизвестный пароль администратора, установленный на устройстве. . . . . . . . . . . . . . . . . . 725
Не удается использовать устройство после замены маршрутизатора беспроводной сети или
изменения его параметров. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 726
Низкая скорость печати. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 728
Уровень чернил не отображается на мониторе состояния принтера (Windows). . . . . . . . . . 729
Другие проблемы с сетью. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 730
Во время настройки на компьютере отображается сообщение. . . . . . . . . . . . . . . . . . . . . . . 731
Пакеты отправляются непрерывно (Windows). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 733
Проверка сведений о сети. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 734
Восстановление заводских настроек по умолчанию. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 737
Проблемы при печати или сканировании со смартфона или планшета. . . . . . . . . . 738
Не удается выполнить печать или сканирование со смартфона или планшета. . . . . . . . . . . . . . 739
Проблемы с печатью. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 742
Печать не начинается. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 743
Замятие бумаги. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 746
Неудовлетворительные результаты печати. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 747
Не удается выполнить печать. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 749
Часть страницы не печатается (Windows). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 750
Пустая бумага/Нечеткая печать/Неверные цвета/Белые полосы. . . . . . . . . . . . . . . . . . . . . . 751
11

Неверные цвета. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 754
Линии не выровнены. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 756
Неполные или отсутствующие линии (Windows). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 757
Неполные или отсутствующие изображения (Windows). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 758
Чернильные пятна / Сворачивание бумаги. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 759
Бумага испачкана / Отпечатанная поверхность поцарапана. . . . . . . . . . . . . . . . . . . . . . . . . . 760
Обратная сторона бумаги испачкана. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 764
Вертикальная линия рядом с изображением. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 765
Цвета передаются неравномерно. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 766
Чернила не поступают. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 768
Бумага подается неправильно, или появилось сообщение об отсутствии бумаги. . . . . . . . . . . . 769
Проблемы автоматической двухсторонней печати. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 771
Остановка копирования/печати. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 773
Не удается выполнить печать с помощью AirPrint. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 774
Проблемы при сканировании (Windows). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 775
Проблемы при сканировании. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 776
Сканер не работает. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 777
ScanGear (драйвер сканера) не запускается. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 778
Отображается сообщение об ошибке, и окно ScanGear (драйвер сканера) не открывается 779
Не удается одновременно отсканировать несколько оригиналов. . . . . . . . . . . . . . . . . . . . . . 780
Не удается правильно выполнить сканирование с помощью функции автоматического
сканирования. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 781
Низкая скорость сканирования. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 782
Появляется сообщение «Недостаточно памяти.». . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 783
Компьютер перестает работать во время сканирования. . . . . . . . . . . . . . . . . . . . . . . . . . . . . 784
Сканер не работает после обновления Windows. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 785
Отсканированное изображение не открывается. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 787
Неудовлетворительные результаты сканирования. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 788
Плохое качество сканирования (изображение, отображаемое на мониторе). . . . . . . . . . . . 789
Белые области вокруг отсканированного изображения. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 791
Не удается отсканировать изображение в правильном размере. . . . . . . . . . . . . . . . . . . . . . 792
Оригинал установлен правильно, но отсканированное изображение наклонено. . . . . . . . . 793
Отсканированное изображение на мониторе компьютера увеличено (уменьшено). . . . . . . 794
Неполадки программного обеспечения. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 795
Требуемый почтовый клиент не отображается на экране выбора почтового клиента. . . . . 796
Сообщения об ошибках IJ Scan Utility. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 797
Сообщения об ошибках ScanGear (драйвера сканера). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 799
Механические неисправности. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 803

Питание не подается. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 804
Питание выключается автоматически. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 805
Проблемы подключения USB. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 806
Не удается подключиться к устройству по USB. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 807
Не отображается окно монитора состояния принтера (Windows). . . . . . . . . . . . . . . . . . . . . . . . . . 808
Проблемы при установке и загрузке. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 809
Не удается установить драйверы MP Drivers. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 810
Easy-WebPrint EX не запускается, или меню Easy-WebPrint EX не отображается (Windows). . . 812
Обновление MP Drivers в сетевом окружении (Windows). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 813
Удаление IJ Network Tool. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 814
Ошибки и сообщения. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 816
Произошла ошибка. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 817
Отображается сообщение. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 820
На PictBridge-совместимом устройстве (беспроводная сеть) появилось сообщение об ошибке. 828
Если не удается устранить проблему. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 830
Список кодов поддержки для ошибок. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 831
Список кодов поддержки для ошибок (замятия бумаги). . . . . . . . . . . . . . . . . . . . . . . 833
1300. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 834
1303. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 836
1304. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 839
Бумага замялась в устройстве. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 842
Другие причины. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 845
1003. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 846
1200. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 847
1202. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 848
1250. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 849
1310. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 850
1401. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 851
1403. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 852
1485. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 853
1486. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 854
1487. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 855
1682. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 856
1684. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 857
1686. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 858

1687. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 859
1688. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 860
1702. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 861
1703. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 862
1704. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 863
1705. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 864
1712. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 865
1713. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 866
1714. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 867
1715. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 868
1890. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 869
2100. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 870
2101. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 871
2102. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 872
2103. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 873
2900. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 874
2901. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 875
3402. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 876
3403. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 877
3405. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 878
3412. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 879
4100. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 880
4103. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 881
5011. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 882
5012. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 883
5050. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 884
5100. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 885
5200. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 886
5400. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 887
5B02. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 888
5B03. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 889
5B04. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 890
5B05. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 891
5B12. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 892

5B13. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 893
5B14. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 894
5B15. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 895
6000. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 896
6500. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 897
6800. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 898
6801. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 899
6900. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 900
6901. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 901
6902. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 902
6910. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 903
6911. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 904
6930. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 905
6931. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 906
6932. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 907
6933. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 908
6936. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 909
6937. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 910
6938. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 911
6940. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 912
6941. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 913
6942. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 914
6943. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 915
6944. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 916
6945. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 917
6946. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 918
B202. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 919
B203. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 920
B204. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 921
B205. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 922

Замечания по использованию сайта и файлов cookie
Замечания по использованию сайта
Порядок печати
Замечания по использованию сайта
•
Через пять лет после прекращения выпуска продукта файл настройки становится недоступным.
Онлайн-руководство остается доступным, но, как правило, не обновляется.
•
При просмотре данного сайта обратите внимание на следующее:
◦
Для получения лучших результатов включите JavaScript в настройках браузера.
◦
Для отображения веб-страниц в соответствии со средой Canon может отправить на Ваш
компьютер, смартфон или планшет один или несколько файлов cookie. Большинство
браузеров автоматически принимают файлы cookie, однако настройки браузера можно
изменить, чтобы не принимать файлы cookie. Если файлы cookie не будут приняты,
некоторые функции данного веб-сайта могут не работать.
◦
Если в Internet Explorer 8 используется режим совместимости, возможно некорректное
отображение некоторых страниц.
В этом случае следует отключить режим совместимости.
•
Частичное или полное воспроизведение, изменение или копирование текста, фотографий или
изображений, приведенных на данном сайте, запрещены.
•
В принципе, компания Canon может изменять или удалять содержимое этого сайта без
предварительного уведомления клиентов. Кроме того, компания Canon может приостановить
или остановить публикацию этого сайта по неизбежным причинам. Компания Canon не несет
ответственности за любой ущерб, нанесенный клиентам в результате изменения или удаления
информации на этом сайте или приостановки/остановки публикации этого руководства.
•
Хотя содержимое этого сайта было подготовлено очень тщательно, обратитесь в сервисный
центр при обнаружении неправильных или недостаточных сведений.
•
В основном описания на этом сайте основаны на продуктах, используемых при
первоначальных продажах.
•
На этом сайте не приводятся данные всех руководств по продуктам, выпускаемым компанией
Canon. См. руководство, поставляемое вместе с продуктом, при использовании продукта, не
описанного на этом сайте.
Порядок печати
Используйте функцию печати веб-браузера для печати этого сайта.
Для Windows:
Чтобы установить печать фоновых цветов и изображений, выполните указанные ниже шаги.
Примечание.
•
В Windows 8, выполните печать в версии для настольного компьютера.
•
В Internet Explorer 9, 10 или 11
1.
Выберите (Инструменты) > Печать (Print) > Параметры страницы… (Page
setup…).
2.
Установите флажок Печатать цвета и рисунки фона (Print Background Colors and
Images).
16
• В Internet Explorer 8
1. Нажмите клавишу Alt, чтобы отобразить меню.
Другой способ отобразить меню: выберите в пункте Сервис (Tools) Панели
инструментов (Toolbars) > Строка меню (Menu Bar).
2. Выберите Параметры страницы… (Page Setup…) в меню Файл (File).
3. Установите флажок Печатать цвета и рисунки фона (Print Background Colors and
Images).
•
В Mozilla Firefox
1.
Выберите (Меню) > Печать (Print) > Параметры страницы… (Page Setup…).
2.
Установите флажок Печать фона (цвета и изображения) (Print Background (colors &
images)) на вкладке Формат и свойства (Format & Options).
•
В Google Chrome
1.
Выберите (Меню Chrome) > Печать… (Print…).
2.
Установите флажок Фон (Background graphics) на вкладке Параметры (Options).
Для Mac OS:
Для печати фоновых цветов и изображений следуйте приведенным ниже действиям для
отображения параметров диалогового окна печати, затем установите флажок Печать фона
(Print backgrounds).
1.
Щелкните Печать… (Print…) в меню Файл (File).
2.
Щелкните Подробнее (Show Details) или (стрелка вниз).
3.
Выберите Safari во всплывающем меню.
17
